Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Cubana de Higiene y Epidemiología
versión On-line ISSN 1561-3003
Rev Cubana Hig Epidemiol vol.50 no.2 Ciudad de la Habana Mayo-ago. 2012
ARTÍCULO DE REVISIÓN
Enfermedad de Lyme: historia, microbiología, epizootiología y epidemiología
Lyme disease: history, microbiology, epizootiology and epidemiology
MSc. Orestes Herrera Lorenzo,I Dr. José Infante Ferrer,I Dr. Carlos Ramírez Reyes,II Dr. Hugo Lavastida HernándezIII
I Departamento de Neurología. Hospital Universitario "Manuel Ascunce Domenech". Camagüey. Cuba.
I Hospital Universitario "Manuel Ascunce Domenech". Camagüey, Cuba.
II Hospital Municipal "Chang Puga". Nuevitas, Camagüey, Cuba.
III Hospital Militar "Octavio de la Concepción y Pedraja". Camagüey, Cuba.
RESUMEN
Objetivo: teniendo en cuenta el riesgo potencial que para Cuba constituye la presencia del agente trasmisor, los autores consideran importante la revisión del tema con vistas a una actualización de los especialistas y demás entidades del sistema de salud que puedan intervenir en la vigilancia y control epidemiológico de esta enfermedad.
Desarrollo: se comenta la historia de la enfermedad, la microbiología, la epizootiología y la epidemiología, así como las manifestaciones clínicas en los principales animales domésticos.
Conclusiones: la borreliosis de Lyme es una nueva enfermedad infecciosa; comparte como otras borrelias y espiroquetas su afinidad por el sistema nervioso central y el sistema nervioso periférico, y se convierte en un diagnóstico de exclusión optimista en Neurología. Conocer sus vectores, su distribución geográfica y algunas de las características biológicas específicas de esta nueva especie de borrelia es de suma importancia para el médico práctico de este nuevo siglo, donde la inmunología y la biología molecular iluminan el oscuro camino de viejas y nuevas interrogantes.
Palabras clave: borreliosis de Lyme, Ixodes ricinus, eritema migrans, Allen Steere, Willy Burgdorfer, B. burgdorferi, Elisa IgG y Elisa IgM, Western Blot.
ABSTRACT
Objective: bearing in mind the risk posed by the presence of the vector of Lyme disease in Cuba, the authors have considered it necessary to carry out a review of the disease with the purpose of contributing updated information to specialists and health institutions involved in its surveillance and epidemiological control.
Content: a discussion is presented of the history, microbiology, epizootiology and epidemiology of Lyme disease, as well as its clinical manifestations in the main domestic animal hosts.
Conclusions: Lyme borreliosis is a new infectious disease. Like other borrelias and spirochetes, it has an affinity for the central nervous system and the peripheral nervous system, thus becoming a diagnosis of optimistic exclusion in neurology. Knowledge about the vectors, geographic distribution and some specific biological characteristics of this new borrelia species is crucial for practitioners of the 21st century, a time when immunology and molecular biology shed new light on old and new questions alike.
Key words: Lyme borreliosis, Ixodes ricinus, eritema migrans, Allen Steere, Willy Burgdorfer, B. burgdorferi, Elisa IgG, Elisa IgM, Western Blot.
INTRODUCCIÓN
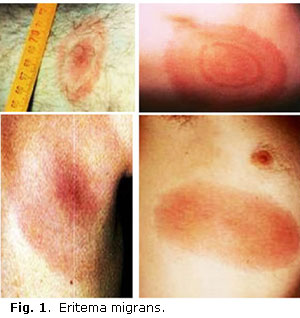
La enfermedad de Lyme, afección multisistémica de comienzo agudo y evolución subaguda o crónica, descrita por primera vez hace ya algunos años, ha llegado a convertirse en la enfermedad transmisible por artrópodos, más frecuente en los EE.UU.1,2 Característicamente, aparece en los meses de verano en forma de una mácula cutánea, patognomónica, llamada eritema migrans (EM), que se desarrolla en el sitio de la picadura de la garrapata y provoca posteriormente una respuesta inmunológica anormal, que días, semanas o meses después da lugar a manifestaciones neurológicas, cardíacas o reumatológicas, principalmente (Fig. 1).3-5
Clínicamente esta enfermedad es muy parecida a la sífilis por su carácter sistémico y su ocurrencia por estadios. El espectro clínico de la enfermedad se ha ido delimitando, aunque persistan enconadas discusiones, sobre todo relacionadas con las manifestaciones neurológicas crónicas.5-8
Las especies de borrelias, al igual que las leptospiras y treponemas, pertenecen al género de las espiroquetas. Es un organismo fastidious y microaerofílico que crece mejor a 30-35 oC en un complejo medio de cultivo líquido nombrado BSK II. El vector principal de la borreliosis de Lyme es una garrapata del género Ixodes (garrapata dura). Son vectores competentes: I. scapularis, I. pacificus e I. persulcatus, todas pertenecientes al complejo Ixodes ricinus.9-11 La borreliosis de Lyme, desde su descripción original a mediados de los 70, ha sido reportada en 46 estados de la Unión Americana, Europa, antigua URSS, China, Japón, África, América del Sur, Australia y en el Ártico, aunque en estas tres últimas regiones no ha sido confirmada por aislamientos.12-15
Más de 40 000 casos han sido reportados al Centro para el Control y Prevención de Enfermedades (CDC) de Atlanta desde 1982 a 1991 con tendencia al crecimiento, tanto en EE.UU. y Canadá, como en Europa.16,17
La borreliosis de Lyme es una zoonosis donde el hombre es un hospedero accidental del agente causal. No se conoce que existan diferencias genéticas en humanos relacionadas con la susceptibilidad para la infección y es también desconocido cómo puede desarrollarse la inmunidad protectora adquirida.
Dado el riesgo potencial que para Cuba constituye la presencia del agente trasmisor, los autores consideran importante la revisión del tema con vistas a una actualización de los especialistas y demás entidades del sistema de salud que puedan intervenir en la vigilancia y control epidemiológico de esta enfermedad. No obstante, la historia de la enfermedad de Lyme en Cuba es controversial y los primeros casos posibles han sido publicados por Rodríguez y otros en el 2003, por evidencias serológicas y clínicas,18-20 sin que se haya logrado el aislamiento de la borrelia en humanos o en sus vectores potenciales.
En el área de Latinoamérica y el Caribe se conoce muy poco sobre la presencia de esta borreliosis; solo se han encontrado reportes de evidencias serológicas en Perú, Bolivia, Brasil y México.21
DESARROLLO
Desde que en octubre de 1975 dos madres le comunicaron al Departamento de Salud de Connecticut que un número importante de los hijos de mujeres de tres pequeñas comunidades (Old Lyme, Lyme e East Haddam) estaban sufriendo una artritis reumatoidea juvenil, un grupo de reumatólogos de la Universidad de Yale, encabezados por el profesor Allen Steere, Malawista y otros, describieron la enfermedad con el nombre de artritis de Lyme y hallaron una prevalencia de 12,2 por 1 000, frecuencia 100 veces superior a la artritis reumatoide juvenil en EE.UU.1,2,22
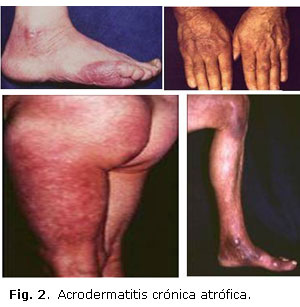
Ya los primeros estudios sugirieron evidencias epidemiológicas de que se diseminaba por la picadura de una garrapata. El rash eritematoso característico que precede a la artritis había sido descrito en 1909 por un dermatólogo sueco, Afzelius, con el nombre de eritema migrans, y adelantó la posibilidad de que fuera causado por picadura de garrapatas o algún otro insecto,23 pero la primera descripción de esta enfermedad correspondió a Buchwald en 1883, quien reportó una lesión atrófica de la piel, llamada por Herxheimer y Hartmann en 1902 acrodermatitis crónica atrófica (Fig. 2). En 1922 Garin y Bujadoux reportaron una paciente picada por garrapata que presentó el eritema y posteriormente desarrolló dolor radicular con parálisis de un brazo y pleocitosis del líquido cefalorraquídeo (LCR).24 Hellestrom, otro dermatólogo sueco, describió en 1930 un paciente con EM y meningitis, y asoció ambas enfermedades. En 1941 y 1944, Bannwarth describió pacientes con meningitis crónica y radículo neuropatía con o sin parálisis de nervios craneales, síndrome que hoy lleva su nombre y es patognomónico de la neuroborreliosis temprana.25
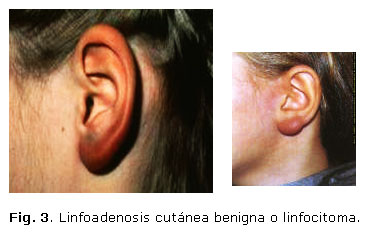
La linfoadenosis cutánea benigna o linfocitoma (Fig.3) fue descrita por otro dermatólogo sueco, Bafverstedt, en 1943 y la relacionó con la acrodermatitis crónica atrófica (ACA). En 1948 Lennhoff demostró la presencia de espiroquetas en las biopsias de piel en casos de EM (Fig. 4),26 lo que inspiró a Hellestrom a usar penicilina para su tratamiento en 1951.27
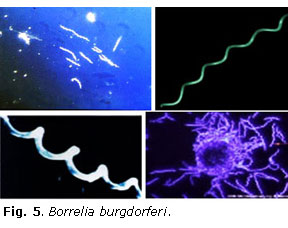
En 1982 Willy Burgdorfer y Allan Barbour describieron y cultivaron un nuevo agente biológico a partir de la sangre obtenida del tubo digestivo de una garrapata del género Ixodes, al que Jhonson denominó Borrelia burgdorferi en 1984 (Fig. 5).28,29 Esta espiroqueta, entonces desconocida, fue aislada posteriormente por Steere y Benach de los pacientes con artritis de Lyme. Ackermann y Asbrink y Preac-Mursic en Europa la aislaron en pacientes de EM y síndrome de bannwarth, respectivamente. Así se demostró el carácter sistémico e infeccioso de la nueva enfermedad, conocida hoy como enfermedad de Lyme o borreliosis de Lyme.
Clínicamente esta enfermedad es muy parecida a la sífilis por su carácter sistémico y ocurrencia por estadios. Es por eso que Pachner la nombró "la nueva gran imitadora". Aunque muchas de sus facetas son aún desconocidas, ha aumentado el interés investigativo y en la década de los 90 se publicó un artículo semanal. El espectro clínico de la enfermedad se ha ido delimitando, aunque persistan enconadas discusiones, sobre todo relacionadas con las manifestaciones neurológicas crónicas.
MICROBIOLOGÍA
Las especies de borrelias, al igual que las leptospiras y treponemas, pertenecen al género de las espiroquetas. Están constituidas por un cilindro protoplasmático rodeado por la membrana celular. Tienen de 7 a 11 flagelos y una cubierta exterior donde se encuentran las proteínas antigénicas Osp A (de 30-32 Kd), Osp B (de 34-36 Kd ) y Osp C. La Borrelia burgdorferi es la más larga de las borrelias (20 a 30 micras) y la más estrecha (0,2 a 0,3 micras), aunque puede tomar de 4 a 30 micras de largo. Es un organismo fastidious y microaerofílico que crece mejor a 30-35 oC en un complejo medio de cultivo líquido nombrado BSK II (Barbour-Stonner-Kelly). Tiene un crecimiento lento y se divide por fisión binaria en 12-24 horas. El cultivo de la Borrelia burgdorferi, obtenido de garrapatas, es relativamente fácil, mientras que de los pacientes solamente se ha podido obtener en muy pocos laboratorios (Fig. 6).10
La Borrelia burgdorferi sensulato ha sido dividida en tres genoespecies30,31 relacionadas con diferentes manifestaciones clínicas, de acuerdo con su patrón proteico, reactividad con anticuerpos monoclonales, PCR y RNA gene - análisis, como se muestra a continuación:
1) B. burgdorferi sensu stricto. Predomina en EE.UU. y se asocia a manifestaciones articulares predominantemente.
2) B. burgdorferi Afzeli (group VS 461). Predomina en Europa y EE.UU. y se asocia a manifestaciones crónicas de la piel (ACA).
3) B. burgdorferi Garini. Predomina en los aislamientos de Europa y se asocia a manifestaciones extracutáneas, principalmente neurológicas.
EPIZOOTIOLOGÍA
Vectores y reservorios
El vector principal de la borreliosis de Lyme es una garrapata del género Ixodes (garrapata dura). Son vectores competentes: I. scapularis, I. pacificus e I. persulcatus, todas pertenecientes al complejo Ixodes ricinus.32,33 La Ixodes dammini se distribuye en el nordeste y norte central de EE.UU., la I. Scapularis desde Virginia hasta el sur de la Florida y la región central de Texas, mientras la I. pacificus se encuentra en la costa del océano Pacífico. En Europa predomina la I. ricinus y la I. persulcatus. Todas son garrapatas de tres hospederos (Fig. 7):
1) Los huevos. De ellos surgen larvas que se alimentan de la sangre de roedores pequeños durante 3 a 5 días y después se dejan caer al suelo para convertirse en ninfas, que se alimentan de igual forma de un reservorio animal para repetir el ciclo. Estas ninfas mudan en el suelo o en otro animal y se transforman en adultos. Son muy activos de mayo a agosto, meses cuando es más frecuente encontrar el mayor número de casos. Al diferenciarse en masculinos y femeninos los individuos se reproducen en un reservorio habitualmente de mayor tamaño y la hembra se repleta de sangre para dejarse caer nuevamente al suelo, depositan millares de huevos y completan sus dos años de existencia.34,35
2) Las garrapatas inmaduras (larvas y ninfas). Se alimentan de diversas especies de animales. La I. ricinus, por ejemplo, ha sido encontrada en 317 diferentes especies (148 mamíferos, 149 aves y 20 tipos de reptiles).36-39 Los humanos se infectan en las áreas boscosas y húmedas, pero en algunos lugares de EE.UU. han sido adquiridos en parques y en los patios que circundan las viviendas. Ciertas especies de hospederos tienen mayor importancia en el ciclo biológico de estas garrapatas.
3) El Apodemus leucopus (ratón de patas blancas). Es el hospedero competente en EE.UU., mientras que el Apodemus flaviculus es el de mayor importancia en Europa. El venado (Odocoileus virginianus) es un importante hospedero para la garrapata adulta; sin embargo, no lo es para las infectadas con Borrelia burgdorferi. Estudios en tal sentido han demostrado que sin la presencia del venado disminuye notablemente el número de garrapatas.40-44
Otros vectores
Otros géneros de garrapatas, tales como el Amblioma americanus, y Dermacenter variabilis han sido reportados como vectores potenciales de la Borrelia burgdorferi. Otros insectos hematófagos, como mosquitos, pulgas y ciertas especies de moscas, han sido reportados como vectores potenciales, aunque parecen tener menor importancia en la dinámica de transmisión al humano.45,46 Los piojos animales y humanos, tan importantes en la transmisión de otras borrelias, no han sido estudiados en la borreliosis de Lyme (Magnanelli, comunicación personal).
EPIDEMIOLOGÍA
Borreliosis de Lyme en humanos
La borreliosis de Lyme desde su descripción original a mediados de los 70 ha sido reportada en 46 estados de la Unión Americana, Europa, antigua URSS, China, Japón, África, América del Sur y Australia, aunque en estas tres últimas regiones no ha sido confirmada por aislamientos.
Más de 40 000 casos han sido reportados al CDC de Atlanta desde 1982 a 1991 con tendencia al crecimiento, tanto en EE.UU. y Canadá, como en Europa.16,17,41
La borreliosis de Lyme es una zoonosis donde el hombre es un hospedero accidental del agente causal. Para la transmisión de esta enfermedad es necesario que la garrapata infectada se mantenga adherida a la piel por un período de no menos de 24 horas. La puerta de entrada es la piel, la diseminación es cutánea, linfática y hematógena. El período de incubación es de días a semanas (desde la picadura hasta la aparición del EM). No todos los pacientes recuerdan el EM y en otros nunca aparece, y semanas o meses después comienzan las manifestaciones crónicas, aunque se desconoce la duración de la infección en los humanos. La infección asintomática es probablemente común. No se conoce que existan diferencias genéticas en humanos relacionadas con la susceptibilidad para la infección y es también desconocido cómo puede desarrollarse inmunidad protectora adquirida. Por otra parte, no se han reportado casos de reinfección.47
Borreliosis de Lyme en animales domésticos
Perros: entre el 40 y el 89 % de los perros son seropositivos en las áreas endémicas. La mayoría tiene una infección asintomática y solo el 5 % desarrolla manifestaciones clínicas tales como: comienzo agudo con una o varias articulaciones inflamadas y cojera, fiebre y depresión. Una presentación menos común es una cojera por toma de una sola articulación con fiebre baja o ausente, que representa una infección crónica. Las articulaciones más frecuentemente afectadas incluyen el carpo, codo y tarso. Otras manifestaciones son la miocarditis, el fallo renal, las convulsiones y los cambios de conducta.48-50
Gatos: en un área endémica la infección de los gatos es muy frecuente, pero tal vez los gatos son mucho más resistentes a desarrollar las manifestaciones clínicas, aunque pueden presentar ligera cojera que mejora fácilmente con el empleo de Amoxicillín. La infección experimental de gatos sin desarrollar manifestaciones clínicas ha logrado obtenerse a través de la vía oral, conjuntival e intravenosa. Es significativo que el ratón de patas blancas mantenga una espiroquetemia asintomática, y que los gatos, sus tradicionales cazadores, desarrollen el mayor número de las veces una infección prácticamente asintomática.49,50
Equinos: solo el 10 % de los animales seropositivos desarrollan la enfermedad. Los signos clínicos más frecuentemente reportados son: cojera, con o sin inflamación articular, a veces acompañadas de fiebre y menos frecuentemente es la cojera, uveítis, encefalitis, abortos frecuentes y letargia; sin embargo, mucho debemos aprender todavía de la borreleosis de Lyme en las especies equinas.51,52
Vacunos: aunque probablemente está muy extendida la infección en las áreas endémicas, poco se conoce del curso natural en estas especies. El parasitismo por Ixodes es común en el ganado, sobre todo el de las formas adultas. La vía oral ha sido postulada como la forma de infección más probable del ganado. Es probable que la Borrelia burgdorferi muera rápidamente por deshidratación; sin embargo, el contacto directo con las mucosas o lesiones de la piel pueden ser los factores que favorecen la infección. Se ha demostrado la presencia de la Borrelia burgdorferi en la sangre, calostro, leche, líquido sinovial y tejidos fetales procedentes de abortos del ganado infectado. Estudios experimentales recientes demuestran la supervivencia de la Borrelia burgdorferi en la leche refrigerada durante largos períodos de tiempo, por lo que se ha pensado en otra probable vía de infección de extraordinaria importancia para el humano.53-55 Las principales manifestaciones clínicas reportadas son: fiebre, cojera, rash eritematoso, pérdida crónica de peso, disminución de la producción de leche, abortos espontáneos y muertes fetales frecuentes.
Ovinos: solo un pequeño número de casos han sido reportados. Los principales signos clínicos incluyen cojera y deterioro físico marcado. La prevalencia y la patogénesis de la infección natural son totalmente desconocidas.56
CONCLUSIONES
La borreliosis de Lyme, desde el punto de vista histórico, tuvo su primera descripción en una pequeña comunidad de los EE. UU, donde las manifestaciones reumatológicas (artritis) fueron consideradas e interpretadas como una artritis reumatoidea juvenil. Hoy conocemos sus manifestaciones sistémicas, así como su predilección por presentar lesiones dermatológicas, tanto en su estadio inicial como tardío, aunque lesiones tales como el eritema migrans, linfocitoma y acrodermatitis crónica atrófica fueron descritas por dermatólogos suecos de principios del siglo XX y son en la actualidad lesiones que caracterizan a la enfermedad de Lyme. Manifestaciones neurológicas asociadas a picaduras de garrapatas fueron reportadas brillantemente por investigadores europeos, quienes describieron el síndrome de Garin- Bujadoux- Bannwarth, hoy conocido como patognomónico de la neuroborreliosis temprana que, gracias al espectacular aislamiento de Willy Burgdorfer de la borrelia en 1982, y en honor a su descubridor, lleva hoy su nombre. Otras manifestaciones cardiovasculares, articulares y neurológicas descritas previamente tuvieron en la Borrelia burgdorferi una causa conocida y un tratamiento específico.
Desde el punto de vista microbiológico podemos concluir que la Borrelia burgdorferi es la más larga de las borrelias (20 a 30 micras) y la más estrecha (0,2 a 0,3 micras), aunque puede tomar de 4 a 30 micras de largo. Es un organismo fastidious y microaerofílico que crece mejor a 30-35 oC en un complejo medio de cultivo líquido nombrado BSK II (Barbour-Stonner-Kelly). Tiene un crecimiento lento y se divide por fisión binaria en 12-24 horas.
El vector principal de la borreliosis de Lyme es una garrapata del género Ixodes (garrapata dura). Son vectores competentes: I. Scapularis, I. Pacificus e I. Persulcatus, todas pertenecientes al complejo Ixodes ricinus.
El Apodemus leucopus (ratón de patas blancas) es el hospedero competente en EE.UU., mientras que el Apodemus flaviculus es el de mayor importancia en Europa. El venado (Odocoileus virginianus) es un importante hospedero para la garrapata adulta; sin embargo, no lo es para las infectadas con Borrelia burgdorferi, pero es imprescindible en el ciclo biológico y en la población de las garrapatas adultas.
La epidemiologia de borreliosis de Lyme ha sido reportada en 46 estados de la Unión Americana, Europa, antigua URSS, China, Japón, África, América del Sur y Central, así como en Australia, aunque en estas tres últimas regiones no ha sido confirmada por aislamientos. Es la enfermedad más frecuente trasmitida por artrópodos en los EE.UU. y en los países europeos, donde constituye un serio problema de salud.
Las principales manifestaciones aparecen en los animales domésticos tales como perros, donde la mayoría tiene una infección asintomática. Los gatos son mucho más resistentes a desarrollar las manifestaciones clínicas, aunque pueden presentar una ligera cojera. Es significativo que el ratón de patas blancas mantenga una espiroquetemia asintomática y los gatos, sus tradicionales cazadores, desarrollen el mayor número de las veces una infección prácticamente asintomática; en los equinos, sin embargo, solo el 10 % de los animales seropositivos desarrollan la enfermedad y es principalmente articular. En el ganado vacuno las principales manifestaciones clínicas reportadas son: fiebre, cojera, rash eritematoso, pérdida crónica de peso, disminución de la producción de leche, abortos espontáneos y muertes fetales frecuentes.
Los autores consideran necesario un conocimiento elemental de la borreliosis de Lyme para el médico práctico de este nuevo siglo y aunque no constituye un peligro inmediato para Cuba, la relación de los animales domésticos y afectivos con el humano obliga a los profesionales de la salud a conocer las principales manifestaciones clínicas en estas especies y el potencial riesgo de contagio ante esta nueva zoonosis.
REFERENCIAS BIBLIOGRÁFICAS
1. Steere AC, Malawista SE, Snydman DR, Shope RE. Andiman WA, Ross MR, et al. Lyme arthritis: an epidemic of oligoarticular arthritis in children and adults in three Connecticut communities. Arthritis Reum. 1977;20:7-17.
2. Steere AC. Malawista SE, Bartenhagen NH, Batsferd WP, Weinberg M. The clinical spectrum and treatment of Lyme disease. Yale J Biol Med. 1984;57(4):453- 61.
3. Savely VR. Update on Lyme disease: the hidden epidemic. J Infus Nurs. 2008;31(4):236-40.
4. Bratton RL, Whiteside JW, Hovan MJ, Engle RL, Edwards FD. Diagnosis and treatment of Lyme disease. Mayo Clin Proc. 2008;83(5):566-71.
5. Marques A. Chronic Lyme disease: a review. Infect Dis Clin North Am. 2008;22(2):341-60.
6. Pavia CS. The Lyme disease controversies continue. Expert Opin Investig Druga. 2003;12(10):1615-20.
7. Steere AC, Cobum J, Glidutein L. The emergence of Lyme disease. J Clin Invest. 2004; 113(8):1093-101.
8. Lovett JK, Evans PH, O'Connell S, Gutowski NJ. Neuroborreliosis in the South West of England. Epidemiol Infect. 2008;136(12):1707-1.
9. Johnson RC, Schmed GP, Hyde FW, Steigerwalt AG, Brenner DJ. Borrelia burgdorferi sp.: Etiologic agent of Lyme disease. Int J Syst Bacteriol [Internet]. 1984 [cited Jan 24 2011];34(4):496-7. Available from: http://ijs.sgmjournals.org/content/34/4/496.full.pdf+html
10. Barbour AG, Rayes SF. Biology of Borrelias species. Microbiol Rev [Internet]. 1986; [ cited Jan 24 2011] 50(4):381-400. Available from: http://www.ncbi.nlm.nih.gov/pmc/articles/PMC373079/pdf/microrev00055-0033.pdf
11. Barbour AG, Jasinskas A, Kayala MA, Davies DH, Steere AC, Baldi P, Felgner PL. A genome-wide proteome array reveals a limited set of immunogens in natural infections of humans and white-footed mice with Borrelia burgdorferi. Infect Immun. 2008;76(8):3374-89.
12. Anderson JF. Epizootiology of Borrelia in Ixodes tick vectors and reservoir hosts. Rew infect. Dis 1989;11(Suppl. 6):31451-9.
13. Schmid GP. The global distribution of Lyme disease. Yale J Biol Med [Internet]. 1984 [cited Jan 24 2011]57(4):617-8. Available from: http://www.ncbi.nlm.nih.gov/pmc/articles/PMC2590002/pdf/yjbm00100-0165.pdf
14. Dermis TD. Epidemiology. In Corle PK (Ed). Lyme disease, Mosby: Year Book; 1993. p. 27-37.
15. Larsson C, Comstedt P, Olsen B, Bergström S. First record of Lyme disease Borrelia in the Arctic. Vector Borne Zoonotic Dis. 2007;7(3):453-6.
16. Tilly K, Rosa PA, Stewart PE. Biology of infection with Borrelia burgdorferi. Infect Dis Clin North Am. 2008;22(2):217-34.
17. Killilea ME, Swei A, Lane RS, Briggs CJ, Ostfeld RS. Spatial dynamics of lyme disease: a review. Ecohealth. 2008;5(2):167-95.
18. Rodríguez I, Pedroso R, Fernández C, Cinco M, Fuentes O. Enfermedad de Lyme en Cuba? Presentación de posibles casos. Rev Cubana Med Trop. 2003;55(1):41-3.
19. Grandío O, Fernández A, Fernández M, Valera R, Fuentes O, Pelegrino J. Informe preliminar sobre investigaciones realizadas en el poblado "Las Terrazas", Sierra del Rosario, sobre la existencia de la Enfermedad de Lyme. Rev Cubana Ped. 1988;60(5):7-73.
20. Rodríguez I, Pedroso R, Fernández C, Cinco M, Fuentes O. ¿Enfermedad de Lyme en Cuba? Presentación de posibles casos. Rev Cubana Med Trop [Internet]. 2003 [citado enero 2011];55(1):41-3. Disponible en: http://bvs.sld.cu/revistas/mtr/vol55_1_03/mtr07103.htm
21. Gordillo-Pérez G, Torres J, Solórzano-Santos F, Martino S, Lipsker D, Velázquez E, et. al. Borrelia burgdorferi infection and cutaneous Lyme disease. Ciudad de México: Emerg Infect Dis. 2007;13(10):1556-8.
22. Steere AC. Lyme borreliosis in 2005, 30 years after initial observations in Lyme Connecticut. Wien Klin Wochenschr. 2006;118(21-22):625-33.
23. Afzelius A. Erythema Chronicum Migrans. Acta Derm Venerul (Stockh). 1921;2:120-5.
24. Garin C, Bujadoux C. Paralysie par les Tiques. J Med Lyon. 1922;71:765-7.
25. Barnwarth A. Chronische Lymphocytare Meningitis Entzundliche Polineuritis und «Rheumatismus». Arch Psychiatr Neruenkr. 1941;113:284-376.
26. Lennhoff C. Spinochetes in aetiologically obscum disease. Acta Derm Venereol. 1948; 28:295-324.
27. Hollstrom E. Successful treatment of Erythema Migrans Afzelius. Acta Derm venermol. 1951;31:235-43.
28. Burgdorfer W, Barbour AG, Hayes SF, Benach JL, Grunwaldt E, Davis JP. Lyme disease a tick borne spirochetosis? Science. 1982;216(4552):1317-9.
29. Johnson RC, Schmed GP, Hyde FW, Steigerwalt A, Brenner D. Borrelia burgdorferi sp.: etiologic agent of Lyme disease. Int J Syst Bacteriol [Internet]. 1984 [cited Jan 24 2011]; 34(4):496-7. Available from: http://ijs.sgmjournals.org/content/34/4/496.full.pdf+html
30. Wang G, Iyer R, Bittker S, Cooper D, Small J, Wormser GP, Schwartz I. Variations in Barbour-Stoenner-Kelly culture medium modulate infectivity and pathogenicity of Borrelia burgdorferi clinical isolates. Infect Immun. 2004;72(11):6702-6.
31. Barbour AG,Hayes SF. Biology of Borrelia species. Microbiol Rev. 1986;50(4):381-400.
32. Hamer SA, Tsao JI, Walker ED, Mansfield LS, Foster ES, Hickling GJ. Use of tick surveys and serosurveys to evaluate pet dogs as a sentinel species for emerging Lyme disease. Am J Vet Res. 2009;70(1):49-56.
33. Burgdorferi N, Hayes SF, Benach JL. Development of Borrelia burgdorferi in Ixoded tick vectors. Ann NY Acad Sci. 1988;539:172-9.
34. Anderson JF. Epizootiology of Borrelia in Ixodes tick vectors and reservoir hosts. Rew infect dis. 1989;11(Suppl. 6):S1451-S1459.
35. Spielman A, Levine JF, Wilson ML. Vectorial capacity of North America Ixodes ticks. Yale J Biol Med. 1984;57(4):507-13.
36. Salkeld DJ, Leonhard S, Girard YA, Hahn N, Mun J, Padgett KA, Lane RS. Identifying the reservoir hosts of the Lyme disease spirochete Borrelia burgdorferi in California: the role of the western gray squirrel (Sciurus griseus). Am J Trop Med Hyg. 2008;79(4):535-40.
37. Brunner JL, LoGiudice K, Ostfeld RS. Estimating reservoir competence of Borrelia burgdorferi hosts: prevalence and infectivity, sensitivity and specificity. J Med Entomol. 2008;45(1):139-47.
38. Taragel'ová V, Koci J, Hanincová K, Kurtenbach K, Derdáková M, Ogden NH, et. al. Blackbirds and song thrushes constitute a key reservoir of Borrelia garinii, the causative agent of borreliosis in Central Europe. Appl Environ Microbiol. 2008;74(4):1289-93.
39. Jordan BE, Onks KR, Hamilton SW, Hayslette SE, Wright SM. Detection of Borrelia burgdorferi and Borrelia lonestari in birds in Tennesse. J Med Entomol. 2009;46(1):131-8.
40. Anderson JM, Norris DE. Genetic diversity of Borrelia burgdorferi sensu stricto in Peromyscus leucopus, the primary reservoir of Lyme disease in a region of endemicity in southern Maryland. Appl Environ Microbiol. 2006;72(8):5331-41.
41. Comstedt P, Bergström S, Olsen B, Garpmo U, Marjavaara L, Mejlon H, Barbour AG, Bunikis J.Migratory passerine birds as reservoirs of Lyme borreliosis in Europe. Emerg Infect Dis. 2006;12(7):1087-95.
42. Battisti JM, Bono JL, Rosa PA, Schrumpf ME, Schwan TG, Policastro PF. Outer surface protein A protects Lyme disease spirochetes from acquired host immunity in the tick vector. Infect Immun. 2008;76(11):5228-37.
43. Dubska L, Literak I, Kocianova E, Taragelova V, Sychra O. Differential role of passerine birds in distribution of Borrelia spirochetes, based on data from ticks collected from birds during the postbreeding migration period in Central Europe. Appl Environ Microbiol. 2009;75(3):596-602.
44. Magnarelli LA, Oliver JH, Hutcheson JH, Anderson Jf. Antibodies to Borrelia burgdorferi in Deer and Raccouns. I wildl Dis. 1991;27(4);562-8.
45. Lo Re V, Occi JL, MacGregoc RR. Identifying the vector of Lyme disease. Am Farn Physician. 2004;69(8):1935-7.
46. Magnarelli LA, Anderson JF, Barbour AG. The etiologic agent of Lyme disease in deer flies, horse flies and mosquitoes. J infect Dis. 1986;154(2):355-8.
47. Rupprecht TA, Koedel U, Fingerle V, Pfister HW. The pathogenesis of Lyme Neuroborreliosis: from infection to inflammation. Mol Med. 2008;14(3-4):205-12.
48. Falco RC, Smith AH, Fish D, et al. The distribution of camine Exposure to Borrelia burgdorferi in a Lyme - Disease Endemic Ann. Am J Public Hearh. 1993;83(9):1305-10.
49. Bushmich SL. Lyme Borreliosis in Domestic Animals. J Spiro Tick Dis. 1994;1:24-8.
50. Appel Max JG. Lyme disease in dog and cats. The cumpendiom. 1990;12(59):617-24.
51. Madigan JE. Lyme disease (Lyme Borreliosis ) in horses. Vet clinics. NA: Equine PMC. 1993;9(2):429-34.
52. Magnarelli L, Fikrig E. Detection of antibodies to Borrelia burgdorferi in naturally infected horses in the USA by enzyme-linked immunosorbent assay using whole-cell and recombinant antigens. Res Vet Sci. 2005;79(2):99-103.
53. Magnarelli LA, Bushmich SL, Sherman BA, Fikrig E. A comparison of serologic tests for the detection of serum antibodies to whole-cell and recombinant Borrelia burgdorferi antigens in cattle. Can Vet J. 2004;45(8):667-73.
54. Farrell GM, Yousef AE, Marth EH. Survival of Borrelia burgdorferi in whole milk, low fat milk and skin milk at 34 `C and in skim milk at S'C. J Food Proct. 1991;54(7):532-6.
55. Farell GM, Marth EH. Borrelia burgdorferi: another cause of foodbonne illness? Int J Food Microb. 1991;14(3-4):247-60.
56. Fridriksdottir V, Overnes G, Stuen S. Suspected Lyme borreliosis in sheep Vet Recund. 1992;130(15);323-4.
Recibido: 23 de mayo de 2011.
Aprobado: 5 de noviembre de 2011.
Dr. Orestes Herrera Lorenzo. Hospital Universitario "Manuel Ascunce Domenech". Camagüey. Cuba. Correo electrónico: oherrera@finlay.cmw.sld.cu