Introducción
La Tuberculosis (TB) es una enfermedad infecciosa considerada un problema de salud pública de primera magnitud.1
La epidemiología molecular, surgida como una combinación de las técnicas de tipaje molecular del complejo Mycobacterium tuberculosis (MTBC) y enfoques epidemiológicos clásicos, ha ganado importancia en los últimos tiempos como un recurso para comprender cuestiones cruciales en la propagación de la TB.2
El control adecuado de la TB requiere el conocimiento de los aislados (o cepas) que circulan localmente, la capacidad de distinguir entre recaídas y reinfecciones, la identificación de infecciones recientes, los factores de riesgo asociados y la capacidad para rastrear la distribución geográfica y la expansión clonal de aislados o cepas específicas.2
Las formas insidiosas de TB y la presencia de fuentes no descubiertas apoyan fuertemente el uso de métodos de tipaje para el control efectivo de eventos epidemiológicos, para identificar puntos de infección en situaciones especiales o buscar las razones de la propagación de ciertos tipos de cepas a nivel regional o mundial. El interés en el tipaje del MTBC es reforzado adicionalmente por la creciente amenaza mundial representada por cepas de Mycobacterium tuberculosis con resistencia a múltiples fármacos (MDR, siglas en inglés) y o con resistencia extendida (XDR, acrónimo en inglés).3
Cuba es uno de los 15 países con más baja carga de la enfermedad en la región de Las Américas4 y trabaja sostenidamente para eliminar la TB. En 2022, la OMS estimó una tasa de incidencia total de 6,6 casos de TB por 100 000 habitantes, siendo 83 % de TB pulmonar confirmada bacteriológicamente.5 La tasa en niños/jóvenes menores de 18 años de edad fue de 1,0 % y la proporción estimada de casos nuevos con TB resistente a rifampicina y multifármacoresistentes (TB RR/MDR) fue de sólo 2,2 %.5 Sin embargo, la tasa de incidencia se ha mantenido alrededor de 6 por 100 000 habitantes desde 2004 hasta la actualidad.6
En Cuba, se realizaron dos estudios genético-poblacionales, en 1995 y 1998, utilizando la técnica del análisis del polimorfismo de la longitud de los fragmentos de restricción con la sonda IS6110 (RFLP-IS6110) en los cuales se encontró un rango de agrupamiento (reflejando transmisión reciente de la enfermedad) de 48 y 45 %, respectivamente.7,8) En un estudio de epidemiologia molecular realizado por González y colaboradores, (empleando el tipaje con elementos repetitivos en tándem de número variable-unidades repetidas interespaciadas de micobacterias, MIRU-VNTR, siglas en inglés, con 24loci) en 61 aislados de MTBC de 2009 procedentes de unidades de salud de La Habana, permitió corroborar que la transmisión reciente era un fenómeno importante en este lugar y que esta se asociaba fuertemente a la permanencia en instituciones cerradas. También se constató que el estudio convencional de los contactos en esta ciudad falla a la hora de identificar un número relevante de vínculos epidemiológicos.9) Sin embargo, en Cuba, no hay información de la dinámica de transmisión de la TB desde la década de 1990.
En 2009, comenzó en Cuba un megaproyecto (por cinco años) de fortalecimiento del Programa Nacional de Control de TB (PNCT), financiado por el Fondo Mundial de lucha contra el sida, la tuberculosis y la malaria, que abarcó todos los componentes del Programa e incluyó a múltiples sectores de la sociedad cubana. No obstante, no se sabe el impacto que tuvo este en la reducción de la transmisión reciente de la enfermedad y la circulación de genotipos.
En este estudio que se presenta ahora, se determinaron, utilizando el espoligotipaje y el tipaje MIRU-VNTR-24 loci, los patrones genéticos y sublinajes de aislados del MTBC circulantes en Cuba en 2009 y su relación con las características clínico-epidemiológicas de los pacientes, y una estimación de la transmisión reciente de la enfermedad, para establecer una línea base.
Métodos
Se realizó un estudio retrospectivo analítico-descriptivo en la Sección de Biología Molecular del Laboratorio Nacional de Referencia e Investigaciones en Tuberculosis, Lepra y Micobacterias (LNRITLM) del Instituto de Medicina Tropical “Pedro Kourí” (IPK).
El universo estuvo constituido por 666 casos de TB diagnosticados en Cuba en 2009.
Tipo de muestreo y razones para su selección
Criterio de inclusión: Todos los aislados de MTBC de Cuba que llegaron al LNRITLM en 2009.
Criterio de exclusión: Se eliminaron los aislados repetidos, los que se encontraban contaminados o secos, los que no se obtuvo ADN, o los que no se completó la caracterización molecular.
En el LNRITLM en ese año, se recibieron 383 aislados de MTBC, obtenidos de muestras clínicas procesadas en los laboratorios de TB laboratories de los Centros Provincial de Higiene, Epidemiología y Microbiología del país.
En total, se emplearon 178 ADN disponibles (conservados a 4 °C en tubos plásticos sellados de 1,5 mL) purificados de los aislados de MTBC mencionados anteriormente. Esta muestra representó 26,72 % del total de pacientes reportados y 46,47 % de los aislados recepcionados.
Tipaje molecular
En la realización del espoligotipaje se empleó el sistema comercial Kit IM9701 (Ocimum Biosolutions Ltd, Hyderabad, India). Se ejecutó con la metodología establecida por Kamerbeek et al.10
El tipaje por MIRU-VNTR-24 loci se realizó siguiendo el protocolo internacional de Supply et al.11
Análisis bioinformático y estadístico
Los genotipos obtenidos por el tipaje MIRU-VNTR-24loci (códigos digitales) y el espoligotipaje se analizaron con las herramientas bioinformáticas “en linea” MIRU-VNTRplus (Que cuenta con una colección de 186 cepas que representan los principales linajes de MTBC. Disponible en: https://www.miru-vntrplus.org/)12 y SITVIT2 (actualmente es la base de datos de genotipaje internacional más grande de un microorganismo infeccioso con una compilación de 111.635 aislamientos clínicos de 169 países de origen de pacientes. Disponible en: http://www.pasteur-guadeloupe.fr:8081/SITVIT2).13
Se usaron las definiciones de agrupamientos, aislados únicos o no agrupados y pacientes de un agrupamiento planteadas por Cave et al. en 2005.14
Se empleó la definición de rango o porcentaje de agrupamiento (como estimado mínimo de proporción de casos de TB relacionados a transmisión reciente), según lo descrito por Small et al., siguiendo la siguiente formula: Número de Pacientes en agrupamientos- Número de agrupamientos/ No. Total de pacientes.15
En las herramientas bioinformáticas también se usan los términos:
Diversidad alélica: Tomando en cuenta los valores del polimorfismo genético de cada locus o de diversidad alélica (h), se definieron los loci altamente (h > 0,6), moderadamente (0,3 ≤ h ≤ 0,6) y pobremente discriminatorios (h < 0,3), según Sola et al., 2003.16
El poder discriminatorio de las técnicas de tipaje se determinó mediante el cálculo del índice discriminatorio de Hunter y Gaston.17
Sublinaje: Grupo de aislados que comparten características esenciales y descienden de un ancestro común.18
Para la recolección de los datos epidemiológicos se revisó la base de datos nacionales de TB del Ministerio de Salud Pública (Minsap) del período mencionado y la base de datos creada en el LNRITLM (y actualizada cada año) con los resultados de la encuesta para la vigilancia a la resistencia a fármacos antituberculosos.
En el procesamiento estadístico de los datos epidemiológicos se procedió a la utilización de los siguientes métodos no paramétricos: prueba de análisis de varianza y de homogeneidad utilizando el paquete estadístico Statgraphics Plus versión 2.1 (Statgraphics Technologies, Inc., The Plains, Virginia, EE. UU.). Los resultados se expresaron en forma de cuadros y figuras.
Consideraciones éticas
Este estudio fue aprobado por el Comité de Ética del IPK (CEI-IPK-35-12), el 20 de abril de 2012. Se realizó de acuerdo con la Declaración de Helsinki. Todos los pacientes contaron con un consentimiento escrito firmado previamente y aprobado por el Comité de Ética. También hablaron con un médico que aclaró cualquier duda asociada con la participación en el estudio. Cuando los pacientes tenían menos de 18 años se obtuvo un consentimiento informado escrito y firmado con la aprobación adicional y firma de uno de los padres. Todos los consentimientos firmados se guardaron en archivos físicos bajo llave bajo la custodia de los investigadores principales para mantener el anonimato de los pacientes. Se siguieron estrictamente las buenas prácticas de laboratorio, así como todas las medidas de bioseguridad para el trabajo y manejo de microorganismos de acuerdo a los niveles de riesgo establecidos por el listado oficial de agentes biológicos que afectan a humanos, animales y plantas de la resolución No 199/2020 del Ministerio de Ciencia, Tecnología y Medio Ambiente vigente en Cuba.
Resultados
El espoligotipaje realizado a 178 ADN obtenidos de aislados de MTBC de Cuba en 2009 produjo 39 patrones de espoligotipos diferentes. El rango de agrupamiento calculado resultó de 75,84 %. Por su parte, el HGDI fue de 0,8734.
Se identificaron cuatro sublinajes predominantes de MTBC, que incluyeron a 84,26 % de los aislados estudiados. De manera individual, predominó el sublinaje S (26,4 %), seguido por los sublinajes Beijing (23,5 %), LAM (19,66 %), y Haarlem (14,6 %) (Fig. 1).
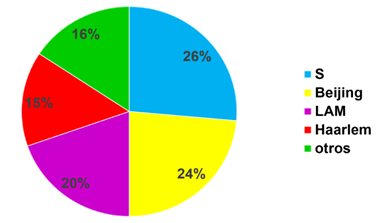 Fuente: Base de Datos Internacional SITVIT2. (Disponible en: http://www.pasteur-guadeloupe.fr:8081/SITVIT2).
Fuente: Base de Datos Internacional SITVIT2. (Disponible en: http://www.pasteur-guadeloupe.fr:8081/SITVIT2).Fig. 1 Principales sublinajes encontrados en 178 aislados del complejo Mycobacterium tuberculosis obtenidos de pacientes con tuberculosis en Cuba en 2009.
El tipaje con MIRU-VNTR-24 loci de los 178 aislados del MTBC definió 154 patrones genéticos diferentes, de los cuales seis agruparon 30 aislados (16,85 %) y 148 mostraron patrones únicos, según la base de datos internacional, de acceso a través de la herramienta bioinformática “en linea” MIRU-VNTRplus.12 El rango de agrupamiento fue de 14,60 % y el HGDI de 0,9926.
En cuanto a la diversidad alélica (h), se observó que de los 24 loci, nueve eran altamente discriminativos; diez moderadamente discriminativos y finalmente existieron 5 loci, pobremente discriminatorios (Fig. 2).
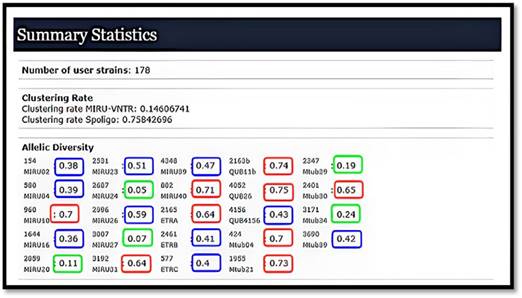 Fuente: herramienta bioinformática en línea MIRU-VNTRplus (Disponible en: https://www.miruvntrplus.org/).
Fuente: herramienta bioinformática en línea MIRU-VNTRplus (Disponible en: https://www.miruvntrplus.org/).Fig. 2 Resultados del cálculo de la diversidad alélica por el tipaje con unidades repetitivas intercaladas de micobacterias con repetición en tándem de número variable (MIRU-VNTR) con 24loci de 178 aislados del complejo Mycobacterium tuberculosis obtenidos en Cuba (2009).
Referente a la información epidemiológica de los casos estudiados, se observó que la edad media de los 178 pacientes fue de 43,19 ± 15,18 años. La inmensa mayoría (91,57 %) de los casos se encontraron en el rango de edad de 15 a 64 años, fundamentalmente en el grupo de 30 a 44 años y 8,42 % restante por encima de los 65 años. También se apreció un predominio significativo del sexo masculino (78,65 %). Esta proporción se mantuvo tanto en pacientes en agrupamientos como en los no agrupados (Tabla 1).
Tabla 1 Características básicas de los casos de tuberculosis con aislados del complejo Mycobacterium tuberculosis, obtenidos en Cuba en 2009, tipificados por Espoligotipaje y con unidades repetitivas intercaladas de micobacterias con repetición en tándem de número variable (MIRU-VNTR) con 24loci
|
|
|
||
|---|---|---|---|
| Sexo | |||
| Femenino | 38 | 31 | 7 |
| Masculino | 140 | 117 | 23 |
| Grupos de edades | |||
| 15 - 29 años | 41 | 33 | 8 |
| 30 - 44 años | 67 | 54 | 13 |
| 45 - 64 años | 55 | 47 | 8 |
| ≥65 años | 15 | 14 | 1 |
| Región de procedencia | |||
| Occidente | 89 | 66 | 23 |
| Centro | 49 | 47 | 2 |
| Oriente | 40 | 35 | 5 |
| Baciloscopia | |||
| Positiva | 154 | 128 | 26 |
| Negativa | 24 | 20 | 4 |
| Serología VIH | |||
| Positiva | 25 | 18 | 7 |
| Negativa | 153 | 130 | 23 |
| Resistencia a los fármacos antituberculosos | |||
| Resistentes | 10 | 6 | 4 |
| Sensibles | 168 | 142 | 26 |
| Permanencia en instituciones cerradas | |||
| Sí | 9 | 9 | 0 |
| No | 169 | 139 | 30 |
| Mortalidad | |||
| Sí | 14 | 10 | 4 |
| No | 164 | 138 | 26 |
Cuando se examinó por regiones se observó que el Occidente acumuló la mitad de los casos (p= 0,0465). Al comparar la dinámica de transmisión por regiones se distinguió que en el Occidente había una mayor diversidad genética porque se detectó un mayor número de patrones. Además, había una mayor transmisión reciente porque había una mayor tendencia al agrupamiento (p= 0,0034).
Esta diferencia en el comportamiento de Occidente está condicionada por la provincia Ciudad de la Habana (provincia actual La Habana), que contó con el mayor rango de agrupamiento (29,09 %), mientras que en el resto del país, sólo se encontraron en conglomerados 11,38 % de los casos (Fig. 3).
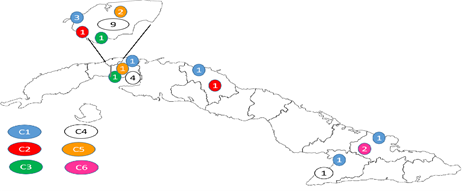
Fig. 3 Distribución geográfica de los casos de tuberculosis según los agrupamientos encontrados por el tipaje con repeticiones en tándem de número variable-unidades repetitivas intercaladas de micobacterias (MIRU-VNTR) con 24 loci y provincias de Cuba.
Al analizar la distribución de sublinajes por regiones, se observó una diferencia en la distribución (p= 0,0087) predominando en cada una un sublinaje diferente: el sublinaje S en Occidente, Beijing en el Centro del país, y LAM en la región Oriental (Tabla 2).
Tabla 2 Distribución geográfica de los sublinajes de los 178 aislados del complejo Mycobacterium tuberculosis obtenidos de pacientes de TB en Cuba en 2009
| Beijing | 14 | 20 | 8 | 42 |
| Haarlem | 13 | 6 | 7 | 26 |
| LAM | 12 | 10 | 13 | 35 |
| S | 33 | 8 | 6 | 47 |
| Otros | 17 | 5 | 6 | 28 |
| Total | 89 | 49 | 40 | 178 |
Fuente: Base de Datos Internacional SITVIT2 (disponible en: http://www.pasteur-guadeloupe.fr:8081/SITVIT2).
En cuanto a la distribución de los sublinajes según agrupamientos, se observó que 21,43 % de los aislados del sublinaje Beijing y 36,17 % de los aislados de S se encontraron en los conglomerados, a diferencia de los otros sublinajes reportados. Sin embargo, no hubo relación entre el sublinaje Beijing y los agrupamientos (p = 0,4496 con corrección de Yates) a diferencia de S, que si se observó una fuerte asociación entre este sublinaje y los agrupamientos (p = 0,0001) (Tabla 3).
Tabla 3 Distribución de los sublinajes de los 178 aislados del complejo Mycobacterium tuberculosis obtenidos de pacientes de TB en Cuba en 2009
| Beijing | 9 | 33 | 42 |
| Haarlem | 2 | 24 | 26 |
| LAM | 2 | 33 | 35 |
| S | 17 | 30 | 47 |
| otros | 0 | 28 | 28 |
| Total | 30 | 148 | 178 |
Fuente: Base de Datos Internacional SITVIT2 (disponible en: http://www.pasteur-guadeloupe.fr:8081/SITVIT2)
Solamente se hallaron diez aislados resistentes al menos a una droga antituberculosa, de los mismos, 40 % se encontraron en agrupamientos. La asociación entre resistencia a los fármacos antituberculosos y los agrupamientos no quedó bien evidenciada. De estos aislados, tres estaban incluidos en el primer agrupamiento por el tipaje MIRU-VNTR-24 loci. Es el único con diferencia significativa con respecto al resto de los aislados estudiados (p= 0,0001). Al analizar la relación entre resistencia al tratamiento y sublinajes, se observó que, de los 10 casos, siete tuvieron aislados del MTBC pertenecientes al sublinaje Beijing, lo que evidenció una relación entre este sublinaje y la resistencia al tratamiento (p= 0,0103) (Tabla 4).
Tabla 4 Relación entre los resultados de las pruebas de sensibilidad en los aislados del complejo Mycobacterium tuberculosis obtenidos en Cuba en 2009 y los sublinajes
| Beijing | 7 | 35 | 42 |
| Haarlem | 0 | 26 | 26 |
| LAM | 2 | 33 | 35 |
| S | 0 | 47 | 47 |
| Otros | 1 | 27 | 28 |
| Total | 10 | 168 | 178 |
Fuente: Base de Datos Internacional SITVIT2 (disponible en: http://www.pasteur-guadeloupe.fr:8081/SITVIT2.
Al estudiar algunos factores de riesgo reconocidos, como la infección por VIH o la permanencia en instituciones cerradas se observó que de las 25 personas viviendo con VIH solo siete tenían aislados en los conglomerados y de estas cuatro se encontraron en el agrupamiento C1. Aunque de forma general, no existía diferencia entre los aislados agrupados y no agrupados (p= 0,1876).
Al asociar la mortalidad de los casos de TB con los agrupamientos determinados con el tipaje MIRU-VNTR-24 loci, se observó que no había diferencias entre los casos con aislados del MTBC incluidos en los conglomerados y los no incluidos (p= 0.3963). En relación a la estancia prolongada en instituciones cerradas, se pudo constatar que todos los patrones fueron únicos (Tabla 5).
Tabla 5 Distribución de los aislados del complejo Mycobacterium tuberculosis obtenidos en Cuba (2009) de los pacientes incluidos en agrupamientos de acuerdo al estatus VIH, los internados, fallecidos
| Fallecidos | 7,86 | 28,57 | p= 0,3963 |
| Reclusos | 5,05 | 0 | p= 0,3528 |
| Positividad al VIH | 14,04 | 28 | p= 0,1876 |
Discusión
En Cuba, se implementan, desde la década de los años 90, técnicas de genotipaje (RFLP-IS6110 y espoligotipaje) para la caracterización molecular de aislados de MTBC obtenidos en este país y realizar estudios genético-poblacionales.7,8 Con estos estudios, se encuentra un rango de agrupamiento (reflejando transmisión reciente) de 48 y 45 %, en Cuba (1995) y La Habana (1998), respectivamente. En 2008, se introduce la técnica de tipaje con los elementos repetitivos MIRU-VNTR-15 loci y posteriormente (2009) se hace un estudio de caracterización molecular con esta técnica en 80 aislados de MTBC obtenidos de muestras de pacientes de unidades de salud de La Habana y se encuentra un rango de agrupamiento elevado (53 %).19 A continuación, se realiza un estudio de epidemiologia molecular más completo en esta ciudad (con aislados de MTBC y pacientes de TB de 2009) y permite corroborar que la transmisión reciente era un fenómeno importante en este lugar y que esta se asocia fuertemente a la permanencia en instituciones cerradas. También se constata que el estudio convencional de los contactos en La Habana falla a la hora de identificar un número relevante de vínculos epidemiológicos.9 Sin embargo, de toda Cuba, no hay información de la dinámica de transmisión de la TB desde la década de 1990.
Este trabajo, se focaliza en el estudio genotípico de los aislados de MTBC obtenidos en Cuba en 2009 y su interacción con los pacientes relacionados, año en que comenzó un gran proyecto de cinco años de duración con apoyo del Fondo Mundial de lucha contra el sida, la tuberculosis y la malaria para el fortalecimiento del PNCT. Este ha sido el proyecto de mayor financiamiento (7,9 millones de dólares) y más abarcador (integró a todos los componentes del Programa y a múltiples sectores de la sociedad cubana, incluso a la sociedad civil) en la historia del PNCT en 60 años. A pesar de que ha pasado una década de su finalización, no se sabe el impacto que tuvo este en la reducción de la transmisión reciente de la enfermedad y en la circulación de genotipos y sublinajes, sobre todo de algunos notorios internacionalmente por su relación con la virulencia, transmisibilidad y resistencia a fármacos, como el sublinaje Beijing. Entonces, los resultados de este trabajo podrían servir de línea base para conocer estos aspectos mencionados.
Al analizar el rango de agrupamiento de este trabajo se observa que es similar a la investigación realizada por Pedersen et al. en los países nórdicos (Dinamarca, Suecia y Finlandia) en el periodo 2012-2013 y 2014-2015.20 Es inferior a lo encontrado en Alemania, Finlandia y Países Bajos, todos países con baja incidencia de TB y programas de control efectivos.21,22,23
La identificación rápida de los loci más discriminativos permite el ahorro de tiempo y recursos durante el monitoreo de aislados con características particulares, en la investigación en el terreno de brotes pasados o potenciales y rastreando aislados importados. En comparación con un estudio metacéntrico realizado entre 2012 y 2019 que analiza los resultados de 56 artículos que evaluaron el poder discriminatorio de cada locus se observa que cinco de los seis loci altamente discriminativos encontrados en estos estudios se corresponden con los de esta investigación.24) También se aprecia una gran concordancia con el estudio realizado en Irán donde coinciden seis de los loci muy discriminativos.25
La identificación de los linajes y sublinajes principales y su distribución geográfica permiten una mejor comprensión de la dinámica de transmisión de la enfermedad. Llama la atención la alta frecuencia de aparición del sublinaje S. Este sublinaje se reporta en Francia, Canadá y Sudáfrica, países con los cuales Cuba incrementa las relaciones comerciales en los últimos años.13,26 En Italia, se considera una familia autóctona, como se pone de manifiesto en un estudio realizado por Garzelli et al. en la Toscana donde 92,5 % de los casos de nativos italianos pertenecen a este sublinaje.27
La proporción elevada de aislados con sublinajes LAM y Haarlem, constituye un reflejo del origen demográfico de la población cubana y los vínculos históricos y persistentes con Latinoamérica y Europa mediterránea, regiones en las que predominan ampliamente dichos sublinajes.13,28
Aunque Cuba tiene una de las tasas más bajas de TB de América Latina, tiene una alta prevalencia del sublinaje Beijing,7,8) en comparación con otros países de la región, excepto Perú, Colombia y Ecuador.29,30 Es importante resaltar que la presencia de este sublinaje en Cuba se ha incrementado de 11,3 % a 25,6 %, entre 1995 y 2010, sin conocer las causas posibles.7,28
Al analizar la población incluida en este estudio se observa que la edad media poblacional coincide con lo encontrado en el estado de Veracruz, México, y en el estado de Romaira, Brasil.31,32) Se diferencia de lo reportado en población extranjera en Finlandia donde la media es de 28 años y en Tokio, Japón, en donde se reporta una edad de menos de 40 años.22,33 Resulta evidente que la edad media de los pacientes es menor según es mayor la incidencia de la enfermedad.
En esta pesquisa, se encontró que la Ciudad de la Habana fue la provincia con más agrupamientos, además de contar con los dos grupos más grandes del estudio. Este hallazgo se asemeja a lo planteado por Izumi et al., que encontraron que el hecho de ser residente en ciudades estaba asociado a los agrupamientos o conglomerados.33
No existe asociación entre el VIH y los agrupamientos, lo cual está dado porque el estatus VIH favorece el desarrollo de la enfermedad, pero no su transmisión. Esto explica la semejanza con el estudio realizado en 505 pacientes con TB en Ciudad del Cabo, Sudáfrica.34 Donde a pesar de tener diferencias en cuanto a la incidencia de TB no hay diferencias entre los casos agrupados y únicos.
La mortalidad por TB está más relacionada con la virulencia de la cepa y las características inmunológicas del paciente que con la transmisión reciente. La ausencia de asociación entre agrupamiento y mortalidad es semejante a lo encontrado en el estudio realizado en Malawi donde tampoco había asociación con la mortalidad.35 En cambio, difiere de lo encontrado en un estudio en Zimbabwe, donde la mortalidad era mayor en los conglomerados.36
En esta investigación, se obtuvo un porcentaje muy bajo de resistencia al tratamiento antituberculoso, similar al estudio realizado por Pedersen et al.18) en países del Norte de Europa y al contrario de las investigaciones en algunos países asiáticos o africanos, como India y Mali.37,38 Esta incidencia baja de resistencia a fármacos puede estar dada por el manejo adecuado del tratamiento de los pacientes y la importación escasa de casos resistentes. La no asociación entre resistencia y conglomerados puede estar dada por la ocurrencia baja de aislados resistentes a los medicamentos antituberculosos.
A manera de conclusión, se puede decir que esta investigación contribuye al conocimiento de la dinámica de transmisión reciente de la TB en Cuba en 2009. El tamaño de los agrupamientos y el alto número de patrones únicos permite inferir que la TB en este país ocurre de forma limitada y la pertenencia a grupos de riesgo no favorece la transmisión de la enfermedad.
Además, sirve de punto de referencia para ayudar a evaluar el impacto positivo que pudo tener la financiación del megaproyecto del Fondo Mundial en la reducción de la diseminación de los aislados de MTBC en la comunidad y la disminución de la transmisión de la TB en este país en los años posteriores.
La estructura genética poblacional de MTBC encontrada en Cuba se asemeja a la de un país Iberoamericano, con la excepción de la gran frecuencia de aparición de los sublinajes Beijing y S.29,30
Para actualizar los conocimientos sobre la transmisión reciente de la enfermedad en Cuba, está en ejecución un estudio de tipaje molecular con aislados de MTBC obtenidos en 2017-2019, previo a la influencia negativa de la epidemia de la COVID-19 en el país.
Limitaciones del estudio
Este estudio tiene algunas limitaciones. i) No se analizaron todos los aislados de M. tuberculosis cultivados durante el período, ya que algunos aislados (o ADN) se perdieron (o no obtuvieron resultados moleculares completos) durante el almacenamiento, transporte, extracción de ADN, espoligotipaje o tipaje con MIRU-VNTR-24 loci. ii) el período fue de sólo un año, faltando aislados agrupados de pacientes vinculados en eventos de transmisión recientes de este corto período.














