Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista de Ciencias Médicas de Pinar del Río
versión On-line ISSN 1561-3194
Rev Ciencias Médicas v.13 n.2 Pinar del Río abr.-jun. 2009
SOCIEDADES CIENTÍFICAS
Ambiente redox salival: Comparación entre pacientes con enfermedad periodontal inflamatoria y pacientes periodontalmente sanos
Salivary redox environment: comparison between patients suffering from periodontal disease and periodontal healthy patients
Hetzel de la C.Lourido Pérez1, Gregorio Martínez Sánchez2, Danay de la C Fleitas Vigoa3, Joaquín Fernández Becerra4.
1Dr. Especialista de Primer Gradoen Estomatología General Integral. Especialista de Primer Grado en Periodoncia, Master en Urgencias Estomatológicas.
2Dr. Doctor en Ciencias Farmacéuticas e Investigador Titular.
3Dra. Especialista de Primer Grado en Periodoncia, Master en Salud bucal comunitaria.
4Dr. Especialista de Primer Grado en Periodoncia.
RESUMEN
Con el objetivo de estudiar el Ambiente redox salival del paciente con enfermedad periodontal inflamatoria y el paciente sano desde el punto de vista periodontal, fue realizado un estudio observacional, transversal y de casos y controles en Pinar del Río, de Julio 2006 a Julio 2007. El universo lo constituyeron 35 individuos; no se aplicó muestreo; se conformaron dos grupos,"Estudio", que incluyó pacientes afectados periodontalmente, y "Control", que incluyó pacientes sanos periodontalmente; a ambos se les realizó un interrogatorio y un examen bucal; los datos fueron registrados en un Cuaderno de Recogida de Datos; se les recogió una muestra de saliva, la cual fue refrigerada a -20oC hasta el momento de la realización de las determinaciones bioquímicas en el analizador automático HITACHI. Para el procesamiento estadístico se aplicó la prueba de Outliers, ensayos de Shapiro, Wilks, se aplicó la prueba T de student y coeficiente de correlación de Pearson; el nivel de significación estadística empleado fue p<0,05. Se comprobó la existencia de un desequilibrio en el Ambiente redox del paciente enfermo respecto al sano. Se encontraron valores medios significativamente más altos de Productos Avanzados de Oxidación de Proteínas en los pacientes "Estudio" respecto a los "Control" y valores medios significativamente más altos en la Capacidad Reductora del Hierro Férrico en los pacientes "Control" respecto a los "Estudio". Se determinó que las variables de mayor valor diagnóstico para la enfermedad periodontal son los Productos Avanzados de Oxidación de Proteínas y la Capacidad Reductora del Hierro Férrico.
Palabras clave: Estrés oxidativo, Enfermedad periodontal, saliva.
ABSTRACT
Aimed at studying Salivary Redox Environment of the patient suffering from the inflammatory periodontal disease and healthy patients from the periodontal point of view an observation, cross-sectional, a cases and controls study was carried out during July 2006-June 2007 in Pinar del Rio. The universe was comprised of 35 individuals; no sampling was applied; and two groups were formed, “Study” which included affected patients and “Control” periodontally healthy patients. Both groups were interviewed and a oral and dental examination was performed. Data were collected in a Data Processing Notebook. A sample of saliva was taken and kept refrigerated at -20º C to conduct a biochemical analysis with a HITACHI automatic analyzer. The statistical process outliers values, Shapiro-Wilks, Students’s test, Pearson´s correlation coefficient were calculated, all of them at 95 % of certainty. The existence of an imbalance in the Patient’s Redox Environment respect to healthy patients was observed. Mean values were significantly higher than the Avanced Products of Protein Oxidation in the patients of the “Study” respect to those in “Control” and mean values were significantly higher in the Reducing Capacity of the Ferro-Iron in “Control” patients compared with “Study”, determining that the Advanced Products of Protein Oxidation and the Reducing Capacity of the Ferro-Iron were the variables of the major diagnostic value for periodontal disease.
Key words: Oxidative stress; Periodontal disease; saliva.
INTRODUCCIÓN
La vida en la tierra surgió en una atmósfera reductora; al aparecer las algas fotosintéticas, el oxígeno formado por éstas permitió el desarrollo de organismos que utilizaban esta molécula para la obtención de energía. Más del 95% del oxígeno consumido por los organismos aerobios es reducido a agua y un pequeño por ciento es reducido a Especies Reactivas del Oxígeno (ERO).1
Se puede considerar Ambiente redox a la relación existente entre agentes antioxidantes y pro-oxidantes que al romperse conduce al Estrés Oxidativo (EOx).
Para poder comprender el fenómeno del EOx se debe conocer qué son los radicales libres (RL), de dónde proceden y cómo actúan. Se considera un RL aquella molécula que en su estructura atómica presenta un electrón desapareado o impar en el orbital externo, dándole una configuración espacial que genera una alta inestabilidad. Existen muchas fuentes de RL, entre ellas: las mitocondrias, y los leucocitos polimorfonucleares (PMN).2, 3
Por su parte las Especies Reactivas del Oxígeno (ERO) incluyen a los RL propiamente dichos y a las moléculas derivadas del oxígeno que tengan una alta capacidad reactiva, que son las especies no radicalarias. Dentro de las especies radicalarias de mayor interés desde el punto de vista biológico están el anión radical superóxido (O2.-), radical hidroxilo (.OH), óxido nítrico (.NO), entre otras. Dentro de las especies no radicalarias se encuentran el ácido hipocloroso (HOCl), peróxido de hidrógeno (H2O2), y el oxígeno singlete (1O2).1
Los RL se forman en condiciones fisiológicas en proporciones controlables por los mecanismos defensivos de las células. Son una herramienta defensiva antimicrobiana y antitumoral del sistema inmunológico; pueden actuar como mensajeros e inductores genéticos; participan en el tono de contracción de la musculatura lisa de los vasos, etc. Pero además tienen un efecto en el daño tisular y su relación con la enfermedad. Estos reactivos pueden alterar directa o indirectamente varios mecanismos celulares y fisiológicos al actuar sobre lípidos, ADN, y proteínas.
En ciertas situaciones patológicas, la producción de RL se incrementa sustancialmente ingresándose al estado de Estrés Oxidativo (EOx). Se considera EOx al desbalance a corto y/o largo plazo del equilibrio entre antioxidantes y pro-oxidantes que provoca efectos adversos o desregulación de procesos fisiológicos y mecanismos de señalización a consecuencia de favorecer los procesos de pro-oxidación u obstaculizar los mecanismos antioxidantes.4 En la actualidad existen controversias sobre si el EOx es la causa o la consecuencia de las enfermedades, es probable que algunas enfermedades sean causadas por perturbaciones en los factores que regulan la producción de ERO.1, 2 El EOx se puede producir por un exceso de sustancias pro-oxidantes, deficiencia de agentes antioxidantes o por ambos factores a la vez.3
El EOx produce daño tisular directo e indirecto, entre los daños directos se encuentran los siguientes: peroxidación lipídica, oxidación de proteínas, alteración del ADN, etc. El daño indirecto consiste en que el EOx produce una activación de los factores de la transcripción de los genes redox, lo que provoca la producción de gran variedad de citocinas proinflamatorias.3
Halliwell define como antioxidante a toda sustancia que hallándose presente a bajas concentraciones respecto a las de un sustrato oxidable (biomoléculas), retarda o previene la oxidación de dicho sustrato. El antioxidante al colisionar con el RL le cede un electrón oxidándose a su vez y transformándose en un RL débil, no tóxico. No obstante no todos los antioxidantes actúan de esta manera. Los antioxidantes se pueden clasificar en exógenos, cuando ingresan a través de la cadena alimentaria: vitamina E, C, flavonoides etc., endógenos, cuando son sintetizados por la célula: glutatión, enzimas como superóxido dismutasa (SOD), catalasa (CAT), y sus cofactores: selenio, hierro, cobre, zinc, manganeso.2
La Enfermedad Periodontal Inflamatoria (EPI) engloba a un conjunto de enfermedades que se caracterizan por afectar a los tejidos que sostienen y protegen al diente: encía, ligamento alveolo-dentario, cemento radicular y hueso alveolar. Constituye la segunda causa de la pérdida de dientes y en su forma más destructiva afecta aproximadamente al 10 % de la población mundial.
La EPI comienza con una afección de la encía denominada «gingivitis» que puede o no extenderse a los tejidos más profundos y dar lugar a la « periodontitis ». Esta última se caracteriza por pérdida ósea y movilidad, que pueden conducir finalmente a la pérdida del diente. Existe un creciente interés por definir aquellos elementos de la respuesta del huésped que aumentan la susceptibilidad a la EPI y entre ellos está el papel del EOx en esta enfermedad.5
La sobre activación de PMN con la consecuente formación de ERO, el efecto de proteasas y citocinas y la disminución de la capacidad antioxidante sistémica y de la saliva inciden decisivamente en la gravedad de las periodontopatías.
Todas las formas de peridontitis en humanos son producidas por bacterias que colonizan el diente cerca del margen gingival. Existen mecanismos de defensa local ante el ataque de estas bacterias, pero el más importante es la acción de los PMN.6 Por otra parte, la enfermedad periodontal activa los mismos mecanismos de defensa sistémicos que cualquier otra infección en el organismo, mientras su activación proporciona defensa contra los m.o.s los mismos sistemas participan en la destrucción de los tejidos del huésped. Se considera que la fuente primaria de ERO en esta enfermedad es el «estallido respiratorio» de los PMN activados. Bajo ciertas condiciones, los factores locales (cálculo, placa, m.o.s) conducen a la migración de los PMN de la gíngiva y el fluido gingival y provocan una ruptura de los tejidos blandos del periodonto, inducida por las ERO generadas por PMN activados. El proceso de peroxidación lípidica, la oxidación de grupos funcionales de aminoácidos de la matríz extracelular y la despolimerización de las cadenas constituidas de glucosaminoglucano por la acción de las ERO, representa el mecanismo desencadenante en el desarrollo de cambios morfofuncionales en el periodonto y sus vasos sanguíneos, como resultado final tienen lugar la destrucción del colágeno y la reabsorción del tejido óseo7-13).Muchas células inflamatorias, fibroblastos, células endoteliales vasculares y osteoclastos también producen ERO.5
Los PMN del fluido gingival y también los periféricos de los pacientes con diferentes formas de periodontitis producen una mayor cantidad de radical superóxido y por lo tanto tienen una respuesta oxidante incrementada con relación a los de los controles sanos. Algunos estudios han demostrado que paralelamente existe un nivel de defensa antioxidante similar al de los controles y por tanto el efecto protector o destructivo de los PMN pudiera asociarse a la capacidad de respuesta antioxidante de los tejidos frente a un EOx. Las ERO también son capaces de incrementar la reabsorción ósea. Estudios recientes sugieren que no están directamente involucradas en la reabsorción, sino que juegan un papel importante en la activación de los osteoclastos fundamentalmente a través del incremento de su formación.5, 14, 15
En su conjunto estos datos permiten plantear que la participación del EOx en esta enfermedad es un hecho. De una parte, los factores etiológicos generales provocan una disminución de las defensas antioxidantes y por otra parte, los factores etiológicos locales en íntimo contacto con la encía, provocan la migración y activación de los PMN. En estas condiciones, la liberación de ERO que provienen de PMN y otras células inmunológicas conduce a daños oxidativos a biomoléculas que desencadenan cambios morfofuncionales en el tejido que conforma el periodonto y sus vasos.
La saliva es uno de los elementos que constituye un mecanismo de defensa antioxidante ante el ataque de los radicales libres, en estudios realizados por DiabLadski (2003) se comprobó que la saliva de los pacientes sanos es de un 40 a un 50% más efectiva en su actividad antioxidante que la de los enfermos periodontalmente, dando como principal conclusión de su estudio que la enfermedad periodontal está asociada con un desbalance entre oxidantes y antioxidantes a favor de los oxidantes debido a un incremento en la producción de los radicales libres y un defecto en la actividad antioxidante de la saliva. 15
Con el objetivo de estudiar el Ambiente redox de la saliva del paciente con enfermedad periodontal inflamatoria y el paciente sano desde el punto de vista periodontal, e identificar las variables redox de mayor valor diagnóstico en la enfermedad periodontal es que es diseñado este estudio.
MATERIAL Y MÉTODOS
Fue realizado un estudio observacional, transversal y de casos y controles en el municipio Pinar del Río, en el período de Julio de 2006 a Julio de 2007, del total de 51 individuos estudiados, 16 fueron excluidos por alteraciones de las muestras o al eliminar valores aberrantes, por lo que el universo quedó constituido por 35 individuos, 24 en el grupo "Estudio" (pacientes afectados por Enfermedad periodontal inflamatoria) y 11 en el grupo "Control" (pacientes sanos desde el punto de vista periodontal). Quedarán incluidos tantos pacientes como sean necesarios, sin importar género, etnia o edad, que estén sanos desde el punto de vista periodontalo padezcan padecíande Enfermedad Periodontal Inflamatoria en alguna de sus manifestaciones, (Gingivitis, periodontitis crónica del adulto o algún tipo de periodontitis agresiva). Quedarán excluidos todos aquellos pacientes que no estén de acuerdo en pertenecer a la investigación, que en el momento de la toma de muestra presentaen algún proceso respiratorio, pacientes con Tuberculosis, con VIH, o alguna alteración bucal en general no relacionada con las patologías en estudio.
A ambos grupos ("Estudio" y "Control") luego de haber dado su consentimiento informado por escrito, se les realizó un interrogatorio y un examen bucal detallado con la utilización de un espejo bucal, explorador y sonda periodontal; el diagnóstico se realizó por el examen clínico y por el estudio radiográfico; los datos fueron registrados en un Cuaderno de Recogida de Datos donde se recogieron los datos generales, los hábitos tóxicos, los antecedentes patológicos, las terapias medicamentosas y el estado periodontal.
Posteriormente el paciente depositó la muestra de saliva en un bulbo, el cual se tapó y se mantuvo a temperatura de refrigeración; en un tiempo menor a las 24 horas se tomó una muestra de saliva (1 mL) y se diluyó en 1 mL de agua destilada y se colocó en 2 viales 1mL de esa saliva diluida; esto se congeló en refrigerador doméstico por un tiempo no mayor de una semana y después se llevó a un refrigerador de -20 grados hasta el momento de la realización de las determinaciones bioquímicas.
Se montó la técnica para la determinación del estado redox de la saliva en el analizador automático HITACHI del IFAL (Instituto de Farmacia y Alimentos), donde se determinaron los siguientes parámetros: GSH (Glutatión Reducido), PAOP (Productos Avanzados de Oxidación de Proteínas), MDA (Malonildialdehido), SOD (Superóxido Dismutasa), FRAP (Capacidad Reductora del Hierro Férrico), ROOH (Organoperóxidos Totales), PP (Potencial de Peroxidación), y Proteínas totales/SOD; técnicas estas aprobadas por el CEIEB (Centro de Estudio para las Investigaciones y las Evaluaciones Biológicas); los valores fueron recogidos en el Cuaderno de Recogida de Datos de cada paciente.
El análisis estadístico se inició con la prueba de Outliers para detectar valores aberrantes; posteriormente se comprobó la normalidad (ensayos de Shapiro, Wilks o Kolmogorov-Smirnov) seguido por la prueba de homogeneidad de varianza (Levene). Para determinar la existencia de diferencias entre grupos se utilizó la prueba T de student. El nivel de significación estadística empleado en todos los casos fue p<0,05. El estudio de relación entre las variables se realizó mediante el análisis de la correlación lineal. Se reportó el coeficiente de correlación de Pearson. Los datos fueron procesados con el paquete estadístico STATISTICA Versión 6.0 para WINDOWS.
RESULTADOS
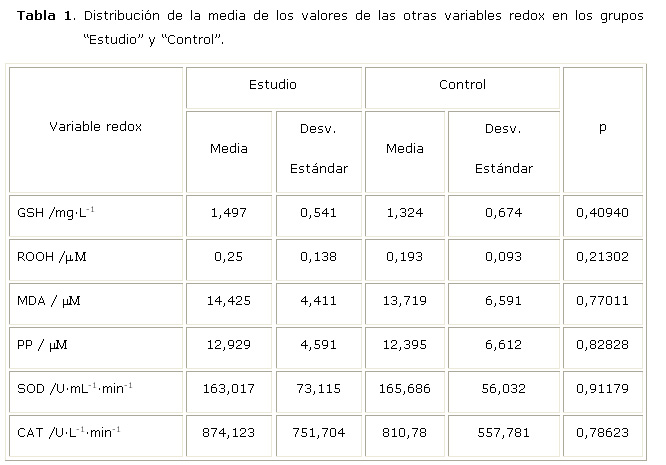
En la figura 1 se muestra la distribución de la media de los valores PAOP según estado periodontal. De las tres variables que representan daño oxidativo (PAOP, MDA y ROOH), la variable PAOP fue la que varió significativamente (p<0,05) en la saliva de los pacientes sanos (media de PAOP=0,068) con respecto a los enfermos periodontalmente (media de PAOP=0,158).
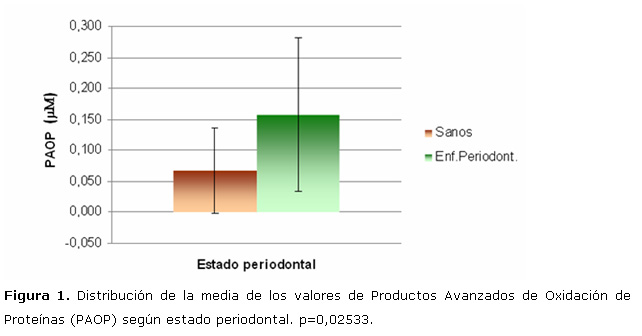
En la figura 2 se muestra la distribución de la media de los valores FRAP según estado periodontal. De las variables que representan capacidad antioxidante total (PP y FRAP), la variable FRAP fue la que varió significativamente (p<0,05) en la saliva de los pacientes sanos (media de FRAP=1,841), con respecto a los enfermos periodontalmente (media de FRAP=1,149), en los pacientes sanos la capacidad antioxidante de la fase acuosa, que es la que predomina en la saliva, resultó ser superior a la de los enfermos periodontalmente.
En cuanto a la actividad de las enzimas antioxidantes, el valor de CAT/SOD fue más bajo en el enfermo periodontal (media de CAT/SOD=0,0000044), que en el paciente sano (CAT/SOD=0,0000071) y aunque la diferencia no fue significativa (p>0,05), hubo variación respecto al valor de los individuos sanos.
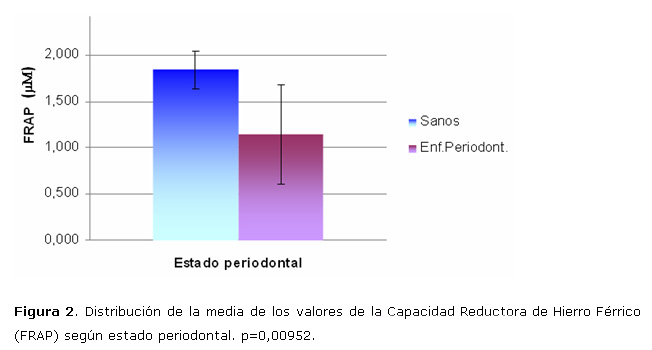
La distribución de la media del resto de los valores de las variables redox en los grupos "Estudio" y "Control" se muestra en la tabla 1; no se obtuvieron diferencias significativas entre ambos grupos en ninguna de las determinaciones realizadas.
Al realizar la asociación entre las variables redox entre pacientes "Estudio" y "Control" se detectó en este estudio una correlación lineal de Pearson positiva entre las variables MDA y PP tanto en individuos del grupo "Estudio" como los del grupo "Control" con un cr=0,997 en el estudio y cr=0,0995 en el "Control". Por su parte en los pacientes "Control" hay también una correlación positiva entre las variables CAT y CAT/SOD con un cr=0,830, correlación ésta que se pierde en los pacientes "Estudio", lo que se debe a variaciones en la actividad de la CAT durante la enfermedad.
No se consideró útil analizar en este estudio la relación entre las variables redox y los hábitos tóxicos debido a que no hubo representatividad en el universo de estudio de este tipo de hábitos, tampoco se consideró útil la comparación con la ingesta de medicamentos debido a la gran variabilidad de los mismos y combinaciones entre ellos.
DISCUSIÓN
En los pacientes enfermos periodontalmente los valores de PAOP fueron un poco más del doble de los pacientes sanos lo que está demostrando que en estos pacientes hay un gran daño oxidativo (clorinación de proteínas) y por tanto son los valores PAOP representativos del daño oxidativo de los tejidos periodontalmente enfermos. Por su parte en los pacientes sanos la capacidad antioxidante (FRAP) de la fase acuosa, que es la que predomina en la saliva, resultó ser superior a la de los enfermos periodontalmente. Los valores de PAOP y FRAP variaron de forma significativa entre ambos grupos, con valores de p<0,05 en ambos casos. Chapple (2006), Mashayekhi y col. (2005), Panjamurthy y col. (2005), Brock y col. (2004) y Diab Ladki y col. (2003), en sus estudios encuentran también diferencias significativas en los valores medios de estas dos variables entre pacientes sanos y periodontalmente afectados. 3, 14-17
Al analizar la actividad de las enzimas antioxidantes, en los enfermos el valor de SOD fue más alto que en los sanos, debido al acúmulo de H2O2 que indica daño a los tejidos. Akalin y col. (2005) en su estudio tampoco encuentran diferencias significativas entre el grupo de individuos con periodontitis crónica y los controles sanos, la posible explicación a estos hallazgos está en el hecho de que la SOD presenta una mayor actividad en el interior de células y tejidos y no tanto en los fluidos extracelulares.6
Se puede concluir por estos resultados que en la enfermedad periodontal inflamatoria hay una disminución de la capacidad antioxidante de la fracción acuosa de la saliva y por tanto se favorecen los procesos de oxidación de proteínas debido a que el propio proceso inflamatorio consume los antioxidantes presentes en la misma para amortiguar la superproducción de ERO que resulta del proceso inflamatorio.
La distribución de la media del resto de los valores de las variables redox no mostró diferencias significativas entre ambos grupos ("Estudio" y "Control") en ninguna de las determinaciones realizadas, sin embargo Chapple y col. (2007), Borges y col. (2002), Akalin y col. (2007) y Mashayekhi y col. (2006) encuentran diferencias significativas también en otras variables como el MDA.18-21 Panjamurthy y col. (2005) y Tsai y col. (2005) también difieren con los resultados de este estudio al encontrar valores significativamente más bajos de GSH en enfermos que en sanos desde el punto de vista periodontal, sin embargo Borges y col. (2007) al igual que este estudio no encuentran esas diferencias.17, 22, 19
Al realizar la asociación entre las variables redox entre pacientes "Estudio" y "Control" se detectó en este estudio una correlación lineal de Pearson positiva entre las variables MDA y PP tanto en individuos del grupo "Estudio" como los del grupo "Control", lo que demuestra que en la medida que hay un mayor daño a lípidos se incrementa el valor de PP que está relacionado con una menor disponibilidad de antioxidantes en la fase lipídica.
Los resultados indican que la oxidación de proteínas juega un papel fundamental en la enfermedad periodontal. En este sentido se puede destacar que la variable PAOP tiene un valor diagnóstico de gran relevancia. Esta variable es un biomarcador que reúne varias características que lo acercan a un biomarcador ideal (se calcula a partir de una muestra no invasiva, en este caso la saliva, su determinación es de bajo costo, su magnitud guarda relación con la intensidad del proceso inflamatorio, entre otras). Se debe destacar que es la primera vez que se hace la determinación de PAOP en saliva. Los valores FRAP mostraron gran variabilidad entre los pacientes sanos y enfermos, constituyendo también una variable de elevado valor diagnóstico.
- Se comprobó la existencia de un desequilibrio en el Ambiente redox del paciente enfermo respecto al sano.
- Se encontraron valores medios significativamente más altos de en los pacientes con enfermedad periodontal inflamatoria que en los pacientes sanos.
- Se encontraron valores medios significativamente más altos en la RHF en los pacientes sanos respecto a los afectados por enfermedad periodontal inflamatoria.
- Existió asociación positiva entre las variables Malonildialdehido y Potencial de Peroxidación tanto en los pacientes sanos como en los enfermos periodontalmente, lo que indica que cuando disminuye la capacidad antioxidante de la saliva se incrementa la oxidación de los lípidos.
- Se determinó que las variables de mayor valor diagnóstico para la enfermedad periodontalson los (PAOP) y la RHF(FRAP).
REFERENCIAS BIBLIOGRÁFICAS
1. Martínez Sánchez G, García García I, León Fernández OS, Bilbao Revoredo T, Ledesma Rivero L. Balance antioxidante/pro-oxidante: Salud y enfermedad. 4ta ed. La Habana: sn; 2004.
2. García Montes de Oca A. Influencia del estrés oxidativo en la enfermedad periodontal. Rev Cien Méd. 2004; 10(2):20-25.
3. Chapple LC. Oxidative stress, nutrition and neutrogenomics in periodontal health and disease. Int J Dent Higiene. 2006; 4(1):15-21.
4. Jones DP. Redefining oxidative stress. Antioxid.Redox Signal. 2006; 8(9-10): 1865-79.
5. Lourido Pérez H, Martínez Sánchez G, Fernández Becerra J. Desbalance redox en la enfermedad periodontal inflamatoria. Antioxidantes y calidad de vida. [ serie en internet ] 2006 En-Mar [citado 5 Ago 2008];4(2): [aprox. 6 p.]. Disponible en: http://www.antioxidantes.com.ar/Home2.htm.
6. Akalin FA, Tokio E, Renda N. Análisis of superoxide dismutase activity levels in gingival and gingival crevicular fluid in patients with chronic periodontitis and periodontally healthy controls. J Clin Periodontol. 2005; 32(3):238-43.
7. Katsuragi H, Ohtake M, Kurasawa I, Saito K. Intracellular production and extracellular release of oxygen radicals by PMNs and oxidative stress on PMNs during phagocytosis periodontopathic bacteria. Odontology. 2003; 91(1):13-8.
8. Greabu M, Battino M, Mohora M, Totan A, Spinu T, Totan C, et al. Could constitute saliva the first line of defence against oxidative stress. Rom J Intern Med. 2007; 45(2):209-13.
9. Król K. Reactive oxygen species and antioxidant mechanisms in the pathogenesis of periodontitis. Am Acad Med Stetin. 2004; 50(2):135-48.
10. Valko M, Leibfrit D, Moncol J, Cronin M, Mazur M, Telser J. Free radicals and antioxidants in normal physiological functions and human disease. International Journal of Biochemistry & Cell Biology. 2007, (39):44-84.
11. Borisenkov MF, Erunova LA, Liuseva EM, Pozdeeva NV. Diurnal changes in the total antioxidant activity of human saliva. Fiziol Cheloveka. 2007; 33(3):137-8.
12. Sawamoto Y, Sugano N, Tanaka H, Ito K. Detection of periodontopathic bacteria and an oxidative stress marker in saliva from periodontitis patients. Oral Microbiol Immunol. 2005;20(4):216-20.
13. Guentsch A, Preshaw PM, Bremer-Streck S, Klinger G, Glockmann E, Sigusch BW. Lipid peroxidation and antioxidant activity in saliva of periodontitis patients: effect of smoking and periodontal treatment. Clin Oral Investig. En prensa 2008.
14. Brock GR, Butterworth CJ, Matthews JB, Chapple IL. Local and systemic total antioxidant capacity in periodontitis and health. J Clin Periodontol. 2004; 31(7):515-521.
15. Diab-Ladki R, Pellat B, Chahine R. Decrease in the total antioxidant activity of saliva in patients with periodontal diseases. Clin Oral Investig. 2003; 7(2):103-7.
16. Mashayekhi F, Aghahoseini F, Rezaie A, Zamani MJ, Khorasani R, Abdollahi M. Alteration of cyclic nucleotides levels and oxidative stress in saliva of human subjects with periodontitis. J Contemp Dent Pract. 2005; 6(4):46-53.
17. Panjamurthy K, Manoharan SH, Rajamani C. Lipid peroxidation and antioxidant status in patients with periodontitis. Cell Biol Lett. 2005;10(2):255-264.
18. Chapple ILC, Brock GR, Milward MR. Compromised GCF total antioxidant capacity in periodontitis: cause or effect?. J Clin Periodontol. 2007; 34:103-110.
19. Borges I, Machado EA, Wilhem D, Bittencourt T, Barreto M. Proinflamatory and oxidative stress markers in patients with periodontal disease. Mediators of Inflammation. 2007: 40-50.
20. Akalin FA, Baltactoglu E, Alver A, Karabulut E. Lipid peroxidation levels and total antioxidant status in serum, saliva and gingival crevicular fluid in patients with chronic periodontitis. J Clin Periodontol. 2007; (34): 558-565.
22. Tsai CC, Chen HS. Lipid peroxidation: a possible role in the induction and progression of chronic periodontitis. J Periodontal Res. 2005; 40(5):378-84.
Recibido: 22 de Diciembre de 2008.
Aprobado: 16 de Marzo de 2009.
Dra. Hetzel de la C. Lourido Pérez. Ave. Borrego, Rpto. Hnos. Cruz, Edif.59 Apto B-7. Pinar del Río. Cuba.
E-mail: hetzel@princesa.pri.sld.cu.