INTRODUCCIÓN
La eliminación de microorganismos del conducto radicular ha sido siempre el propósito principal del tratamiento pulporradicular (TPR) en un diente con infección pulpar. La preparación biomecánica y la irrigación con sustancias antisépticas, no siempre son de gran eficacia, debido a la supervivencia de microorganismos resistentes en los túbulos y canalículos dentinarios donde no es posible aplicar los instrumentos y las diversas sustancias que se utilizan. Se requiere entonces, el uso de un medicamento no tóxico que sea capaz de destruir los agentes patógenos, modular y reducir la inflamación, así como posibilitar la reparación tisular.1,2
Desafortunadamente, los medicamentos utilizados en el conducto radicular no han mostrado evidencias de cumplir con todos los aspectos antes mencionados, se han utilizado una amplia gama de agentes químicos diferentes, algunos de forma empírica o basada únicamente en pruebas de laboratorio, otros a criterio personal del profesional. Son escasas las investigaciones clínicas sobre la eficacia de la mayoría de ellos; sobre todo, de sus efectos indeseados en sitios alejados de su aplicación.3
Uno de los antisépticos comúnmente empleado en Estomatología desde el pasado siglo y que mantiene su uso hasta la actualidad, lo constituye el Camphenol Plus (CP), mezcla constituida por: 4-clorofenol (4-CF, paraclorofenol), dexametasona, timol y alcanfor. Es un líquido oleoso, de color ámbar y con un olor penetrante característico. El propósito del alcanfor además de servir como vehículo, es reducir la acción irritante del 4-CF, al causar su lenta liberación, de lo cual resulta un medicamento con bajo poder de agresión a los tejidos.
El paraclorofenol alcanforado (PCFA), principal agente activo del CP, constituye un derivado fenólico efectivo contra la variedad de microorganismos presentes en los conductos radiculares infectados y estrechos, con gran poder biocida cuando se mezcla con otros fármacos como el hidróxido de calcio. Sin embargo, se le han señalado algunos inconvenientes que han limitado su uso, como los enumerados por Canalda y col.,4 es citotóxico sobre los fibroblastos pulpares humanos, inhibe el ADN celular de una manera dependiente de la concentración, causa inflamación significativa después de 24 horas de aplicado, actúa básicamente por contacto y su efecto se neutraliza en presencia de materia orgánica como sangre o pus.
Abd Gami y col.,5) refieren que el fenol y sus derivados son irritantes para la piel, incluso en solución diluida; pueden causar necrosis, estimulación transitoria del sistema nervioso central (SNC) y depresión que conduce al coma. Se pueden acumular en bazo, riñón, hígado, corazón, cerebro y tejido adiposo, afectando la homeostasis de dichos órganos.
Ambikathanaya U.K.6 y Tingting G. y col.,7 coinciden en que los derivados fenólicos, al incrementar sus concentraciones en los líquidos extracelulares, penetran al interior de las células y son capaces de desacoplar la fosforilación oxidativa de la cadena transportadora de electrones en la mitocondria, lo que provoca disrupción en los mecanismos de obtención de energía (ATP), la producción de especies reactivas del oxígeno (EROs); además de provocar la peroxidación de lípidos de la membrana plasmática por activación del sistema citocromo P450.
Otros autores como Syed AU y col.,8, Bergantin LB.9 y Aiello AE,10 han profundizado en el funcionamiento de los canales de iones de potasio y calcio en la musculatura lisa vascular, así como su control por agonistas endógenos y algunos fármacos. Escasos artículos científicos citan el vínculo de estos canales con el mecanismo de acción de los fenoles clorados.
En Cuba, al igual que en otros países, se emplea el CP; se coloca en la entrada del conducto radicular (cámara pulpar) mediante bolillas de algodón embebidas, sin una norma estandarizada en cuanto al tamaño y dosis a aplicar de dicho agente químico. Es posible que este proceder terapéutico sea la causa de que, en un gran número de pacientes con TPR realizados en pulpa no vital, persista la inflamación, el dolor y la irritación de los tejidos periapicales. Se debe tener en cuenta además, que la acción antibacteriana del CP desaparece en un 90 % durante las primeras 24 horas, cuando se coloca en la cámara pulpar mediante un algodón embebido con el medicamento.4
Aunque la literatura contiene numerosos estudios sobre las características y acción del CP con base en el PCFA sobre los microrganismos, son escasos los reportes científicos de su efecto sobre el endotelio y la dinámica contráctil del músculo liso vascular, en especial de tejidos venosos como la vena porta hepática, vaso sanguíneo que garantiza al hígado un flujo de sangre constante para mantener la vida.11,12,13
Lo anterior se sustenta en lo planteado por Canalda y col.,4 al afirmar que el medicamento, cuando se deposita en el interior de los conductos radiculares, no limita su efecto a esta área. Se ha demostrado su distribución sistémica al difundir hacia los tejidos adyacentes a través del ápice radicular; se ha detectado en sangre y orina, aunque se desconoce la posible repercusión de estos hallazgos en el organismo.
Por todo lo antes planteado, se realiza la presente investigación con el objetivo de determinar el efecto del Camphenol Plus sobre el músculo liso vascular de la vena porta.
MÉTODOS
Se realizó una investigación experimental preclínica en el Instituto de Fisiología “Oscar Langerdorff”, Universidad de Rostock, Alemania, entre octubre y diciembre del 2018, con el propósito de determinar el efecto del Camphenol Plus sobre el músculo liso vascular de la vena porta.
Se tomaron como biomodelos 21 ratas Wistar de ambos sexos, con un peso entre 200-250 gramos, seleccionadas de forma aleatoria y sacrificadas mediante decapitación, previa anestesia por vía inhalatoria.
La muestra biológica estuvo constituida por 21 venas porta a las cuales después de retirársele el tejido adiposo perivascular, se les realizó con sumo cuidado, un corte horizontal, se preservó la integridad endotelial y de las células del músculo liso vascular (MLV).
Para cumplir el objetivo trazado se midieron las siguientes variables:
1. Tensión basal espontánea (TBE): tensión alcanzada por el músculo liso vascular tras la adición en solución Krebs fisiológica.
2. Tensión base inicial (TBI): tensión máxima alcanzada por el músculo liso vascular tras la preactivación con sustancias vasoactivas. Se registró al minuto cero.
3. Tensión inducida por Camphenol Plus: tensión alcanzada por el músculo liso vascular (previamente activado con sustancias vasoactivas), tras la adición de 10 µl de Camphenol Plus 3 %. Se registró al minuto uno, tres, cinco, siete y diez.
Para medir la TBE, las preparaciones biológicas se colocaron en un baño de órganos [Tissue Bath Station, BIOPACTM] con 30 mililitros de solución Krebs fisiológica (NaCl: 112; NaHCO3: 25; KH2PO4: 1,2; KCl: 4,7; MgCl2 + 6H2O: 1,2; CaCl2 + 2H2O: 3,6; Glucosa: 11,5 milimoles respectivamente), a 36,5ºC, se mantuvo un suministro continuo de carbógeno (95 % de O2 y 5 % de CO2). Posteriormente, se estandarizó dicha tensión mediante un peso de tracción de 1 g, con ajustes de calibración y, para garantizar su estabilidad, los anillos se lavaron con solución Krebs cada 15 minutos durante una hora.14,15
Para la investigación, se prepararon tres soluciones de Camphenol Plus a concentraciones del 3, 7 y 10 %, se utilizó como solvente orgánico el dimetilsulfóxido (DMSO). Este último fue añadido previamente a 13 preparaciones control, donde se comprobó que no ejerció efecto alguno sobre el músculo liso vascular de las venas porta.
Para medir la TBI, las muestras biológicas se preactivaron con solución Krebs concentrada en iones potasio (K+=80 mmol/L) hasta alcanzar la máxima constricción (meseta) aproximadamente a los 10 minutos. A continuación, se añadieron 10 microlitros de solución de Camphenol Plus y se registraron los niveles de tensión muscular resultante de manera continua durante diez minutos, se registraron para su estudio los minutos 1, 3, 5, 7 y 10.
Para obtener los registros gráficos de la actividad contráctil espontánea e inducida del músculo liso vascular, se empleó el software LabChart 7.2 de ADInstruments. Tales registros se almacenaron en soporte digital para su posterior análisis e interpretación. La información obtenida se procesó con el paquete estadístico SPSS (Statistical Package for Social Sciences) versión 22.0. Se empleó la media aritmética y desviación estándar.
El porcentaje de vasorelajación del músculo liso vascular inducido por Camphenol Plus para cada uno de los intervalos de tiempo, se calculó mediante la expresión matemática:
Por ciento de relajación vascular = [(Tensión Máxima Constricción - Tensión Inducida) / (Tensión Máxima Constricción - Tensión Basal Espontánea)] x 100
Se compararon los valores promedios de tensión registrados en los diferentes intervalos de tiempo con los de la tensión espontánea basal y tensión base inicial, a través de comparaciones de media relacionadas, con la aplicación de la prueba de Wilcoxon de los rangos con signo. Los valores de p < 0,05 se consideraron estadísticamente significativos.
Todo el diseño experimental se realizó de acuerdo a las normas éticas alemanas relacionadas con cuidado, uso y manejo de animales de experimentación.
RESULTADOS
Se resumen los valores promedios de TBE, TBI, así como los desarrollados por el músculo liso vascular de la vena porta tras adición de Camphenol Plus. Se observa cómo la tensión disminuyó de forma gradual con cada una de las concentraciones empleadas del medicamento en función del tiempo. (Gráf. 1)
Fuente: Registros LabChart 7.2 ADInstruments de los autores.
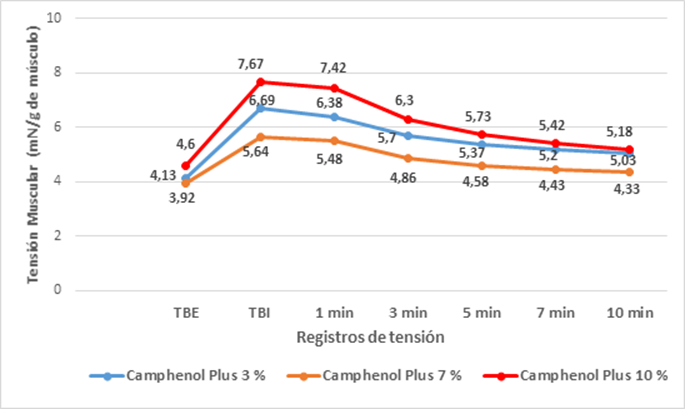
Gráf. 1 Tensión desarrollada por el músculo liso vascular de la vena porta en el tiempo tras la preactivación con solución Krebs (K+=80 mmol/L) y la adición de Camphenol Plus. Instituto de Fisiología “Oscar Langerdorff”, Universidad de Rostock, Alemania, entre octubre y diciembre del 2018.
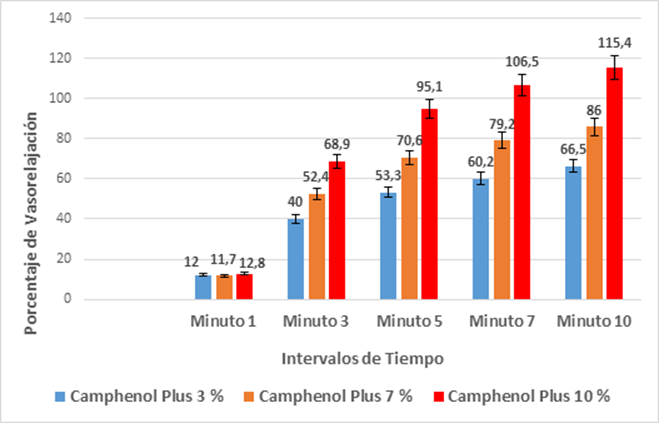
Las mayores variaciones de tensión se registraron en los minutos siete y diez con el empleo de solución de Camphenol 10 %, con una diferencia de 2,25 y 2,49 mN respectivamente en relación a la tensión base inicial (máxima vasoconstricción). En las restantes concentraciones, aunque la inhibición del músculo liso vascular fue menor, las variaciones registradas en la fuerza muscular fueron significativas en todos los intervalos de tiempo estudiados (Z<Zα (0,05); Z<-1,96; p<0,05).
El grado de relajación vascular y vasodilatación, se incrementó de forma escalonada según la concentración del medicamento desde el minuto uno.
En el tercer minuto el incremento de la vasodilatación es notable en todas las concentraciones, superando unas tres veces a la del minuto inicial a concentración del tres por ciento, y unas cuatro y cinco veces respectivamente a concentraciones del siete y diez por ciento.
A partir del minuto tres y hasta el diez para concentraciones del tres y siete por ciento, las diferencias porcentuales se mantuvieron con valores discretos de incremento; no así para concentración del diez por ciento, donde a partir del minuto cinco la relajación vascular se hizo extrema, superando el cien por ciento después del minuto siete.
Las pruebas estadísticas de U Mann Whitney realizadas en busca de diferencias significativas en relación con la tensión desarrollada al minuto 10 entre las distintas concentraciones, no arrojaron diferencias significativas (Z>-1,96; p>0,05). (Gráf. 2)
DISCUSIÓN
La actividad espontánea del MLV está presente en arterias pequeñas y algunos tejidos venosos como la vena porta hepática (VPH). La generación y propagación de señales eléctricas según los investigadores Patejdl R. y Noack T.,16 es un elemento clave de la función fisiológica en estos tejidos excitables, y se considera una función intrínseca de las células y los dominios subcelulares distribuidos por todo el tejido muscular liso.
Aunque en el MLV, la existencia de células especializadas oscilantes y transmisoras denominadas "intersticiales de Cajal o marcapasos" se discute de manera controvertida, en la VPH se han descrito las mismas desde el punto de vista morfológico y funcional, al estudiarse los nexos entre ellas, con las células musculares lisas, el acoplamiento excitación-contracción y la regulación de la concentración intracelular de iones calcio.
La actividad mecánica en la mayoría de los tejidos vasculares es el resultado de oscilaciones del potencial de membrana en "reposo" (PMR). Puede incrementarse en amplitud y frecuencia hasta un tono tetánico bajo estimulación con el agonista simpático noradrenalina, o en un líquido extracelular con altos niveles de potasio (hiperpotasemia); por el contrario, disminuir de forma marcada por la acción de neurotransmisores, hormonas o fármacos con acción vasorelajante.
Los resultados de la investigación, sugieren que “in vitro” el Camphenol Plus (CP) tiene efecto vasorelajante que varía según la concentración y el tiempo de exposición al medicamento. Esta acción vasorelajante podría ser explicada mediante dos posibles mecanismos combinados: el primero (a corto plazo), producción de derivados epoxilados del ácido araquidónico (AA) en el endotelio vascular, los llamados ácidos epoxieicosatrienoicos (EETs), obtenidos por las epoxigenasas de la familia 2 del citocromo P450 (CIP-450), que actuarían como factores hiperpolarizantes del endotelio (FHDE) no dependientes de óxido nítrico ni prostanoides, y que provocarían en el músculo liso vascular vasorelajación, al incrementar la apertura gradual y sostenida de canales de potasio con la consiguiente hiperpolarización de la membrana.17
El segundo mecanismo (a largo plazo) como sugiere Syed AU y col.,8 que el CP al desacoplar la fosforilación oxidativa de la cadena transportadora de electrones a nivel mitocondrial, reduzca la producción de trifosfato de adenosina (ATP) por debajo de un punto crítico de 1 mol/L, lo que conduciría a la activación de canales de potasio sensibles a ATP (KATP), involucrados en la regulación del flujo sanguíneo local, la consiguiente hiperpolarización de la membrana, el bloqueo de los canales de calcio dependientes de voltaje tipo L (CCDVs) y la vasorelajación resultante.
Los cambios más notables observados en cuanto al porcentaje de vasorelajación producidos por el CP, y ocurridos entre los minutos uno y tres tras la preactivación, guardan estrecha relación con el cierre de una fracción mayor de canales de calcio en un tiempo menor que en los restantes intervalos registrados. Durante la máxima vasoconstricción producida por la solución Krebs (K+=80 mmol/L), prácticamente todos los canales de calcio dependientes de voltaje, los operados por receptor y de estiramiento se hallan completamente abiertos; mayor es el influjo de calcio hacia el interior del sarcolema, su concentración en el interior de la fibra muscular lisa vascular y el número de puentes cruzados entre los filamentos de actina y miosina, traducido en el estado de máxima tensión considerado en el estudio realizado como tensión base inicial (TBI).
Tras la adición de los primeros microlitros de solución de CP a diferentes concentraciones, los EETs liposolubles producidos por el endotelio vascular con un tiempo de vida media corta y acción paracrina, 18,19 hiperpolarizan la membrana de la fibra muscular lisa de forma rápida, al causar en pocos minutos una apertura mayor de canales de potasio dependientes de voltaje (Kv), y de calcio de gran conductancia (BK), hecho evidenciado experimentalmente por el incremento del porcentaje de vasorelajación observado entre el minuto uno y tres.
En condiciones de hiperpotasemia [K+]e > 5 meq/L como la producida con solución Krebs (K+=80 mmol/L), se produce una disminución del gradiente de iones potasio desde el interior de la membrana en los primeros momentos, debido a que el sarcolema tiene normalmente una relativa alta permeabilidad a este ion por activación de varios de sus canales.20 Al transcurrir el tiempo y en función de la concentración, un número mayor de canales de potasio sensibles a ATP se abren, igual número de canales de calcio se cierran, hasta el punto de producir una relajación total de la vasculatura venosa, como la observada a partir del minuto cinco a concentraciones de Camphenol Plus al 10 %.
Al comparar los valores promedios de tensión registrados en los diferentes intervalos de tiempo, con los de la tensión base inicial en cada concentración de medicamento empleado, se pudo comprobar con un nivel de significación de 0,05; que existieron diferencias significativas, lo que confirma que el Camphenol Plus, modifica la dinámica contráctil del músculo liso vascular de la vena porta en función de la concentración y el tiempo, lo que produce vasorelajación.
Se sugiere para futuras investigaciones dadas las limitaciones del estudio, incrementar el número de muestras y el intervalo de tiempo, ya que los clorofenoles son resistentes a la biodegración, se pueden acumular en órganos como el hígado, y alterar la homeostasis de dicho órgano.
Se concluye que el Camphenol Plus, indujo “in vitro”, relajación de la musculatura lisa vascular en la vena porta de ratas Wistar, a través de un acoplamiento excitación-contracción de tipo farmacomecánico.
Los resultados demuestran la necesidad de tener en cuenta el uso adecuado del Camphenol Plus, en cuanto a la cantidad a utilizar en los tratamientos aplicados en casos de infecciones pulporradiculares, así como en el tiempo de aplicación. Es necesario considerar que este antiséptico colocado en el conducto radicular, difunde hacia los tejidos adyacentes al ápice de la raíz dentaria, así como, la poca información relacionada con la acción del mismo en el músculo liso vascular.