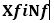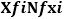INTRODUCCIÓN
El dominio de las radiaciones con fines terapéuticos ha revolucionado la medicina y en especial las tecnologías de radiación para el tratamiento del cáncer como campo de investigación de la oncología; historia que tuvo sus comienzos en 1895, con el descubrimiento por accidente de los rayos X por Röntgen. Poco tiempo después a finales de enero de 1896, Grubbé en Chicago trató a la primera paciente con cáncer de mama con rayos X. Otros descubrimientos realizados abrieron el camino a la comprensión, uso y dominio de las radiaciones en la medicina, lo que sentó las bases de la física médica y en especial, de las radiaciones en la oncología. (1
El concepto de garantía de calidad en radioterapia abordado por la OMS en la norma ISO-6215-1980,2 ha orientado, entre otros factores, la necesidad de administrar una radioterapia de alta precisión geométrica, lo cual exige como un requisito previo, conocer con la precisión requerida la localización y extensión del tumor y los órganos críticos circundantes.
Existen estudios3 muy consistentes y evidencias empíricas que demuestran los efectos nocivos de las radiaciones cuando inciden en regiones no enfermas. Puede ocasionar complicaciones dermatológicas, gastrointestinales, genitourinario, neurológicas, óseas, entre otras. Ello impulsó a los investigadores a lo largo de la historia de la oncología terapéutica por radiaciones a transitar de las “más simples e imprecisas” formas de localización por visualización o palpación, al uso de bario y yodo, a lo que se conoce en la actualidad como la radioterapia guiada por imágenes, (Image-Guided Radiation Therapy, IGRT). Estas emplean la resonancia magnética (MRI), las diferentes tecnologías de tomografía computarizada (TC), de kilovoltaje (Conebeam TC, CBCT), de megavoltaje (MVCBCT), así como la TC helicoidal de haz en abanico de megavoltaje (heli cal Megavoltaje TC, MVCT), las que se utilizan para el diagnóstico, y ayuda a los oncólogos radioterapeutas a especificar su objetivo.4
Mucho ha tenido que ver con esa evolución, el desarrollo tecnologías y procedimientos para la localización de los tumores, dado que están presente durante todas las etapas de tratamiento a la enfermedad, en el diagnóstico, la simulación, la delimitación del volumen, el cálculo dosimétrico, la impartición del tratamiento, y el seguimiento al paciente. En la actualidad en la llamada era de radioterapia ICRT se han conseguido márgenes de error comprendidos entre 3 a 5mm.5,6
Es por ello que la precisión, la reducción de las incertidumbres geométricas es objetivo constante de preocupación; para lograr su reducción debe tenerse presente que las incertidumbres pueden estar asociadas a movimientos externos del paciente y a movimientos internos del tumor, dados por cambios orgánicos del tumor o de otros órganos proximales. Para elevar la eficiencia del tratamiento estas incertidumbres deben ser evaluadas día a día en el contexto del tratamiento,7 con el objetivo de realizar las correcciones necesarias desde el punto de vista de geométrico y dosimétrico. Aspecto que ha dado lugar a una práctica radioterápica conocida como radioterapia adaptativa (Adaptive Radiation Therapy, ART).8
Las incertidumbres geométricas pueden ocurrir en la fase preparatoria y durante la fase de ejecución de la radioterapia (es decir, antes y durante el curso del tratamiento, respectivamente).9 Los errores geométricos que ocurren durante el curso del tratamiento pueden ser sistemáticos y/o aleatorios (variación diaria o movimiento de órganos durante una sola fracción).10 Se ha demostrado que los errores sistemáticos tienen un mayor impacto en la dosis administrada al objetivo que los errores aleatorios.11,12 Es decir, la pérdida de Probabilidad de Control de Tumores (TCP) con una distribución de error sistemática dada, es mayor que con una distribución de error aleatorio similar.11 Por lo tanto, para mantener un alto nivel de precisión geométrica, lo más importante es minimizar las incertidumbres geométricas sistemáticas.
Con el objetivo de reducir al mínimo los errores sistemáticos, es necesario realizar un riguroso proceso de delineación. Para ello, el radiólogo cuenta con la información clínica de los pacientes (anamnesis, exploración física, patología e imagenología) la cual permite evaluar la localización y extensión del tumor.
En tal sentido, se precisa el volumen tumoral macroscópico (GTV) que permite conocer la extensión y ubicación macroscópicas demostrables del tumor, el volumen clínico diana (CTV) y el volumen objetivo de planificación (PTV). Este último, como herramienta recomendada para dar forma a las distribuciones de dosis absorbidas a fin de garantizar que, la dosis absorbida prescrita realmente se administre a todas las partes del CTV, con una probabilidad clínicamente aceptable. La delimitación del PTV utiliza el conocimiento de la presencia y el impacto de las incertidumbres y variaciones, tanto en la ubicación del tumor como en los parámetros de la máquina.13
Otro de los elementos a tener presente, está relacionado con la exposición de tejidos de órganos sanos, es decir, no objeto de las radiaciones, los cuales podrían sufrir morbilidad significativa.14 Ello conduce a evaluar los órganos en riesgo (Organs At Risk, OAR),15 a través de la planificación del volumen de órganos en riesgo (VPP). Para garantizar una preservación suficiente del tejido normal se pueden utilizar reglas de prioridad en el sistema de planificación o se pueden subdividir el PTV o PRV en regiones con diferentes restricciones de dosis absorbida. En cualquier caso, se recomienda que la dosis absorbida se informe en la PRV y PTV completas.
Para lograr incertidumbres en los rangos óptimos, se puede emplear la radioterapia de arco volumétrico modulado (VMAT);16,17 técnica novedosa, desarrollada a partir de la terapia de arco de intensidad modulada. Por lo general, puede administrar 2 Gy-fracciones, con una dosis alta de conformidad con el objetivo y, al mismo tiempo, preservar el tejido circundante sano, todo en menos de dos minutos.8 La alta precisión del tratamiento ofrece la posibilidad de minimizar las incertidumbres geométricas. El algoritmo que optimiza el plan de tratamiento permite administrar la dosis durante una rotación completa de 360° del pórtico. El requisito tecnológico es un acelerador lineal médico rotacional equipado con un colimador multiláminas dinámico (MLC), que permite variar la tasa de dosis y unido a una velocidad de rotación del pórtico que se puede ajustar según los requerimientos del tratamiento.9
La investigación se realizó con el objetivo de determinar el margen de error de la configuración, y el movimiento de órganos en la determinación de la posición del Clinical Target Volumen basadas en la tomografía computarizada de haz cónico de kilovoltaje en el tratamiento al cáncer de próstata, así como cuantificar el movimiento de los órganos durante la terapia conformal de la próstata obtenida un margen para la próstata.
MÉTODOS
Investigación experimental donde se asumió el método radioterápico de la adaptación día a día. Se seleccionaron los pacientes registrados de enero a abril del 2017 de Oncología Radioterápica del Hospital Universitario de la Universidad de Verona en Italia, con adenocarcinoma de próstata en estadios T1 a T4, los cuales fueron tratados mediante terapia de arco volumétrico modulado. Todos los pacientes aceptaron participar en el estudio, la muestra quedó conformada por 33 pacientes, la fase de tratamiento se realizó según los códigos éticos establecidos en dicha institución hospitalaria.
Se adquirieron imágenes volumétricas diarias de CT de haz cónico, después de la configuración para todos los pacientes con tres marcadores fiduciales intraprostáticos (16) y sin marcadores fiduciales intraprostáticos. Se analizaron un total de 15 090 imágenes volumétricas de los 33 pacientes, en dos grupos: pacientes que no fueron tratados con semillas fiduciales y pacientes que fueron tratados con semillas fiduciales.
En los pacientes que no fueron tratados con semillas fiduciales, el hueso pélvico de la tomografía de simulación se comparó con el hueso pélvico del CBCT, mientras que el emparejamiento para la próstata se basó en la localización perceptible del tumor y el llenado de la vejiga, así como en la anatomía ósea pélvica. Se consideró óptima la alineación cuando el borde posterior de la próstata, el hueso pélvico y la superficie anterior del recto, coincidían.
Para pacientes que fueron tratados con semillas fiduciales, el emparejamiento para la próstata, se basó en esta semilla fiducial, que es una técnica convencional que se utiliza para medir el movimiento de la próstata. Estas semillas fiduciales fueron colocadas tres semanas antes por el médico, bajo una guía de ultrasonido.
La selección de los pacientes se realizó a partir de la utilización de la terapia de arco volumétrico modulado (VMAT) con la aplicación de una dosis prescrita al menos el 95 % del volumen de interés. Las dosis prescritas están pensadas como dosis mínimas para CTV, mientras que los PTV deben recibir esa dosis al 95 % o más, preferiblemente al 98 %. La dosis máxima para el 2 % o menos de PTV no debe exceder la dosis recetada en más del 7 %, incluso si se puede aceptar un 10 % o menos. Esta dosis máxima de PTV no debe ser motivo de preocupación para los órganos en riesgo y la dosis máxima de PTV en sitios no objeto de radiaciones (OAR) no debe exceder la dosis recetada.
Todas las tomografías computarizadas se realizaron en la posición de tratamiento. El paciente fue colocado en decúbito supino e inmovilizado mediante un sistema de fijación de rodilla y fijación de pies, con el sistema de inmovilización Combifix. Con la característica principal de tener un sistema de posicionamiento de pedal graduado. Dado que uno de los elementos fundamentales de un tratamiento de radioterapia es la reproducibilidad, fue necesario buscar el mismo estado de la vejiga y el recto; pues estudios realizados18,19,20 demuestran que su llenado es una variable interviniente en la radiación, ya que modifica la posición entre órganos y genera un aumento de la probabilidad de órgano en riesgo. Por ello, se propone que la vejiga no esté completamente vacía (el paciente debe orinar y beber inmediatamente ½ litro de agua, 15 minutos antes de la CT de centrado y cada sesión de radioterapia). En cuanto a la reproducibilidad del recto, el paciente debe mantenerlo lo más vacío posible.
En primer lugar, se realiza una vista scout y se identifica un posible isocentro de tratamiento con la colocación sobre la piel de tres marcadores radiopacos para la definición del origen. Luego, se realiza TC con grosor de corte de 2-3 mm y paso de 3 mm, al tatuar las posiciones de los tres puntos de referencia en el paciente en previsión de procedimientos de simulación virtual off-line. La TC para el plan de cuidados debe tener una extensión de la longitud del cráneo superior a 6 cm por encima de los límites definidos.
La adquisición de las imágenes en todos los pacientes, se realizaron mediante TC con un escáner de TC helicoidal Somatom Emotion 6, con grosor de corte de 3 mm. Las imágenes de TC resultantes se transfirieron al sistema de planificación del tratamiento Eclipse. El tiempo de adquisición es de aproximadamente 30 segundos en modo pelvis con rotación de pórtico de 360°. Todas las imágenes kV-CBCT adquiridas tienen una longitud de exploración suficiente para cubrir el objetivo completo con un grosor de corte de 3 mm. Se realizó el procedimiento de registro entre las imágenes CBCT adquiridas y las imágenes CT de planificación.
La delineación de objetivos a partir del volumen tumoral bruto (GTV) de cada paciente se determinó sobre la base de las imágenes de resonancia magnética (MRI), se compararon con las imágenes de TC originales. El contorneado de volúmenes objetivo se realizó a través del software del sistema de planificación Eclipse 15.5* del fabricante Varian Medical Systems, se contornearon de forma interactiva la próstata, las vesículas seminales, la vejiga y el recto.
La delimitación del CTV supone que no hay células tumorales fuera de este volumen. En el caso de la RT posoperatoria, el CTV debe incluir un volumen de 5 mm en todas las direcciones (excepto la pared rectal) para la extensión microscópica; 5 mm adicionales en la dirección posterior y lateral en presencia de resección incompleta, se excluyó la pared rectal; 5 mm adicionales en la dirección de los márgenes tumorales microscópicamente positivos (excepto la pared rectal).
En los tratamientos posoperatorios, se debe incluir el sitio original de la base de la vesícula seminal. En el caso de tratamiento de rescate, el CTV debe relacionarse con el alojamiento prostático con recaída. Para definir el PTV se añade un margen 3D al GTV bajo una expansión automática anisotrópica en las direcciones, frontal, posterior, cráneo-cauda y lateral de 0,4 cm en la dirección posterior y 0,6 cm en las restantes direcciones.
En la valoración de los OAR por proximidad deben atenderse el recto, la vejiga, las cabezas femorales y el bulbo del pene. En cuanto al recto, se contornea el perfil externo para evaluar la dosis y la toxicidad a todas las estructuras anatómicas del órgano y no solo a la mucosa. De acuerdo con las pautas de la EORTC-RTOG, el área cubierta por la unión recto-sigma al orificio anal está rodeada. Para rangos de dosis totales de 70-78 Gy, 60-70 % del recto debe recibir menos de 40 Gy, 40-45 % no más de 60 Gy y 70 Gy pueden recibir menos de 20-25 %. En el caso de la vejiga se ramifica en toda su longitud con especial atención a determinar el límite entre la base de la próstata y la propia vejiga. Otros OAR a considerar son las cabezas femorales y el bulbo del pene. Se considera el mismo rango de dosificación total utilizado para el recto, menos del 30-40 % de la vejiga debe recibir 65Gy, menos del 30-50 % del volumen de 70Gy y 75Gy puede afectar un volumen inferior al 10 %. La dosis máxima para los bulbos femorales y peneanos debe ser inferior a 50Gy.
La configuración de verificación para evaluar la cobertura del volumen objetivo, se realizó con radioterapia guiada por imágenes de anatomía ósea diaria, llamada tomografía computarizada de haz cónico de kilovoltaje KV-CBCT17 que es una modalidad de tecnología de punta para la guía de imágenes, ya que produce imágenes tridimensionales de la región de interés del paciente un tiempo relativamente corto (1-3 min) con una calidad suficiente para el propósito de alinear al paciente.
El uso de esta modalidad para verificar la ubicación del paciente y el objetivo inmediatamente antes de la aplicación de la radioterapia se ha extendido ampliamente en los últimos años. Se conoce como radioterapia guiada por imágenes (IGRT). La orientación precisa del tumor es muy importante y las imágenes pueden ser de gran ayuda en este proceso. Por lo tanto, la garantía de calidad de los sistemas de imágenes utilizados para guiar el haz también es esencial. Se podría argumentar que es tan crítico como la garantía de calidad para la salida de la dosis de radiación, ya que la cantidad correcta de dosis de radiación administrada a la ubicación incorrecta puede ser tan perjudicial como la cantidad incorrecta de dosis de radiación a la ubicación correcta.
Se asumió una fase que los autores llamaron exploratoria que integra ART offline y online con las imágenes tridimensionales obtenidas con anterioridad, esto con el fin de corregir casi todos los grandes errores sistemáticos de configuración mediante el análisis en línea (online) y fuera de línea (offline) de un número limitado de imágenes obtenidas del (CBCT). Anteriormente se trabajó en una técnica de correlación de imágenes tridimensional (3D) basada en la coincidencia de bordes, en general, la técnica de coincidencia de bordes. Se trabajó con 33 pacientes, de ellos 24 fueron tratados con semillas fiduciales es una técnica convencional utilizada para medir el movimiento de un órgano, que consiste en localizar puntos de referencia en el órgano y en la anatomía ósea y comparar la distancia entre estos puntos de referencia en exploraciones posteriores (TC).
El movimiento relativo del hueso pélvico viene dado por las rotaciones y traslaciones encontradas por el algoritmo de coincidencia cuando se empareja solo en el hueso pélvico. Después de la coincidencia, el movimiento de los órganos se visualiza en imágenes compuestas o en color lavado. El movimiento relativo de un órgano se cuantifica al seleccionar el órgano y realizar un emparejamiento con la utilización de los contornos del órgano, con el emparejamiento pélvico como punto de partida. (Fig. 1) El algoritmo de coincidencia encuentra la rotación y traslación 3D necesarias para alinear el órgano seleccionado desde la posición en la que está alineado el hueso pélvico. Estas rotaciones y traslaciones describen directamente el movimiento del órgano en relación con el hueso pélvico. Con este método, se cuantifica el movimiento de la próstata y de cada fémur en relación con el hueso pélvico.
La coincidencia ósea se verifica al seleccionar un corte de un escaneo y calcular el corte correspondiente por interpolación trilineal del otro escaneo, con la utilización de los valores de rotación y traslación conocidos del emparejamiento. Un médico completó las imágenes y la verificación adicional, al hacer una corrección en línea, con leves ajustes manuales que se consideró clínicamente necesario. Se realizó además, una coincidencia de corrección en línea para los pacientes basada en FM, anatomía ósea y tejido prostático blando (CBCT) a partir de los cambios de traslación registrados en el archivo de registro de imágenes de la ficha electrónica del paciente. La alineación se consideró óptima cuando el borde posterior de la próstata y la superficie anterior del recto coincidían.
Una vez realizada la corrección online se procedió a administrar el tratamiento, como establecen los protocolos. Al concluir el tratamiento se realizó una corrección tipo offline con el objetivo de corregir el error medio del paciente sin corregir la variación diaria. Permiten un gran paso en la reducción de márgenes con una carga de trabajo limitada. Los procedimientos estadísticos para impulsar las correcciones fuera de línea se han abordado ampliamente desde el campo de las imágenes de portales electrónicos. En esta investigación se empleó el procedimiento de ventana móvil con el empleo de la radioterapia de intensidad modulada (VMAT), se obtuvieron 15 090 correcciones offline. Los datos de corrección para la próstata se recopilaron en un software de registro como Offline Review (Siemens Medical System). Tanto el órgano en movimiento como la variación de la configuración provocan errores sistemáticos y aleatorios.
Conocidos estos datos se procedió a calcular los errores sistemáticos y aleatorios. El error sistemático se interpreta como la variación promedio de la geometría de la irradiación con respecto a la geometría del plano. Este tipo de error se detectó con el cálculo de la media de los valores considerados por la fórmula a continuación, en la que se representan los valores individuales del grupo de datos y el número de componentes del grupo:
Después del cálculo del error sistemático se procedió al cálculo de los aleatorios, correspondientes a las variaciones introducidas durante la ejecución real del tratamiento. En este caso, se calculó la desviación estándar de los datos registrados para cada paciente para su detección. La fórmula utilizada fue la siguiente, donde, como antes, representa los valores individuales del grupo de datos considerado, el número de miembros del grupo y el promedio de los datos del grupo:
Durante el trabajo se decidió calcular tanto el error aleatorio en las sesiones como en todo el tratamiento.
Procedimiento matemático para el cálculo del margen de PTV
Para el cálculo del margen de PTV se utilizó la fórmula de Van Herk, donde Σ representa la incertidumbre sistemática y σ la aleatoria. Las incertidumbres aleatorias son fluctuaciones estadísticas, mientras que las incertidumbres sistemáticas a menudo se deben a un problema que persiste durante todo el tratamiento.
Uno de los objetivos generales del proyecto era corregir el movimiento del paciente y el objetivo y reducir el margen entre el volumen objetivo clínico (CTV) y el volumen objetivo de planificación (PTV). Para estimar la posible reducción del margen, se utilizó la fórmula del margen, definida por Van Herk y col.,10 la cual define el margen de PTV (M) como:
Para realizar el cálculo de errores se utilizará la fórmula de Van Herk aplicada desde el año 2000 para el cálculo de los márgenes de PTV, la cual integra los errores sistemáticos y aleatorios.
RESULTADOS
La variación de la configuración expresa el movimiento de la anatomía ósea con respecto al sistema de coordenadas CT o Linacs, y el movimiento del órgano son los cambios del tumor en comparación con la anatomía ósea. La teoría y prácticas radioterápicas advierten que, tanto los errores sistemáticos, como los aleatorios, ocurren como consecuencia de la divergencia entre el valor de la geometría de irradiación media y la geometría en el plan de tratamiento llevado a cabo, en las tres direcciones posibles: anteroposterior, cráneo - caudal, lateral.
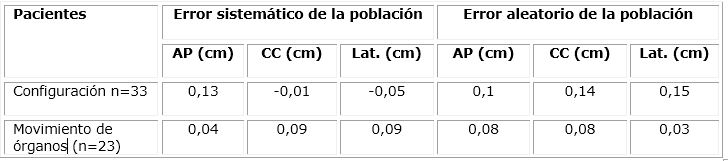
El primer paso para lograr los objetivos es encontrar errores sistemáticos y aleatorios en base a los datos registrados para cada paciente. Se observan las distribuciones globales de la corrección de la variación de la configuración. (Tabla 1)
Los resultados demuestran que la incertidumbre por configuración es pequeña. En lo referente a los errores sistemáticos se manifiesta de la siguiente manera:
En la dirección anteposterior está comprendida entre -0,83 y +0,76, en la dirección cráneo-cuadal -0,57 y +0,57, en la dirección lateral está comprendido entre +0,10 y 0,53.
Dentro de la muestra de 33 pacientes solo se manifiestan dos valores atípicos relacionados con los pacientes 25 en la posisión anteposterior con valor de -0,820 y el paciente 28 en la posición lateral con un error de -0,777.
En la dirección anteroposterior, el valor -0,820 del paciente 25 que se considera un valor atípico por lo que los desplazamientos de la configuración son demasiado grandes en relación con los otros pacientes.
En la dirección lateral, el valor -0,777 del paciente 28 que se considera un valor atípico por lo que los desplazamientos de la configuración son demasiado grandes en relación con los otros pacientes.
En la dirección cráneo-cuadal, los valores están muy cerca, no hay valores atípicos.
Los errores aleatorios son menos frecuentes y tienen menos relevancia en la configuración, con un rango mucho menor en la incertidumbre de ocurrencia de los mismos:
En la posición anteposterior +0,10 y +0,53,
En la dirección cráneo-caudal +0,15 y +0,53
En la dirección lateral +0,15 y +0,88
Para la representación gráfica de la dispersión de los valores obtenidos se ha usado una representación en una gráfica BoxPlots. Se consideró un valor atípico para la variación de la configuración y el movimiento de los órganos que son demasiado grandes en relación con los otros pacientes. (Fig. 1)
Dentro de los datos obtenidos en la dirección anteposterior los pacientes 9, 12 y 25 aportan valores atípicos en la distribución, 0,422, 0,465 y 0,532, dentro de la población de pacientes tratados. De igual manera en la dirección cráneo-caudal se observan valores atípicos 0,946, 0.555 de los pacientes 10 y 17 lo cual se considera un valor atípico de ahí que se consideran desplazamientos demasiado grandes de la configuración en relación al resto de pacientes. En la dirección lateral se observan valores 0.884, 0.79 de los pacientes 12 y 17.
De igual manera se realizó el estudio de los errores sistemáticos y aleatorios en el movimiento de órganos para 23 pacientes. (Tabla 2)
Se puede observar que, para el movimiento del órgano, el grado de dispersión del error sistemático, la distribución es estrecha:
- 0,48 a +0,072 en la dirección anteroposterior.
En la dirección cráneo-caudal está comprendido entre -0,042 y +0,11.
En la dirección lateral el interval fluctúa entre +0,042 y +0,11.
De igual manera, la dispersión de los valores en el error aleatorio es estrecha:
En la dirección anteroposterior entre +0,08 y +0,50.
En la dirección cráneo-caudal entre +0,05 y +0,19.
En la dirección lateral los valores están entre +0,046 y +0,18.
En la dirección anteroposterior se observa valor -0,12, -0,48, -0,036 de los pacientes 1, 3, 10, un valor atípico; por lo que se consideran desplazamientos demasiado grandes de la configuración en relación a los otros pacientes. (Figura 2)
En la dirección craneal caudal, el valor -0,04, -0,04, de los pacientes 1, 3, se toma como un valor atípico, por lo que se consideran desplazamientos demasiado grandes de la configuración en relación con los otros pacientes.
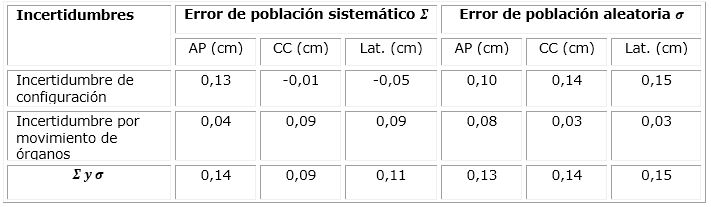
Las distribuciones globales de la variación de la configuración y el movimiento de órganos para el tratamiento del cáncer de próstata para toda la población, expresado a través de los errores sistemáticos y aleatorios en las posiciones anteroposterior, cráneo-caudal y lateral. Se puede observar que los valores obtenidos están comprendidos en los rangos de la llamada radioterapia eficiente. (Tabla 3)
Se muestran también los resultados de la incertidumbre sistemática y aleatoria, magnitudes indirectas resultado de la determinación de los errores sistemáticos y aleatorios por configuración y movimiento de órganos. (Tabla 4)
El cálculo de los márgenes de PTV obtenidos en el tratamiento de radioterapia adaptativa de la población estudiada, si se suponen correcciones sistemáticas perfectas y al utilizar la DE sobreestimada como errores aleatorios, serían: AP 4,4 mm, CC 3,3 mm y LAT 3,7 mm.
DISCUSIÓN
El empleo de la radioterapia adaptativa día a día, guiada por imágenes IGRT, en particular, la CBCT de kV mediante VMAT ha permitido, según los datos ofrecidos por la tomografía de simulación, reducir significativamente las incertidumbres por configuración y por movimiento de órganos, tanto las de naturaleza sistemáticas, como las aleatorias. Unido al uso de las técnicas anteriormente descritas, un factor condicionante de estos resultados es el sistema de inmovilización Combifix para lograr la reproducibilidad de configuración y la inmovilización consciente del paciente.
Tal y como se ha descrito en la literatura especializada,8,9,10 los errores geométricos sistemáticos son los de mayor incidencia, lo cual se corrobora para el caso de los errores por configuración, donde se observa que se reduce sustantivamente la dispersión de los valores obtenidos. Lo cual significa que el protocolo de la ART debe gestionarlo adecuadamente a partir de las correcciones offline y online. Cabe destacar que los valores obtenidos, tanto de los errores sistemáticos, como aleatorios por configuración, están comprendidos en los intervalos de alta precisión geométrica.
Es importante resaltar el estado de satisfacción logrado a partir de las incertidumbres por movimiento de órganos por alineación de la próstata, el recto y el hueso pélvico, las cuales muestran una dispersión en valores bien reducidos y con una cantidad de datos atípicos muy reducida en la población estudiada.
Los valores de los errores sistemáticos y aleatorios por configuración y por movimiento de órganos condicionan que los márgenes de PTV sean adecuados para ofrecer un tratamiento radioterápico seguro, al disminuir significativamente los OAR y posibilitar la dosis adecuada de radiación.
Las distribuciones globales de la variación de la configuración y el movimiento de órganos para el tratamiento del cáncer de próstata para toda la población, expresado a través de los errores sistemáticos y aleatorios en las posiciones anteroposterior, cráneo-caudal y lateral coinciden con la literatura.7,8,9,10 Lo cual se sustenta en que el empleo de la radioterapia adaptativa día a día permite el logro de márgenes admisibles en el tratamiento del paciente, minimiza la exposición de órganos que no son objeto de radiación y por tanto, disminuye los efectos nocivos, lo cual mejora la calidad de vida del paciente.
La investigación aporta gran validez al empleo de radioterapia adaptativa día a día, pues posibilita la realización de correcciones en función de las imágenes que se obtienen sobre la marcha en el proceso de planificación.
Los resultados obtenidos en el cálculo de los márgenes de PTV, en el tratamiento de radioterapia adaptativa permiten corroborar la importancia que tiene la reproducibilidad en la radioterapia guiada por imágenes día a día centrada en aspectos de la morfología de cada paciente, en las tres direcciones concebidas, anteroposterior, cráneo-cauda y lateral. Estos resultados fueron corroborados con el seguimiento clínico de los pacientes y el uso de otras técnicas de imagenología para validad que no ha existido afectación por radiación a los órganos en riesgo.
Cabe destacar que valoraciones clínicas, acompañadas imágenes y otros estudios de laboratorio, corroboraron la no existencia de complicaciones significativas por radiación en órganos en riesgo causados por la exposición indebida por incertidumbres.
AGRADECIMIENTOS
Los más sinceros agradecimientos a la Universidad de Trieste, Italia, a los profesores del Master Avanzado en Física Médica y al Centro Internacional de Física Teórica Abdus Salam. En especial al Dr. C. Carlo Cavedón, orientador de esta investigación y a los doctores Alessio Pierelli, Paolo Maria Polloniato y al Departamento de Oncología Radioterápica del Hospital Universitario de la Universidad de Verona en Italia.