Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Fitosanidad
versión On-line ISSN 1818-1686
Fitosanidad v.13 n.3 Ciudad de la Habana jul.-sep. 2009
Ecología
Caracterización de cepas de Bacillus thuringiensis Berliner y actividad biológica hacia Spodoptera frugiperda (J.E. Smith) (Lepidoptera: Noctuidae) y Anticarsia gemmatalis Hübner (Lepidoptera: Noctuidae)
Caracterization of Bacillus thuringiensis Berliner Strains and Biological Activity on Spodoptera frugiperda (J.E. Smith) (Lepidoptera: Noctuidae) and Anticarsia gemmatalis Hübner (Lepidoptera: Noctuidae)
Yamilé Baró Robaina,¹ Deise M. fontana Capalbo² y Rosely Dos Santos Nascimento²
¹Instituto de Investigaciones de Sanidad Vegetal. Calle 110 no. 514 e/ 5.a B y 5.a F, Playa, Ciudad de La Habana, CP 11600, ybaro@inisav.cu
²Embrapa Medio Ambiente, Jaguariuna, SP, Brasil
RESUMEN
Se realizó la caracterización de nueve cepas cubanas de Bacillus thuringiensis según la morfología del cristal, la determinación del patrón de proteínas Cry y la actividad biológica frente a los insectos lepidópteros Spodoptera frugiperda y Anticarsia gemmatalis. Se observó la típica morfología bipiramidal en todas las cepas, y además la presencia de inclusiones cúbicas. El patrón de proteínas Cry obtenido correspondió con el de la cepa estándar internacional de B. thuringiensis var. kurstaki cepa HD1, en el que se observan dos bandas bien definidas correspondientes a la proteína Cry 1 (130 kDa) y Cry 2 (70 kDa). En la evaluación de la actividad biológica las cepas LBT 4 y LBT 7 causaron el 100% de mortalidad frente a S. frugiperda, mientras que las LBT 4, LBT 7, LBT 13 y LBT 47 provocaron el 100% de mortalidad para A. gemmatalis.
Palabras claves: Bacillus thuringiensis, d-endotoxinas, Spodopterafrugiperda, Anticarsia gemmatalis, actividad biológica
ABSTRACT
This study describes the characterization of nine Cuban Bacillus thuringiensis strains based on crystal morphology, SDS polyacrylamide electrophoresis (PAGE) and insecticidal activity against Spodoptera frugiperda and Anticarsia gemmatalis.Ultrastructural analysis of parasporal bodies of the nine strains showed the typical bipyramidal crystal and cubic inclusion partially embedded in the middle of the bipyramidal crystal. The PAGE analysis showed two bands of 130 kDa and 70 kDa belongs to Cry 1 and Cry 2 protein present to HD1 standard strains B. thuringiensis var. kurstaki.The strains LBT 4 and LBT 7 analyzed in this report showed potential as biological insecticide against S. frugiperda and LBT 4, LBT 7, LBT13 and LBT47 strains showed 100% of mortality to Anticarsia gemmatalis.
Key words: Bacillus thuringiensis, d-endotoxins, Spodoptera frugiperda, Anticarsia gemmatalis, biological activity
INTRODUCCIÓN
Bacillus thuringiensis Berliner, 1915 se caracteriza por su habilidad para producir cristales parasporales durante la fase de esporulación. La morfología, tamaño y número de las inclusiones parasporales varía entre las diferentes cepas de B. thuringiensis. Estos cristales están compuestos de proteínas denominadas δ-endotoxinas o proteínas Cry. Su peso molecular oscila entre 25 y 140 kDa, y constituyen del 20 al 30% del contenido de la bacteria. Estas toxinas presentan actividad insecticida hacia diversos órdenes de insectos, principalmente lepidópteros, dípteros y coleópteros [Del Rincón-Castro et al., 2006; Iñigo et al., 2006], y están codificadas por múltiples genes presentes en grandes plásmidos. Hasta la fecha se han clasificado 332 δ-endotoxinas dentro de 47 grupos de proteínas Cry, 22 proteínas Cyt en dos grupos y otras seis proteínas de B. thuringiensis que no se han clasificado dentro de un grupo específico [Crickmore et al., 2005]. Las proteínas tóxicas hacia larvas de lepidópteros pertenecen a los grupos Cry 1, Cry 2 y Cry 9. Dentro del grupo Cry 1 existen alrededor de diez subclases diferentes, y cada una tiene un rango de actividad específico contra diferentes insectos lepidópteros [Bobrowski et al., 2001; Del Rincón-Castro et al., 2006]. E
l uso de B. thuringiensis como insecticida comercial en la agricultura por más de cuarenta años se basa en su alta especificidad y eficiencia hacia las diferentes plagas, y la no toxicidad hacia insectos, plantas y vertebrados no blancos.
El gusano cogollero del maíz (Spodoptera frugiperda (J. E. Smith, 1797) (Lepidóptera: Noctuidae)) es una de las principales plagas de este cultivo en regiones tropicales y subtropicales de América [Del Rincón-Castro et al., 2006]. En Cuba y en numerosos países de la región se reportan pérdidas provocadas por esta plaga de hasta el 40% de la producción. Es por ello que la obtención de productos insecticidas contra esta plaga resulta de vital importancia [Ayra et al., 2006].
El gusano terciopelo (Anticarsia gemmatalis Hübner) es la especie más importante del complejo de defoliadores de la soya, y causa grandes daños en el cultivo en la mayor parte de las áreas donde se siembra esta planta, provoca reducciones drásticas en el área foliar y disminuye la fotosíntesis y la productividad [Bobrowski et al., 2001].
Actualmente el cultivo de la soya es de gran importancia económica para el país, por ser una de las fuentes más promisorias de concentrados proteicos, aceite vegetal y lecitina, rubros importados por Cuba. Al tener en cuenta el interés en comenzar la producción de soya en unas 5000 ha, resulta imprescindible contar con cepas promisorias para controlar las plagas que afectan este cultivo [Hernández et al., 2004].
De acuerdo con los antecedentes ya mencionados, el objetivo de este trabajo fue la caracterización de nueve cepas de B. thuringiensis según la morfología del cristal, el patrón de proteínas Cry y la evaluación de su actividad biológica frente a Spodoptera frugiperda y Anticarsia gemmatalis.
MATERIALES Y MÉTODOS
Se emplearon nueve cepas de B. thuringiensis pertenecientes a la colección del Instituto de Investigaciones de Sanidad Vegetal (LBT-4, LBT-5, LBT-7, LBT-9, LBT-12, LBT-13, LBT-16, LBT-25 y LBT-47), y se utilizó la cepa HD1 estándar internacional de B. thuringiensis var. kurstaki.
Para la observación de las esporas y cristales de las cepas de B. thuringiensis en el microscopio electrónico, las cepas crecieron en medio Bacto peptona, con agitación en zaranda orbital a 150 rpm a 30°C hasta que el cultivo alcanzó la esporulación. Después de la lisis celular se tomó 1,5 mL del cultivo y se centrifugó a 10 000 rpm durante 10 min. El precipitado se resuspendió en 1 mL de agua destilada. Este proceso se repitió dos veces. El precipitado resultante se resuspendió en 1,5 mL de agua destilada.
Se realizó una suspensión de las muestras sobre soporte metálico, y se metalizaron durante 3 min en un metalizador. Las observaciones de las muestras se realizaron en un microscopio electrónico digital de barrido.
Para la determinación de la composición de proteínas Cry por electroforesis SDS-PAGE se tomó 1,5 mL de un cultivo esporulado de cada una de las cepas en estudio, y se centrifugó a 10 000 rpm durante 5 min. El precipitado se lavó dos veces con 1 mL de NaCl 1 M y tres veces con 1 mL de agua destilada estéril. El precipitado final se resuspendió en 100 μL de agua destilada y en buffer de lisis 2X (Tris-HCl 1 M pH 6,9; 2- mercaptoetanol, SDS 10%, glicerol, bromofenol azul). La muestra se calentó durante 6 min a 100°C.
La electroforesis SDS-PAGE 12% se realizó en una cámara vertical. Se empleó buffer de corrida Tris-Glicina- SDS (0,25 M tris, 1,92 M glicina, SDS 10%) pH 8,3. La tinción de las bandas de proteínas obtenidas se realizó con azul coomassie R-250 al 0,1%.
Para el bioensayo selectivo contra Anticarsia gemmatalis y Spodoptera frugiperda las cepas de B. thuringiensis se pusieron a crecer en caldo nutriente hasta la esporulación. Se adicionaron 150 mL del cultivo en viales que contenían la dieta artificial. Cada vial contenía 10 larvas de segundo instar de Anticarsia gemmatalis y Spodoptera frugiperda.
El ensayo se realizó con tres réplicas y se utilizó como control positivo la cepa HD1 de B. thuringiensis var. kurstaki. Las placas con las larvas se incubaron a 30°C entre el 60 y el 70% de humedad relativa, y la mortalidad se registró a las 48 h. Transcurrido ese tiempo las larvas que no murieron se transfirieron a nuevos viales con dieta artificial sin la suspensión bacteriana. El ensayo se evaluó nuevamente a los cinco días.
Composición de la dieta para A. gemmatalis: frijol 69,4 g/L; extracto de levadura 34,7 g/L; germen de trigo 55,3 g/L; agar 22 g/L; proteína de soya 55,3 g/L; caseína 27,7 g/L; ácido ascórbico 5 g/L; solución de vitaminas 5,53 g/L; agua 1000 mL. Composición de la dieta para S. frugiperda: frijol 146,6 g/L; extracto de levadura 44,9 g/L; germen de trigo 70,4 g/L; agar 17,75 g/L; agua 1000 mL.
RESULTADOS Y DISCUSIÓN
La morfología de los cristales en las nueve cepas de B. thuringiensis estudiadas presentó forma bipiramidal, característicos de la mayoría de las cepas pertenecientes a la especie B. thuringiensis. Se observó también en algunas cepas la presencia de inclusiones cúbicas (Fig. 1). Las flechas indican los cristales bipiramidales y cúbicos.
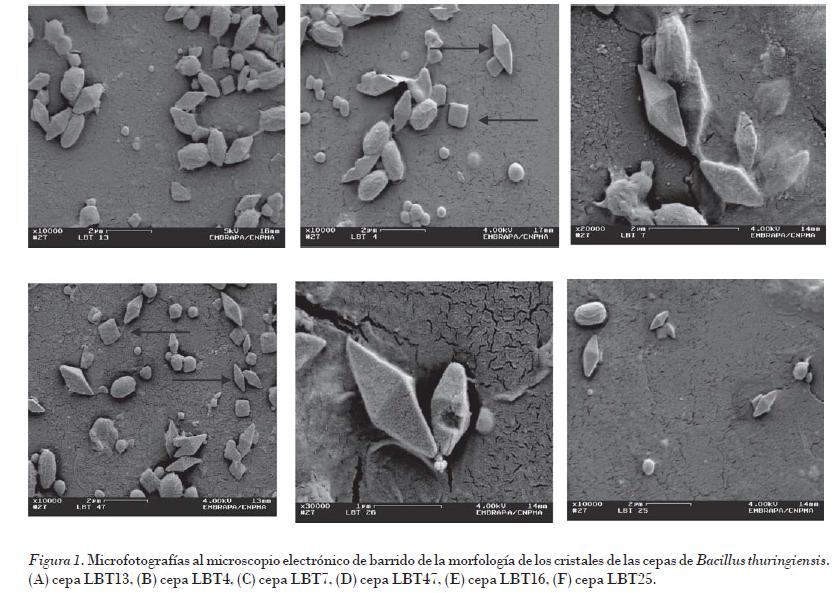
La característica distintiva de B. thuringiensis es la presencia de las inclusiones cristalinas o cuerpos parasporales de naturaleza proteica. La formación de estas estructuras es un proceso asociado al evento de esporulación, en el cual los cristales se liberan al medio por lisis del esporangio. Su formación responde además a la presencia de genes que codifican para su producción, localizados en plásmidos de alto peso molecular [Glare y Callaghan, 2000; Gitahy et al., 2007].
La morfología, tamaño y número de las inclusiones parasporales varían entre las diferentes cepas de B. thuringiensis, y son visibles al microscopio de contraste de fase, y la morfología se onfirma en el microscopio electrónico de transmisión y de barrido. Aunque generalmente predomina la forma bipiramidal, es posible distinguir diferentes morfologías como bipiramidal, esférico-amorfo, rectangular, cuadrado y en forma de barra [Benintende et al., 2000].
Lee (1995) analizó 113 aislados de B. thuringiensis y encontró gran variedad en la morfología de los cristales. Observó cuerpos parasporales bipiramidales, amorfos, esféricos, cúbicos y rectangulares. Igualmente Carreras (2003) advirtió cristales bipiramidales de diferentes tamaños, así como cúbicos y amorfos en un grupo de cepas nativas de B. thuringiensis estudiadas.
Del Rincón-Castro et al. (2006), al analizar tres cepas nativas del estado de Guanajuato, México, también observaron cristales bipiramidales típicos de las cepas de B. thuringiensis. Adicionalmente apreciaron una inclusión cuadrada aplanada más pequeña.
Se plantea que el cristal bipiramidal generalmente se asocia con la toxicidad de la cepa contra insectos lepidópteros y la presencia en ellas de la proteína Cry 1. Los cristales cúbicos y ovoides son activos tanto para lepidópteros como dípteros, y se relaciona a la inclusión cúbica con la proteína Cry 2 [Glare y Callaghan, 2000].
El patrón de proteínas Cry (Fig. 2) presente en las inclusiones parasporales se determinó para cada una de las cepas en estudio. Como se observa en cada una de las cepas, se obtuvieron dos bandas bien definidas, correspondientes a la proteína Cry 1 (130-140 kDa) y a la Cry 2 (70 kDa). La cepa LBT9 solo presentó la banda correspondiente a la proteína de 130 kDa.
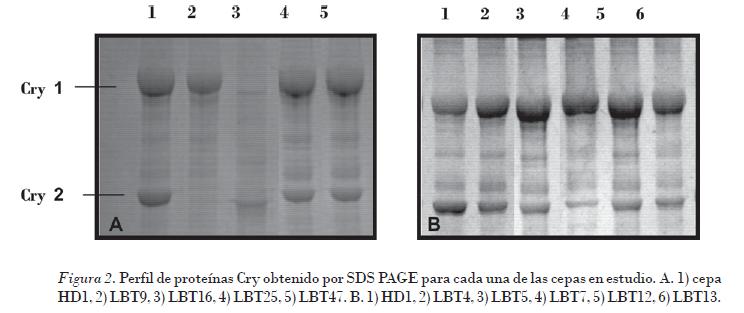
Las δ-endotoxinas contenidas en los cristales parasporales forman una familia de proteínas, clasificadas de acuerdo con la similitud de sus secuencias aminoacídicas y el espectro de toxicidad exhibido frente a diversos organismos plagas.
Gitahy et al. (2007) informaron que la mayoría de los cristales de B. thuringiensis tóxicos a insectos del orden lepidópteros están compuestos de proteínas de aproximadamente 130 kDa, los que corresponden al tamaño de las δ-endotoxinas Cry tipo 1, usualmente asociadas con cristales de morfología bipiramidal. Los polipéptidos de 70 kDa corresponden con las δ-endotoxinas Cry tipo 2 asociados con la morfología cúbica. Los resultados del ensayo biológico se muestran en la Fig. 3.
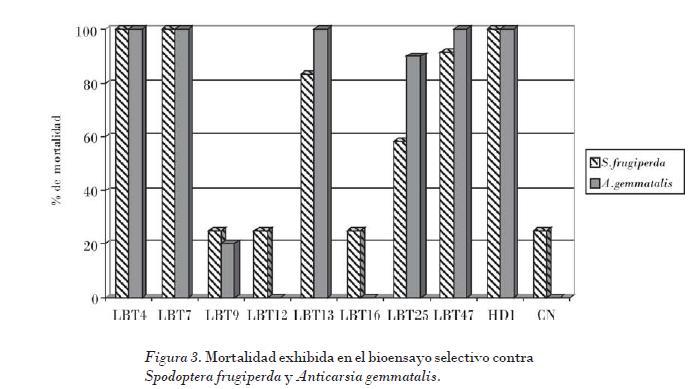
En el caso de S. frugiperda las cepas LBT4 y LBT7 fueron las más virulentas, y provocaron el 100% de mortalidad a las 48 h. Las cepas LBT13 y LBT47 provocaron el 85% de mortalidad y la LBT25 el 58%. Por su parte, la LBT9, LBT12 y LBT16 se comportaron de igual forma que el control negativo (caldo nutriente), al mostrar menos del 25% de mortalidad.
Para A. gemmatalis las cepas LBT4, LBT7, LBT13 y LBT 47 exhibieron el 100% de mortalidad a las 48 h, y la cepa LBT25 mostró el 90% de mortalidad. Las restantes cepas no mostraron ninguna actividad.
La toxicidad exhibida por estas cepas está íntimamente relacionada con la presencia de las proteínas Cry 1 y Cry 2 en cada una ellas; sin embargo, no todas las cepas mostraron actividad tóxica contra estos dos insectos, y las que lo mostraron no se manifestó en la misma extensión. Si se tiene en cuenta el patrón de proteínas obtenido en cada una de las cepas, cabría esperar que todas ellas mostraran actividad biológica contra insectos lepidópteros.
El espectro de las toxinas producidas por B. thuringiensis varía ampliamente. Ello se relaciona con la especificidad de las subespecies de esta bacteria. A pesar de la alta similitud de sus secuencias de aminoácidos encontradas frecuentemente entre algunas de ellas, las toxinas Cry exhiben comúnmente diferentes efectos insecticidas [Glare y Callaghan, 2000].
La variable toxicidad de las proteínas Cry de B. thuringiensis a los diferentes grupos taxonómicos de las larvas de insectos se debe a los diferentes mecanismos que conducen a la activación de los cristales parasporales y a las variadas condiciones del intestino de los insectos [Lee, 1995].
El mecanismo de acción de las proteínas Cry de B. thuringiensis involucra la solubilización del cristal en el intestino medio del insecto. Para la mayoría de los lepidópteros las protoxinas son solubilizadas bajo condiciones alcalinas y enzimas específicas, las cuales pueden variar según el organismo susceptible. Las diferencias en el grado de solubilización explica la variabilidad en la toxicidad entre las proteínas Cry [Crikmore et al., 2000].
La especificidad de las subespecies de B. thuringiensis es dependiente de las toxinas producidas; además, cada ä-endotoxina y su combinación dentro de un aislado pueden también interactuar para incrementar, sinergizar o disminuir la toxicidad a un insecto particular [Glare y Callaghan, 2000].
Como ya se mencionó, la presencia de ciertas toxinas puede potenciar la actividad de otras, o provocar uniones no productivas. Queda claro que la interacción es específica para el insecto, lo que puede reflejar diferencias en las afinidades del receptor para cada toxina. Debido a esto la unión de las endotoxinas a sus receptores es fundamental para la toxicidad [Del Rincón- Castro et al., 2006].
CONCLUSIONES
• Las nueve cepas de B. thuringiensis estudiadas presentaron cristales de morfología bipiramidal. En las cepas LBT4, LBT7, LBT13, LBT25 y LBT47 se observó además la presencia de inclusiones cúbicas.
• El análisis del perfil de proteínas Cry por SDS-PAGE reveló en ocho de las cepas analizadas la presencia de las proteínas Cry 1 (130 kDa) y Cry 2 (70kDa). En la cepa LBT9 solo se obtuvo la banda correspondiente a la proteína Cry 1.
• Las cepas LBT4, LBT7, LBT13, LBT25 y LBT47 provocaron más del 90% de mortalidad en ensayo selectivo contra A. gemmatalis. Las cepas LBT4 y LBT7 fueron las más virulentas contra S. frugiperda, que causaron el 100% de mortalidad a las 48 h. La toxicidad de estas cepas se atribuyó a las proteínas Cry 1 y Cry 2.
REFERENCIAS
Ayra, P. C.; C. L. Rodríguez; P. Y. Fernández; R. P. Téllez: «Increased Activity of a Hybrid Bacillus thuringiensis Toxin Against Spodoptera frugiperda Larvae from a Maize Field in Cuba», Biotecnología Aplicada 23:236-239, La Habana, 2006.
Benintende, G.; J. López-Meza; J. Cozzi; C. Piccinetti; J. Ibarra: «Characterization of INTA 51-3, a New Atypical Strain of Bacillus thuringiensis from Argentina», Curr. Microbiol. 41:396-401, EE.UU., 2000. Bobrowski, V. L.; G. Pasquali; M. Bodanese-Zanettini; L. Fiuza: «Detection of cry1 Genes in Bacillus thuringiensis Isolates from South of Brazil and Activity Against Anticarsia gemmatalis (Lepidoptera: Noctuidae)», Brazilian J. Microbiol. 32:105-109, Brasil, 2001. Carreras, B.: «Caracterización de cepas de Bacillus thuringiensis para el control fitosanitario», Tesis en opción al título de Maestro en Microbiología General, Universidad de La Habana, 2003. Crickmore, N.: «Bacillus thuringiensis toxin nomenclatura», http:// www.biols.susx.ac.uk/Home/Neil_Crickmore/Bt/index.html, 2000 (consulta 12 de enero del 2009). Crickmore, N.; D. R. Zeigler; E. Schnepf; J. Van Rie; D. Lereclus; J. Baum; A. Bravo; D. Dean: «Bacillus thuringiensis toxin nomenclature», http://www.lifesci.sussex.ac.uk/home/Neil_ Crickmore/Bt/, 2005 (consulta 12 de enero del 2009).
Del Rincón-Castro, M. C.; J. Méndez-Lozano; J. E. Ibarra: «Caracterización de cepas nativas de Bacillus thuringiensis con actividad insecticidahacia el gusano cogollero del maíz (Spodoptera frugiperda (Lepidoptera: Noctuidae)), Folia Entomol. Mexic. 45 (2):157-164, México, 2006.
Gitahy, P.; M. Teixeira de Souza; R. Monnerat; E. Arrigoni; J. Baldani: «A Brazilian Bacillus thuringiensis Strain Highly Active to Sugarcane Borer Diatraea saccharalis (Lepidoptera: Crambidae)», Brazilian J. Microbiol. 38:531-537, 2007.
Glare, T.; M. O'Callaghan: Bacillus thuringiensis: Biology, Ecology and Safety, John Wiley and Sons, Chichester, Inglaterra, 2000.
Hernández, M.; F. Cuevas; M. González; L. Guzmán: «Comportamiento de dos variedades de soya CS 23 e IS 27 (Glycine max (L.) Merill) en diferentes épocas», Avances 6(3), 2004, http://www.avances.pinar.cu/No.2004-3/soya.htm (consulta 13 de julio del 2009).
Iñigo, R.; A. Estela; M. Porcar; C. Martínez; J. Oguiza; J. Ferré; P. Caballero: «Molecular and Insecticidal Characterization of a Cry 1 Protein Toxic to Insects of the Family Noctuidae, Tortricidae, Putellidae and Chrysomelidae», Appl. Environm. Microbiol. 72 (6):4796-4804, EE.UU., 2006.
Lee, H.: Distribution of Bacillus thuringiensis in Korea, Bacillus thuringiensis Biotecnology and Enviromental Benefits vol. I, Hua Shiang Yuan Publishing, Taiwán, 1995, pp. 201-215.














