Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Fitosanidad
versión On-line ISSN 1818-1686
Fitosanidad v.13 n.4 Ciudad de la Habana oct.-dic. 2009
Ecología
Reacción de clones naturales e híbridos de la FHIA de bananos y plátanos a las poblaciones de Cuba de Fusarium oxysporum f . sp. cubense, agente causal de la marchitez por Fusarium o mal de Panamá
Reaction of natural and hybrids cultivars of FHIA Bananas and Plantains to Cuban Fusarium oxysporum f . sp. cubense Populations, causal agent of Fusarium Wilt or Panama Disease
Luis Pérez Vicente,¹ Alicia Batlle Viera,¹ Julio Chacón Benazet² y Virgen Montenegro Moracén³
¹Instituto de Investigaciones de Sanidad Vegetal. Calle 110 no. 514 e/ 5.a B y 5.a F, Playa, Ciudad de La Habana, CP 11600, lperezvicente@sanidadvegetal.cu; lperezvicente@live.com
²UBPC. Caney del Sitio. Palma Soriano, Santiago de Cuba
³Laboratorio Provincial de Sanidad Vegetal. Carretara a Siboney Km 6, Ternerito Lindo, Santiago de Cuba
RESUMEN
La marchitez por Fusarium oxysporum f. sp. cubense (Foc) es una de las más importantes enfermedades de los bananos. Se estudió la reacción de los clones híbridos de la FHIA, clones diploides y silvestres, a las inoculaciones artificiales con Foc (GCV 01210, raza 1; 0124 y 0128, raza 2). El inóculo de Foc se reprodujo sobre semillasde Sorghum vulgare en bandejas en el laboratorio. Se inocularon cinco plantas por clon, para lo cual se colocaron 15 g de la semilla inoculada de Sorghum con cada GCV en el fondo del hoyo de plantación. Los clones Manzano y Gros Michel fueron altamente susceptibles a la raza 1 (GCV 01210) y resistentes a los aislados pertenecientes a la raza 2 (GCV 0124 y 0128). Los clones Burro CEMSA, Pisang Awak y FHIA 03 fueron severamente afectados por aislados pertenecientes a la raza 2. El Yangambi Km 5 y FHIA 18 fueron severa y ligeramente afectados por el GCV 01210, respectivamente. El FHIA 21 fue ligeramente afectado por la raza 2 (GCV 0124). Los clones FHIA 02 y FHIA 14 no mostraron síntomas con ninguno de los aislados inoculados. Se observó una reacción diferencial en los clones Pelipita, Pisang Jari Buaya y Paka contra los GCV 0124 y 0128 obtenidos del clon Burro Criollo (Bluggoe, raza 2), lo que evidencia que ambosaislamientos de la raza 2 difieren en patogenicidad a otros clones. La actual clasificación de razas de Foc no tiene sentido genético y requiere ser revisada en el futuro.
Palabras claves: mal de Panamá, marchitez por Fusarium oxysporum f. sp. cubense, reacción de clones, GCV
ABSTRACT
Fusarium wilt by Fusarium oxysporum f.sp.cubense (Foc ) is one of the most important diseases of banana. The reaction of FHIA hybrids cultivars (cv.), diploids and landraces to artificial inoculations with Foc (VCGs 01210, race 1; 0124 and 0128, race 2) was studied. Foc inoculum was reproduced on Sorghum vulgare in trays in the lab. Fifteen grams of inoculated Sorghum seeds of each VCG were placed on the soil under each of five inoculated tissue culture plants. Manzano and Gros Michel cvs. were only susceptible to race 1 (VCG 01210).Burro CEMSA, Pisang awak and FHIA 03 were severely affected by isolates of race 2 (VCGs 0124 and 0128) and slightly by race 1. The cultivars FHIA 02 and FHIA 04 does not showed symptoms with any of the isolates tested. FHIA 18 was slightly affected by the races 1 and 2. It has been reported naturally affected in conducible soils to Foc . Adifferential reaction of the cultivars Pelipita, Pisang Jari Buaya and Paka against the GCVs 0124 y 0128 obtained from Burro Criollo (race 2) were observed, supporting the criteria that both isolates differs in pathogenicity to other cultivars and belong to different races. The results indicate that the current system of classification of races, has not genetic sense and requires further international collaborative research to achieve a better understanding of Foc pathogenicity. Themethod of inoculum multiplication and inoculation proved to be efficient for testing cvs. reaction to the disease.
Key words: Panama disease, Fusarium wilts of banana, Fusarium oxysporum f. sp. cubense, resistance, cultivars reaction, VCG
INTRODUCCIÓN
La marchitez por Fusarium o mal de Panamá causado por Fusarium oxysporum f. sp. cubense (Foc) es una de las enfermedades más ampliamente distribuidas e históricamente importantes de los bananos y plátanos a nivel mundial. El patógeno tuvo su origen en el sudeste asiático, aunque la enfermedad haya sido reconocida por primera vez en otros lugares, y ha coevolucionado junto a las musáceas en su centro de origen [Bentley et al., 1998]. Se calcula en más de 80 000 ha de cultivo del clon Gros Michel destruidas por la raza 1 entre 1890 y mediados de la década de los cincuenta del pasado siglo [Stover, 1962] solo en las grandes empresas exportadoras [Ploetz, 2005], lo que determinó su cambio por clones del subgrupo Cavendish (AAA). Los clones Cavendish se afectaban únicamente en los subtrópicos; pero la aparición de la raza 4 tropical (GCV 01213-01216) más recientemente ha causado importantes pérdidas en plantaciones de Malasia e Indonesia [Masdek et al., 2003; Nasdir, 2003].
El primer informe en Cuba oficial sobre la marchitez por Fusarium fue el de Smith (1910); sin embargo, Johnston (1915) informó que el clon Gros Michel (AAA) y el Manzano (subgrupo Silk, AAB) se encontraban severamente afectados antes de 1910, y comentaron la existencia de antecedentes de incidencia de la enfermedad en el clon Manzano (subgrupo Silk, AAB) desde finales del siglo XIX. Según Acuña y Díaz (1953), la zona de Baracoa, situada en el extremo oriental de Cuba, exportó en 1897 tres millones de racimos de Gros Michel. La única medida practicada para su manejo consistía en la destrucción de las plantas afectadas y la quema de sus residuos, hasta que comenzó su sustitución paulatina por el clon Robusta (subgrupo Cavendish, AAA), al que localmente se nombró Inmune por su resistencia al mal de Panamá. La misma situación existió en el resto de las regiones del país [Johnston, 1915]. A partir de la sustitución del Gros Michel por clones del subgrupo Cavendish y el cultivo masivo de clones de plátanos AAB, la marchitez por Foc perdió su importancia económica en Cuba, y quedó confinada a las pequeñas parcelas de agricultores y jardines de viviendas, donde Foc se mantenía sobre plantas de los clones Burro Criollo (Bluggoe, ABB) y Manzano.
La aparición de la Sigatoka negra en Cuba a finales de 1990 [Vidal, 1992] tuvo un fuerte impacto en los costos de producción, pero especialmente en la estructura clonal de la superficie del país plantada de musáceas [Pérez et al., 2002]. Los bananos Cavendish (AAA) fueron sustituidos por los clones FHIA 23 (AAAA) y FHIA 18 (AAAB), que junto al FHIA 3 (AABB) ocupan alrededor de 11 000 ha. Asimismo, en la actualidad solo se mantiene el 18% de las más de 43 000 ha de plátanos (AAB) existentes en 1990. Los plátanos fueron sustituidos por el cultivo a gran escala del clon Burro CEMSA (ABB), que ocupa unas 63 000 ha, y por el FHIA 3 (AABB). Junto a esto, se ha popularizado el cultivo del clon conocido popularmente como Burro Vietnamita (Pisang Awak, ABB).
En diferentes localidades del país se han hallado plantas de los clones Burro CEMSA, FHIA 3 y FHIA 18, afectadas de mal de Panamá, lo cual sugirió la necesidad de realizar algunos ensayos de sensibilidad de todos los clones FHIA que se han introducido, debido a la osibilidad de que la enfermedad se estuviera propagando de nuevo en clones moderadamente susceptibles de forma imperceptible. La aparición en los últimos años de plantas afectadas por la enfermedad sugiere que pudiera existir una acumulación poliética de inóculo en los clones con algún nivel de susceptibilidad, y que la causa de que no se haya visto más rápidamente en clones FHIA en otros suelos sea debido probablemente al programa de multiplicación por vitroplantas sanas.
Las poblaciones de Foc se han clasificado en función de grupos de compatibilidad vegetativa (GCV) [Leslie, 1990; 1993; Ploetz, 1990; Pegg et al., 1996; Ploetz y Pegg, 1999] y la patogenicidad. Se han reconocido cuatro razas del patógeno [Stover, 1962]. Las poblaciones de Cuba pertenecen a los GCV 01210 presentes en Manzano y Gros Michel, pertenecientes a la raza 1, y a los 0124, 0124-0125 y 0128 presentes en Burro Criollo, FHIA 3 y Pisang Awak, y pertenecientes a la raza 2 [Batlle y Pérez, 1999; 2001].
El objetivo del presente estudio fue determinar la reacción de los clones híbridos de la FHIA y de diploides y triploides silvestres naturales en el germoplasma de Cuba frente a las principales GCV y razas de Foc presentes en la isla.
MATERIALES Y MÉTODOS
Para determinar la reacción de los clones de banano naturales e híbridos se seleccionaron para las inoculaciones aislamientos pertenecientes a los GCV 0124 (aislado ESB-1 perteneciente a la raza 2 obtenido del clon Burro Criollo en Esmeralda, Camagüey), 0128 (aislado SC- 3 perteneciente a la raza 2 obtenido del clon Burro Criollo en Palma Soriano, Santiago de Cuba) y 01210 (aislado TuPP de la raza 1 obtenido del clon Manzano en Puerto Padre, Las Tunas).
Para la multiplicación en condiciones controladas de Foc se procedió a utilizar semilla de sorgo ( Sorghum vulgare Pers.), las que se esterilizaron dos veces en dos días consecutivos, se colocaron en bandejas en una capa delgada y se cubrieron con papel de aluminio o con papel de traza estéril. La semilla se inoculó con una suspensión de conidios de Foc de cada GCV y raza en agua estéril (5 x 105 esporas/mL), obtenidos de un cultivo monospórico en PDA incubado por 14 días independientemente. Se utilizó suficiente suspensión para garantizar un completo mojado de la superficie de la semilla de sorgo en las bandejas, y estas se incubaron por un período de 10 a 14 días hasta que la semilla de sorgo estuviera completamente cubierta de micelio y esporasde Foc.
Se utilizaron 15 g de semilla de sorgo con Foc por hueco antes de plantar, y se tomaron cinco plantas de cada uno de los clones Manzano, Gros Michel, Burro Criollo, Pelipita, Pisang Awak, Yangambi Km 5, Pisang Mas, Calcutta 4, Niyarma Yik, Pisang Lilin, Pisang Jari Buaya (PJB), Paka, Musa acuminata 1, Musa acuminata, FHIA 2, FHIA 3, FHIA 4, FHIA 18 y FHIA 21. Los clones fueron obtenidos del jardín clonal del Instituto de Investigaciones en Viandas Tropicales (Inivit) y multiplicados por cultivo de tejidos en el Instituto de Biotecnología de las Plantas (IBP), de la Universidad Central de Las Villas. Las vitroplantas se aviveraron hasta alcanzar una altura aproximada de 25 cm y se llevaron al campo e inoculadas, para lo cual se colocó el inóculo debajo de la planta, en el suelo previamente humedecido (Fig. 1a y b). El ensayo se condujo con un diseño totalmente aleatorizado.
La evaluación de la reacción de los clones se realizó por la determinación de la frecuencia de plantas muertas, la severidad de los síntomas externos de la enfermedad según la siguiente escala de severidad: 1) sana; 2) clorosis ligera y marchitez sin afectación del peciolo; 3) clorosis moderada, peciolos doblados y marchitez con rajadura de la base de las vainas; 4) clorosis severa, peciolos doblados, enanismo de la nueva hoja que sale y de las plantas, rajadura de los pseudotallos; 5) planta muerta; y a la cosecha de las plantas se evaluaron los síntomas internos, para lo cual se utilizó la escala propuesta en las Guías Técnicas del Inibap para la evaluación al marchitamiento por Fusarium [Carlier et al., 2002]: 1) cormo completamente limpio; 2) puntos aislados de tejido vascular con coloraciones; 3) hasta 1/3 de la superficie con coloraciones; 4) coloración entre 1/3 y 2/3 de la superficie con coloraciones; 5) más de 2/3 de la superficie con coloraciones; 6) coloración completa del tejido vascular.
RESULTADOS Y DISCUSIÓN
Los clones Niyarma Yik, Musa acuminata 1 y Pisang mas presentaban plantas muy débiles al momento de la inoculación artificial, y se presentaron altas mortalidades de plantas pocos días después de la inoculación, por lo que se descartaron del estudio.
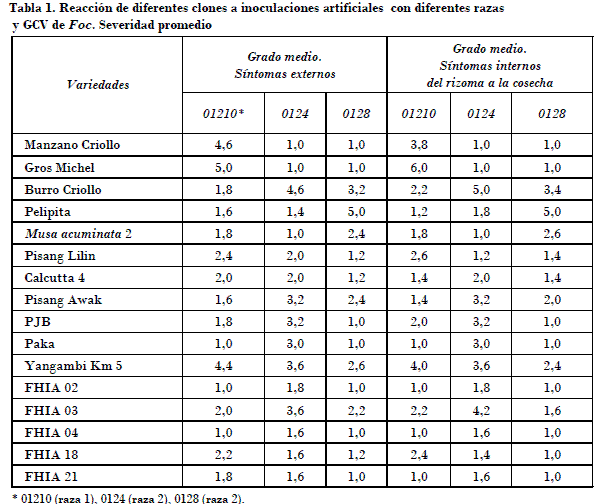
En la Fig. 2 y en la Tabla 1 aparecen los resultados de la evaluación de la frecuencia de plantas muertas producto de las infecciones artificiales con diferentes GCV de Foc, y de la severidad de los síntomas externos e internos que mostraron los clones. La reacción de los clones Manzano, Gros Michel y Burro Criollo (Bluggoe, ABB) se ajustó a la expresión esperada de acuerdo con la clasificación de razas informada por Stover (1962).
El clon Pisang Awak (ABB) mostró síntomas externos e internos, y muerte de plantas con los aislados de los GCV 0124 y 0128 (raza 2). Se apreciaron rajaduras de los tallos, acortamiento de las hojas nuevas que salen próximo a la floración y necrosis de los rizomas. Frente al GCV 01210 (raza 1) presentó síntomas ligeros de clorosis en algunas plantas y coloraciones pardas aisladas (grado 2) en algunos rizomas a la cosecha. Estos datos concuerdan con los informes de Wardlaw (1972), quien informó de su susceptibilidad en Trinidad después de algunos años de cultivo en suelos infectados. Ploetz et al. (1999) informaron en cambio que el Pisang Awak mostró índices intermedios a severos de marchitez al inocularlo con poblaciones pertenecientes al grupo 01210 provenientes del clon Manzano en la Florida.
El clon Pelipita mostró síntomas externos e internos frente a los GCV 0124 y 0128 (pertenecientes a la raza 2), y muerte de plantas solo frente al 0128. Contrariamente, en ensayos en la Florida Ploetz et al. (1999) informaron plantas muertas frente al GCV 01210 (raza 1).
El cultivar Pisang Lilin mostró niveles ligeros de infección frente a los GCV 0124 y 0128, y la afectación más alta se expresó frente al GCV 01210, con grados intermedios de severidad. Se ha informado como resistente a diferentes GCV y razas en distintas localidades del mundo en los ensayos internacionales de musáceas [Inibap, 2000; Ploetz y Pegg, 1999]. Por su parte, Stover (1962) lo refiere como resistente a la enfermedad, no obstante una alta frecuencia de su progenie en cruces con Gros Michel resultar susceptible.
La accesión Musa acuminata 2 del jardín clonal del Inivit mostró síntomas ligeros de clorosis de los bordes de las hojas especialmente con el GCV 0128. Llegaron al final del ensayo sin otros síntomas importantes en la planta madre y el primer hijo.
Musa acuminata burmannicoides Calcutta 4 mostró alta incidencia y severidad frente a la raza 1 (GCV 01210), lo que concuerda con los informes de Stover (1962).
El clon Pisang Jari Buaya reflejó niveles intermedios a severos de ataque frente a los GCV 0124 y 0128 pertenecientes a la raza 2 GCV 0124, y ligeros frente a la raza 1. El Yangambi Km 5 presentó susceptibilidad a todos los aislados estudiados, en contraste con los resultados de estudios conducidos en Queensland, donde fue resistente a la raza 1 [Ploetz y Pegg, 1999]. No se dispone de referencias del comportamiento de este clon en otros lugares.
Los clones FHIA 04 y FHIA 02 no mostraron síntomas, o solamente muy ligeros de clorosis respectivamente frente al GCV 0124. El FHIA 02 ha resultado susceptible a la raza 1 en estudios conducidos en otras regiones [Ploetz y Pegg, 1999]. En una visita a la FHIA se observó con el doctor Phil Rowe plantas afectadas en ensayos conducidos en La Lima, en Honduras, durante una visita en 1996; sin embargo, en condiciones de producción en Cuba no ha mostrado síntomas de la enfermedad en ninguna de las localidades del país.
El clon FHIA 03 mostró infecciones frente a todos los GCV, pero mayor susceptibilidad a los aislados ertenecientes al GCV 0124 (raza 2). Este resultado confirma la susceptibilidad del clon al patógeno observadas en diferentes regiones del país.
El clon FHIA 18 presentó síntomas de bordes de las hojas cloróticos y plantas muertas con los aislados pertenecientes al GCV 01210 (raza 1). Una planta de este clon se encontró afectada previamente en una finca de la localidad del Caney del Sitio, y no en el resto de las áreas del país, a diferencia de lo que se observó con el FHIA 3 en diferentes suelos.
Los resultados han mostrado la inconsistencia del actual sistema de diferenciación de razas de Foc existente hasta el momento. Los aislados de los GCV 0124 y 0128 se obtuvieron del clon Burro Criollo (ABB Bluggoe), y en los experimentos fueron patogénicos al Bluggoe, pero no al Gros Michel, y por tanto debe considerarse comoraza 2. La diferencia de reacción del clon Pelipita, PJB y Paka contra los GCV 0124 y 0128 apoyan el criterio de que ambos aislados, supuestamente de la misma raza, difieren en patogenicidad a algunos clones. Estos resultados y las diferencias de reacción observadas de algunos clones en diferentes países, aparentemente contra la misma raza, son una expresión de las limitaciones del actual sistema de clasificación de razas y de la necesidad de lograr un mejor conocimiento de la especialización patogénica como ya se ha mencionado por Stover y Buddenhaguen (1986). Esto requiere la coordinación de esfuerzos a nivel internacional para poder obtener una comprensión más cabal de la especialización fitopatogénica de Foc y su repercusión práctica. Hasta tanto, la mejor herramienta para clasificar las poblaciones de Foc son los GCV.
Por otro lado, se requiere lograr una mejor comprensión de los mecanismos de defensa que operan frente a la infección por Foc, y cómo las condiciones edáficas y de cultivo los afectan. Clones como el Manzano, Gros Michel, Pisang Awak, etc., son afectados en Cuba tanto en suelos ferralíticos como pardos calcáreos arcillosos, lo que pone de manifiesto su susceptibilidad. Otros clones muestran síntomas solo en condiciones de suelos pesados con una tabla de agua alta, como ocurre en las plantaciones cercanas a las riberas de los ríos Contramaestre, Sagua y Mayarí. En estas zonas los clones Cavendish y los plátanos AAB no se afectan, pero los de Burro CEMSA, FHIA 03 muestran síntomas de la enfermedad. Para estas zonas, donde los suelos son muy conducibles a la enfermedad, se requiere adoptar medidas de manejo integrado tanto culturales -que haga desfavorable el ambiente al desarrollo del patógeno y disminuyan la población en el suelo y su diseminación-como de uso de antagonistas.
El método de reproducción del patógeno sobre granos de S. vulgare permitió una inoculación eficiente para los ensayos de campo. La reproducción es relativamente simple y barata, y no requiere de condiciones sofisticadas. La adopción de este sistema de inoculación en las evaluaciones de la reacción de los clones permitiría hacer comparables los ensayos de diferentes localidades, y reducir las diferencias de reacción de los clones impuestos por las condiciones ambientales, de disponibilidad de inóculo en el suelo y la patogenicidad de los aislamientos.
CONCLUSIONES
• Los clones FHIA 02 y FHIA 04 no mostraron síntomas en el ensayo con ninguno de los aislados probados.
• El clon FHIA 03 mostró una susceptibilidad ligera a la raza 1 (GCV 01210) y de moderada a intensa a la raza 2 (CVG 0124 y 0128).
• El FHIA 18 es ligeramente afectado por la raza 1 (GCV 01210) y raza 2 (0128) en condiciones de suelos favorables al desarrollo de la enfermedad.
• La actual clasificación de razas de Foc es incompleta. Solo permite agrupar los aislados como patogénicos o no a Gros Michel y Manzano, Burro Criollo o los Cavendish; requiere de investigaciones posteriores y colaboración internacional para lograr una mejor comprensión de la patogenicidad de Foc. Hasta tanto, el mejor sistema para tipificar las poblaciones del patógeno son los GCV.
• El sistema de reproducción e inoculación con la utilización de granos de sorgo con Foc mostró ser eficiente como método para la prueba de la reacción de los clones de Musa. La distribución en el suelo del patógeno es más uniforme, evita disminuir escapes a la enfermedad y permite controlar la raza y el GCV con que se trabaja
Agracedimiento
El presente trabajo de investigación fue parcialmente financiado por Inibap (Bioversity International)
REFERENCIAS
Acuña, J.; R. Díaz: Estudios económico-sociales. Municipio de Baracoa, Banco de Fomento Agrícola e Industrial de Cuba, 1953.
Batlle, A.; L. Pérez: «Grupos de compatibilidad vegetativa de las poblaciones de Fusarium oxysporum Schlecht f. sp. cubense (E. F. Smith) Snyd. and Hans. presentes en Cuba», Infomusa 8(1):22-23, Francia, 1999.
Batlle, A.; L. Pérez: «Population Biology of Fusarium oxysporum f. sp . cubense of Banana and Plantains in Cuba: Vegetative Compatibility Groups», Abstracts of Papers. Annual Meeting APS Caribbean Division, June 11-15, 2001-Havana, Posted online August 8, 2001.
Bentley, S.; K. G. Pegg; N. Y. Moore; D. R. Davis; I. W. Buddenhagen: «Genetic Variation Among Vegetative Compatibility Groups of Fusarium oxysporum f. sp. cubense Analyzed by DNA Fingerprinting », Phytopathology 88:1283-1293, EE. UU, 1998.
Carlier, J.; D. De Waele; J. Escalant: «Evaluación global de la resistencia de los bananos al marchitamiento por Fusarium, enfermedades de las manchas foliares causadas por Mycosphaerella y nematodos», Guías Técnicas Inibap 6, Ed. Ipgri, Francia, 2002.
Inibap: «Results of IMTP Phase II», International Musa Testing Program, Inibap, Ipgri 2000. (formato digital), Francia, 2000.
Johnston, J. R.: «La enfermedad del plátano en Cuba», Estación Experimental Agronómica de Santiago de las Vegas, Circ. 47, 13, La Habana, 1915.
Leslie, J. F.: «Genetic Exchange Within Sexual and Asexual Populations in the Genus Fusarium», Fusarium wilt of banana, APS Press St. Paul, MN, EE. UU., 1990, pp. 37-48.
____: «Vegetative Compatibility in Fungi», Ann. Rev.of Phytopath. 31:127- 151, EE. UU., 1993.
Masdek, N.; M. Mahmood; A. Molina; S. C. Hwang; A. Dimyati; R. Tangaveli; I. Omar: «Global Significance of Fusarium Wilt: Asia», Abstracts of Papers 2nd. International Symposium on Fusarium wilt on Banana, Promusa-Inibap/Embrapa, Salvador de Bahía, 22-26 sept., Brasil, 2003.
Nasdir, N.: «Fusarium Wilt Race 4 in Indonesia», Abstracts of Papers 2nd. International Symposium on Fusarium wilt on Banana, Promusa-Inibap/Embrapa, Salvador de Bahía, 22-26 sept., Brasil, 2003.
Pegg, K. G.; N. Y. Moore; S. Bentley: «Fusarium Wilt of Banana in Australia», Australian Journal of Agriculture Research 47:633-650, Australia, 1996.
Pérez, L.; J. M. Álvarez; M. Pérez: «Economic Impact and Management of Black Leaf Streak Disease in Cuba», Mycosphaerella Leaf Spot Diseases of Bananas: Present Status and Outlook, Proceedings of the International Workshop on Mycosphaerella Leaf Spot Diseases, San José, Costa Rica, 2002, pp. 71-83.
Ploetz, R. C.: Population Biology of Fusarium oxysporum f. sp. cubense. Fusarium Wilt of Banana, APS Press St. Paul, MN, EE. UU, 1990, pp. 63-76.
Ploetz, R. C.; K. G. Pegg: Fusarium wilt. Diseases of Banana, Abaca and Enset, CABI Publishing, Wallingford, Reino Unido, 1999, pp. 143-159. Ploetz, R. C.; H. L. Haynes; A. Vázquez: «Responses of New Banana Accessions in South Florida to Panama Disease», Crop Protection 18:445-449, EE. UU., 1999. Ploetz, R. C.: «Panama Disease: An Old Nemesis Rears its Ugly head». Part 1: The Beginnings of the Banana Export Trades Featured History on APSnet, EE. UU., August, 2005. Smith, E. F.: «A Cuban Disease», Science 31:754-755, EE. UU., 1910. Stover, R. H.: «Fusarial Wilt (Panama Disease) on Banana and Other Musa species», Phytopathological Paper 4. CMI, CAB, Inglaterra, 1962, pp. 117. Stover, R. H.; I. W. Buddenhaguen: «Banana Breeding, Polyploidy, Disease Resistance and Productivity», Fruits 41:175-191, Francia, 1986. Vidal, A.: «Sigatoka negra en Cuba. En nuevos focos de plagas y enfermedades», Boletín Fitosanitario de la FAO 40:(1-2), Italia, 1992. Wardlaw, C. W.: Banana Diseases Including Plantain and Abaca», Longman, Nueva York-Londres, 1972.