Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Fitosanidad
versión On-line ISSN 1818-1686
Fitosanidad v.14 n.4 Ciudad de la Habana oct.-dic. 2010
Control biológico
Estudio fitoquímico preliminar y actividad fungicida de corteza de Maytenus urquiolae Mory (Celastraceae)
Preliminary Phytochemical Study and Fungicide Activity of Maytenus urquiolae Mory (Celastraceae) Tree Bark
Alexander Fernández de la Torre, 1 Clara Nogueiras Lima, 2 Carlos Romeu Carballo, 3 Jorge Roberto Palacios 3 Enoc Naranjo Chamizo, 4 Rolando Marbot Ramada3 y Armando Urquiola Cruz5
1Empresa Comercializadora de Pinar del Río. Carretera al central José Martí Km 1, San Cristóbal, Pinar del Río, Cuba, alexander@azugrup.pr.minaz.cu
2Centro de Estudios de Productos Naturales, Facultad de Química, Universidad de La Habana. Calle Zapata s/n, e/ Mazón y G, Vedado, Plaza de la Revolución, Ciudad de La Habana, C. P. 10400, clara@fq.uh.cu
3Instituto de Investigaciones de Sanidad Vegetal. Calle 110 no. 514 e/ 5. a B y 5. a F, Playa, Ciudad de La Habana, C. P. 11600, cromeu@inisav.cu
4IPQI Mártires de Girón. Calle 17 esq. a 5. a ave., Playa, Ciudad de La Habana
5Jardín Botánico de Pinar del Río. Carretera Hoyo de Guamá Km 1½, Pinar del Río, Cuba
RESUMEN
Se realizó el tamizaje fitoquímico de la corteza del tallo de Maytenus urquiolae Mory, el cual mostró triterpenos y compuestos fenólicos como las familias de metabolitos más abundantes en el material vegetal. Se aisló y caracterizó el polímero 1,4 trans poliisopreno, marcador quimiotaxonómico de la familia Celestraceae, y finalmente se realizó un estudio de la composición química de la fracción de más baja polaridad, la cual se caracterizó por cromatografía gaseosa acoplada a espectrometría de masa, en la que se identificaron 11 compuestos, seis pertenecientes a la familia de los sesquiterpenos. El extracto en n-hexano:éter etílico (1:1) de la corteza del tallo mostró efecto fungicida in vitro contra el patógeno Curvularia clavata B. L. Jain.
Palabras claves: Celastraceae, Maytenus urquiolae, tamizaje fitoquímico.
ABSTRACT
A phytochemical screening of Maytenus urquiolae Mory steam barks was done. This study showed that triterpenes and fenolic compounds were the main metabolites families present in plant material. Polymer 1,4 trans polyisoprene was isolated and characterized as chemiotaxonomic significance of Celestraceae family. Finally a chemical composition study of the lower polarity fraction was carried out by CG-MS, where 11 compounds were identified and six of them belong to sesquiterpene family. The steam barks n-hexane: ethyl ether (1:1) extract showed in vitro fungicide activity against the pathogen Curvularia clavata B. L. Jain.
Keywords: Celastraceae, Maytenus urquiolae, phytochemistry screening.
INTRODUCCIÓN
La familia Celastraceae es conocida comúnmente como familia agridulce (bittersweet) debido al sabor de sus frutos. Incluye 98 géneros con aproximadamente 1264 especies [Dias et al., 2005].
Dentro de la familia Celastraceae, el género Maytenus tiene una larga historia de empleo en la medicina popular de varios pueblos [González et al., 1996]. Se conoce que presentan una serie de familias de metabolitos secundarios con amplia variedad de actividades biológicas [Santos-Oliveira et al., 2009]. Ejemplo de esto son los alcaloides sesquiterpénicos piridínicos con actividad antialimentaria e inmunosupresora [Alvarenga et al., 2001], triterpenoquinonas y dímeros triterpénicos con actividad antimicrobiana [González et al., 1996] y nortriterpen metilénquinonas con actividad antimicrobiana e insecticida [Ávilla et al., 2000; Spivey et al., 2002]. Se conoce además que estas plantas contienen metabolitos considerados marcadores taxonómicos como la gutapercha, agarofuranos, sesquiterpénicos piridínicos, entre otros [Menezes de Olivera et al., 2006].
El objetivo de este trabajo fue realizar un estudio fitoquímico preliminar de la corteza del tallo de la especie Maytenus urquiolae, así como evaluar de manera preliminar su actividad fungicida.
MATERIALES Y MÉTODOS
La especie Maytenus urquiolae Mory, árbol endémico de Cuba, fue descrita por vez primera en 1993 [Mory, 1993]. Se recolectó en el municipio de Mantua, provincia de Pinar del Río, en noviembre del 2007.
La corteza de tallo se secó a la sombra por espacio de 48 h y luego se completó el proceso en estufa a 35°C durante 2 h. Posteriormente se procedió a su trituración por medio de un molino de cuchillas, con un tamiz de 5 mm. Se maceraron 690 g del material vegetal en 2 L de una mezcla de n-hexano:éter etílico 1:1 durante 24 h; seguidamente se calentó a reflujo en la misma mezcla por espacio de 4 h. Se filtró por gravedad, y al dejar enfriar el filtrado precipitó 5,9 g de un sólido amorfo de color blanco (A1 ), el cual se lavó con pequeños volúmenes de metanol y gotas de acetona. El líquido sobrenadante se concentró a presión reducida y se obtuvieron 11 g de un sólido color naranja (A2).
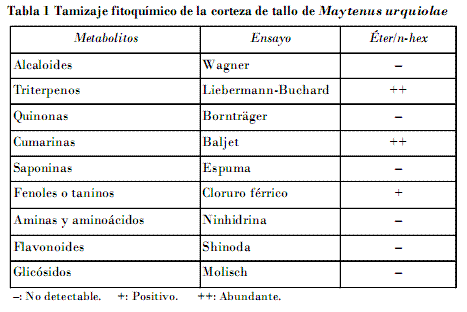
Para detectar las principales familias de metabolitos presentes en la corteza del tallo se procedió a realizar el tamizaje fitoquímico según el Minsap (1994).
El compuesto A1 fue caracterizado por su punto de fusión y por espectroscopia IR-FT, 1 H-RMN y 13 C-RMN.
Se preparó una columna cromatográfica por vía seca en la que se utilizó como adsorbente gel de sílice 60 de tamaño 0,063-0,200 mm de alta pureza, y se le añadieron 5 g de A2 disueltos en 10 mL de n-hexano, la columna se eluyó con n-hexano, n-hexano-cloroformo 1:1, cloroformo, acetato de etilo y metanol. La fracción de n-hexano se concentró al vacío hasta total sequedad, y el residuo (R1 ) se analizó por CG-MS.
Con el objetivo de evaluar la actividad fungicida se seleccionó como hongo diana una cepa de Curvularia clavata B. L. Jain, patógeno en pastos, donado por el cepario del Inisav, que se sembró en placas Petri de 9 cm de diámetro con PDA, las que se incubaron a 28 ± 2°C durante siete días. Para la producción de conidios se transfirieron de dos a tres porciones del micelio a hojas de yerba Don Carlos (Sorghum halepense L. Pers.) en agar agua. Después de 72 h y observados los conidios al estereoscopio, se tomaron las hojas que se transfirieron a medio líquido papa dextrosa y se incubaron a 28 ± 2°C durante 72 h. El ensayo se llevó a cabo según el método descrito por Philip et al. (1984), modificado con papa dextrosa como medio de cultivo. En placa delgada cromatográfica de 25 x 25 cm, cubierta de gel de sílice (0,5 mm de espesor) se aplicaron 5, 10, 20, 40 y 100 µL de una solución de A2 de concentración 5 mg/mL en acetato de etilo. Después de evaporado el solvente se asperjaron 10 mL de suspensión de esporas del hongo fitopatógeno C. clavata. La placa cromatográfica se incubó por espacio de cuatro días a 32 ± 2°C en cámara húmeda (humedad > 95%) en la oscuridad. Como control positivo se utilizó tebuconazol a 50 µg/mL. Se evaluó cualitativamente la inhibición de la germinación de conidios.
RESULTADOS Y DISCUSIÓN
En el tamizaje fitoquímico realizado el ensayo de Liebermann-Buchard para la identificación de triterpenos dio positivo; se observó la formación de una coloración roja con gran intensidad, hecho que indica abundancia de este metabolito en la corteza de tallo. En el ensayo de Baljet, para la identificación de las cumarinas, se notó su presencia en buenas cantidades. Se identificó la presencia de fenoles o taninos en el ensayo del cloruro férrico. Por último, el ensayo de Molisch confirmó la presencia de glicósidos (Tabla 1).
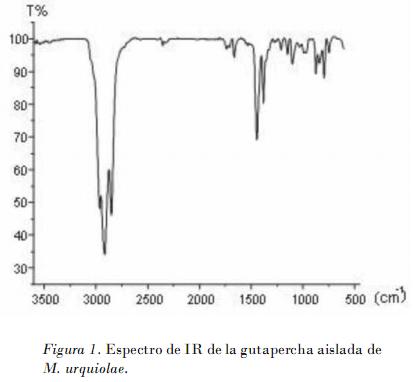
El sólido esponjoso de color blanco A1 resultó soluble en tetracloruro de carbono y diclorometano, e insoluble en metanol y acetato de etilo. Su apariencia física y solubilidad sugieren la posibilidad de estar en presencia de 1,4 trans poliisopreno, polímero natural conocido como gutapercha. El intervalo de la temperatura de fusión fue de 68-70°C, valor superior al reportado para el mismo polímero aislado de Maytenus acanthophylla (52,5-56°C) [Menezes de Oliveira et al., 2006]. La diferencia en las temperaturas de fusión puede deberse a diferencias en el grado de polimerización.
El espectro IR de A1 muestra señales de carbonos con hibridación sp2 (> 3000 cm_1). El grupo CH3 también se detecta por sus bandas características de 2915, 2890 y 1446 cm_1 . La banda a 1664 cm_1 caracteriza la frecuencia de vibración estiramiento de doble enlace carbonocarbono (nC=C), y a 796 cm_1 aparece la banda de doblaje fuera del plano de alquenos ?CH.
La ausencia de señales correspondientes a grupos carbonilo, amino, alcoholes u otros compuestos oxigenados, son también elementos que confirman la presencia de la gutapercha (Fig. 1).
Se verificó la estructura del polímero con los espectros de 1 H-RMN y 13 C-RMN. En el espectro de 1 H-RMN (Fig. 2) aparecen dos señales características del compuesto, una perteneciente al protón olefínico (d5,12 p.p.m. (1H,s)) y otra del grupo CH3 (d1,60 ppm (3H,s)); aparece además la señal de los grupos metilenos (CH2 ) (d2,01 p.p.m. (4H,d)).
El espectro de 13 C-RMN muestra cinco señales pertenecientes a la unidad estructural (Fig. 3). Las señales a 135 p.p.m. (=CH-) y 125 p.p.m. pertenecen a los carbonos sp2 del doble enlace; la señal a 16 p.p.m. al grupo CH3; y las señales a 40 p.p.m. y 27 p.p.m. a los grupos CH2.
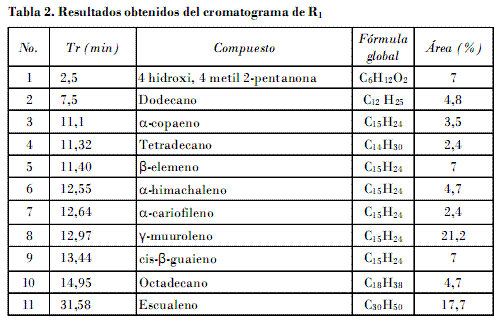
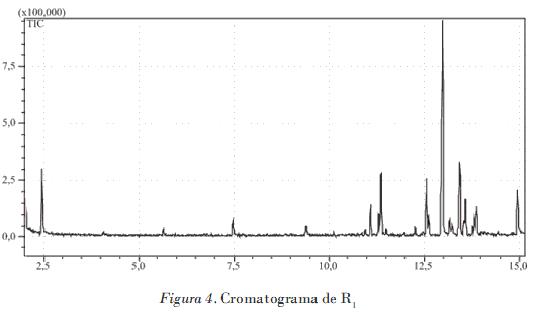
R1 se logró del fraccionamiento de A2 y se hizo un CG-MS. La Tabla 2 resume los resultados del cromatograma de R1 (Fig. 4). Se utilizó una columna SPB-5 (30 m x 0,25 mm x 0,25 µm) con una programación de temperatura para el horno de 60°C (2 min), 4°C/min hasta 250°C (20 min).
El detector empleado fue de impacto electrónico (70eV) a 230°C. La detección se realizó en el modo scan entre 35 y 400 uma. Los componentes fueron identificados por comparación de sus espectros de masas con los compilados en la base de datos NIST98.
Fueron detectados 11 compuestos. Seis identificados son sesquiterpenos, los cuales significan más del 50% de la composición de R1 . Se destaca d-muuroleno con el 21,2%. Es de notar que, según la literatura, los sesquiterpenos son sustancias comunes en las Celastraceas, y se relacionan con la biosíntesis de los agarofuranos, metabolitos con marcada actividad insecticida [Céspedes et al., 2001]. Fueron detectados además tres hidrocarburos saturados de 12, 14 y 18 átomos de carbono.
Los resultados _primeros de carácter fitoquímico que se le realizan a esta planta_ dan elementos que confirman su clasificación taxonómica, puesto que la gutapercha es considerada un marcador quimiotaxonómico de la familia Celeastraceae. Las familias de metabolitos encontradas en el tamizaje fotoquímico como triterpenos, cumarinas y compuestos fenólicos están ampliamente descritas por sus actividades biológicas en el control de plagas. Los triterpenos se caracterizan por ser muy efectivos como insecticidas y fungicidas [Chen et al., 2005; Connolly y Hill, 2002], de los compuestos fenólicos en general, y las cumarinas en particular se conoce su efecto insecticida, fungicida y rodenticida [Duke, 1990; Baskar et al., 2010].
Finalmente, los sesquiterpenos identificados por cromatografía gaseosa se caracterizan por provocar efecto antialimentario en insectos y alelopático [Fraga, 2003; Silva et al., 2009]. Todos estos elementos indican a esta planta como promisoria fuente de metabolitos activos en el control de plagas.
En la Tabla 3 se listan los valores de la inhibición del crecimiento miceliar de C. clavata respecto a la cantidad de extracto de A2 aplicado.
El extracto obtenido a partir de M. urquiolae (A2 ) comenzó a evidenciar efecto antifúngico a partir de los 20 µL, equivalente a 100 µg del crudo. Los valores obtenidos son interesantes, ya que se está evaluando un extracto que contiene una mezcla de metabolitos y no a un compuesto puro. El o los metabolitos responsables de la actividad biológica pueden estar en diferentes proporciones en el extracto, desde ser mayoritario a solo encontrase a nivel de trazas. Este estudio merece una profundización en el análisis de los metabolitos involucrados en la actividad antifúngica por la posible utilización en el control de patógenos en la agricultura.
CONCLUSIONES
• El extracto en n-hexano/éter etílico (1:1) de la corteza del tallo de Maytenuz urquiolae Mory inhibió la germinación conidial de C. clavata.
• El tamizaje fitoquímico realizado a la corteza del tallo mostró la presencia de triterpenos, cumarinas, compuestos fenólicos y glicósidos.
• Se aisló y caracterizó un polímero natural (1,4 trans poliisopreno) conocido como gutapercha, el cual es un marcador quimiotaxonómico de la familia Celastraceae.
• Para la fracción R1 se identificaron 11 compuestos, seis de ellos sesquiterpenos.
REFERENCIAS
Alvarenga, N.; C. A. Velásquez; N. Canela de Alvarenga: «Actividad biológica de compuestos aislados de corteza de raíz», Revista de Ciencia y Tecnología, Dirección de Investigaciones, UNA 1 (3): 51, México, 2001.
Avilla, J.; A. Teixidio; C. Velázquez; N. Alvarenga; E. A. Ferro; R. Canela: «Insecticidal Activity of Maytenus species (Celastraceae) Nortriterpene Quinone Methides Against Codling Moth, Cydia pomonella (L.) (Lepidoptera: Tortricidae)», Journal of Agricultural and Food Chemistry 48 (1): 88-92, EE. UU., 2000.
Baskar, K.; R. Maheswaran; S. Kingsley; S. Ignacimuthu: «Bioefficacy of Couroupita guianensis (Aubl) Against Helicoverpa armigera (Hub.) (Lepidoptera: Noctuidae) Larvae, Spanish», Journal of Agricultural Research 8 (1): 135-141, España, 2010.
Céspedes, C. L.; E. J. Aranda; A. J. Becerra; O. M. Silva; L. Achnine: «Insect Growth Regulator and Insecticidal Activity of â Dihydroagarofurans from Maytenus spp. (Celastraceae)», Zeitschrift fur Naturforschung 56: 603-613, Alemania, 2001.
Chen, J. C.; M. H. Chiu; R. L. Nie; G. A. Cordell; S. X. Qiuc: «Cucurbitacins and Cucurbitane Glycosides: Structures and Biological Activities», Natural Products Reports 22: 386-399, EE. UU., 2005.
Connolly, J. D.; R. A. Hill: «Triterpenoids», Natural Products Reports, 19: 494-513, EE. UU., 2002.
Dias, J. F.; G. M. Cirio; M. D. Miguel; O. G. Miguel: «Contribution to the Allelophatic Study of Maytenus ilicifolia Mart. ex Reiss., Celastraceae», Revista Brasileira Farmacognosia. 15 (3): 220-223, Brasil, 2005.
Duke, S. O.: Natural Pesticides From Plants, Advances in New Crops, Timber Press, Portland, EE. UU., 1990.
Fraga, B. M.: «Natural Sesquiterpenoids», Natural Products Reports 20: 392-413, EE. UU., 2003.
González, A. G.; N. Alvarenga; A. Ravelo; I. Bazzocchi; E. Ferro; A. Navarro; L. Moujir: «Scutione. A New Bioactive Norquinonemethide Triterpene from Maytenus Scutioides (Celastraceae). Biorganic», Medicinal Chemistry 4: 815-820, EE. UU., 1996.
Menezes de Oliveira, D.; G. D. De Fátima Silva; L. Pains Duarte; S. A. Vieira Filho: «Chemical Constituents Isolated from Roots of Maytenus acanthophylla Reissek (Celastraceae)», Biochemical Systematics and Ecology 34: 661-665, EE. UU., 2006.
Minsap: Guía para el tamizaje fotoquímico, Minsap, La Habana, 1994.
Mory, B.: «Maytenus urquiolae Mory sp. nov. eine neue Celastraceae für die flora von kuba mit 3 tafeln und 2 tabellen», Feddes Repertorium 104 (7-8): 431-438, Alemania, 1993.
Philip, H. E.; W. S. Bowers; E. J. Funk: «Identification on Fungicidal and Namaticidal Omponents in the Leaves of Piper bettle (Piperaceae)», Journal of Agricultural and Food Chemistry 32: 1254-1256, EE. UU., 1984.
Santos-Oliveira, R.; S. Coulaud-Cunha; C. Waldeciro: «Revisão da Maytenus ilicifolia Mart. ex Reissek, Celastraceae. Contribuição ao estudo das propriedades farmacológicas», Revista Brasileira de Farmacognosia 19 (2b): 650-659, Brasil, 2009.
Silva, A. P. da; M. A. Marçal; M. G. Bichara; R. L. Cunha: «Efeitos potencialmente alelopáticos dos óleos essenciais de Piper hispidinervium C. DC. e Pogostemon heyneanus Benth sobre plantas daninhas», Acta Amazonica 39 (2), Brasil, 2009.
Spivey, A. C.; M. Weston; S. Woodhead: «Celastraceae Sesquiterpenoids: Biological Activity and Synthesis», Chemical Society Review 31 (1): 43-59, EE. UU., 2002.