Introducción
El pie diabético (PD) constituye un problema de salud mundial. Los pacientes presentan lesión y/o ulceración del pie, inducida por la hiperglucemia mantenida, con o sin existencia de isquemia y previo desencadenante traumático. El PD constituye el 3 % de los ingresos hospitalarios de los diabéticos, entre el 60 %-70 % de estos casos presentan infección, esta última responsable de la estadía hospitalaria prolongada.1
La hiperglucemia pudiera favorecer las infecciones, pero la glucosa no potencia el crecimiento bacteriano, hecho que sugiere la participación del sistema inmune en esta susceptibilidad.2 Las alteraciones en el sistema inmune promueven la inflamación y la resistencia a la insulina, y están relacionadas con fagocitosis, quimiotaxis, síntesis de citocinas proinflamatorias, desbalance en las células Th1, Th17 y T reguladora, disminución en la síntesis de anticuerpos y del sistema del complemento.3,4,5,6) Existe una relación entre la diabetes mellitus (DM) y las infecciones; en el pie diabético se detectan gérmenes como el Staphylococcus aureus, Streptococcus pyogenes, gram negativos o anaerobios.7,8
La disfunción celular de la inmunidad innata es significativa en la DM de tipo 2, con activación crónica e incremento de citocinas proinflamatorias;9,10,11,12 esto contribuye a la disfunción de las células β pancreáticas y agrava las complicaciones del diabético. La acumulación de macrófagos interfiere con el proceso de fagocitosis en la diabetes.10,13
El elemento inmunológico no resulta bien identificado en la práctica médica asistencial y puede variar según la presentación clínica del pie diabético. La descripción del estado inmunológico permitiría a los médicos angiólogos asistenciales seleccionar una inmunoterapia adecuada de apoyo en caso de que existieran alteraciones inmunológicas.
Debido a la multifactorialidad implicada en la evolución del paciente con pie diabético, tanto los factores inmunológicos secundarios como el control metabólico mediante la medición de la hemoglobina glucosilada (HbA1c) constituyen un pilar importante en el manejo integral de dicho paciente. Por tal motivo, se propuso como objetivo caracterizar las alteraciones del estado inmunometabólico de los pacientes con pie diabético.
Métodos
Se realizó un estudio descriptivo de corte transversal en 25 pacientes diabéticos de tipo 2 con diagnóstico de pie diabético, los cuales fueron ingresados en el servicio de Angiología y Cirugía Vascular del Hospital Universitario “Manuel Ascunce Domenéch” de Camagüey, en el período comprendido entre septiembre y diciembre de 2018. Se excluyeron del estudio los pacientes diabéticos sin estudio inmunológico completo.
Todos los pacientes incluidos dieron su consentimiento para utilizar sus datos en el estudio.
Las variables fueron: edad, sexo (femenino y masculino), tipo de pie diabético, inmunoglobulina G (IgG), componente 3 (C3) del sistema complemento y HbA1c.
Se trabajó con suero obtenido de sangre venosa periférica sin anticoagulante, en el que se determinaron las concentraciones séricas de los parámetros del sistema inmunológico y el porciento de HbA1c; ambos por métodos turbidimétricos que utilizaron el autoanalizador bioquímico New INLAB 240 (Italia) del laboratorio de inmunología del hospital.
Los valores de referencias del prospecto del diagnosticador para los parámetros inmunológicos fueron los siguientes:
Se trabajó con los siguientes criterios para agrupar los resultados:
Normal: cuando los valores están en el rango.
Disminuido: cuando los valores están por debajo del límite inferior del rango.
Aumentado: cuando los valores son mayores que el límite superior del rango.
Se consideró la HbA1c normal cuando los valores se encontraban entre 4,5 % y 7 %; dudosa si estaban entre 7 % y 8,5 %; y por encima de 8,5 %, patológica (desbalance o descompensación metabólica).
La edad se estratificó en 4 grupos:
Se utilizaron las siguientes clasificaciones etiopatogénicas del profesor McCook14 para agrupar las formas clínicas de presentación del pie diabético:
Neuroinfeccioso: incluye el mal perforante plantar (con y sin osteomielitis), el absceso, la celulitis y el flemón difuso.
Isquémico: incluye la úlcera isquémica, la gangrena y la gangrena en parche.
Mixto: incluye el isquémico infectado.
Se llenó una base de datos con los resultados de todas las variables en una planilla Excel, las cuales se procesaron estadísticamente con la ayuda del Programa Estadístico para las Ciencias Sociales (SPSS) v25.0 para Windows.
Las variables cuantitativas fueron transformadas en cualitativas y se resumieron en frecuencias absolutas y relativas. Se trabajó con un nivel de confiabilidad del 95 % (α = 0,05).
Resultados
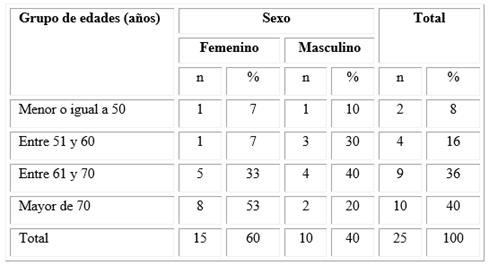
Más de la mitad de los pacientes con pie diabético correspondieron al sexo femenino y el grupo de edad más frecuente fue el de mayores de 70 años, seguido de aquellos entre 61 y 70 años (Tabla 1).
Tabla 1 Distribución de los pacientes con pie diabético según grupo de edades y sexo
Fuente: Registro de los pacientes.
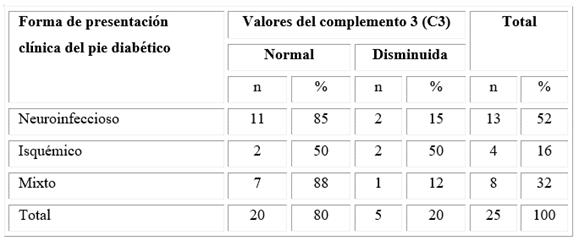
Los valores de los componentes del sistema complemento indicaron que la quinta parte de los pacientes tuvieron disminución del componente C3 (distribuidos entre pie diabético neuroinfeccioso, pie diabético isquémico y pie diabético mixto) (Tabla 2).
Tabla 2 Distribución de los pacientes con pie diabético según sus formas de presentación clínica y los valores del C3
Fuente: Registro de los pacientes.
Los niveles séricos de IgG fueron normales en casi la mitad de los pacientes y se encontraron disminuidos en casi un tercio; entre estos últimos, el 30 % pertenecía al grupo de pie diabético neuroinfeccioso. En contraste, se observó un aumento de las concentraciones séricas de IgG en un tercio de los pacientes (equitativo entre pacientes con pie diabético neuroinfeccioso y el mixto) (Tabla 3).
Tabla 3 Distribución de los pacientes con pie diabético según sus formas de presentación clínica y los valores de la IgG

Fuente: Registro de los pacientes.
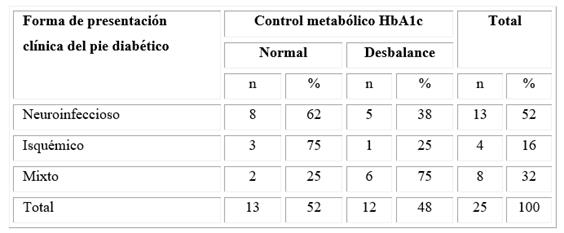
El control metabólico según HbA1c reflejó un desbalance en el 48 % de la población estudiada; de ellos la mitad correspondió al grupo de pacientes con pie diabético mixto. Dentro de los pacientes con descontrol metabólico, 8 mostraron alteraciones en las concentraciones séricas de IgG y 2 en las de C3 (Tabla 4).
Discusión
Los diabéticos entre la séptima y octava décadas de vida presentan un deterioro orgánico y desarrollan complicaciones severas de la enfermedad, entre ellas el pie diabético y las infecciones, fenómenos asociados a la inmunosenescencia.
En este estudio predominaron los individuos con más de 70 años, resultado que coincide con Lepedda y otros,15 que encontraron una media para la edad de 72,2 años con una desviación estándar de 7,7 años.
El sexo femenino predominó en la muestra, y fue relevante que el mayor número de mujeres se ubicara en el grupo de más de 70 años, lo que se correspondió con que el indicador de esperanza de vida resultara superior en las mujeres que en los hombres, independientemente de su enfermedad de base; sin embargo, en el trabajo de Lepedda y otros15 se describió lo contrario, con una relación 14:1 a favor del sexo masculino.
El haber encontrado un 20 % de pacientes que presentaron una disminución en la concentración sérica de C3 pudiera explicarse por la inmunidad innata, la que resulta relevante en la defensa contra infecciones bacterianas. La fagocitosis es un mecanismo que integra elementos celulares y humorales; en particular, el componente C3 del sistema de complemento tiene crucial importancia en esta función, razón por la que su disminución implica el desarrollo de cuadros sépticos severos en los pacientes.
Hostetter16 señaló que la unión de la glucosa al sitio bioquímicamente activo del complemento C3 inhibe la unión de esta proteína a la superficie microbiana y perjudica la opsonización; además, Ahrén y otros17 agregaron el papel de dicho componente en la modulación de la secreción de la insulina, independiente de otros factores moduladores de la glucemia, como la edad, la adiposidad y la inflamación subclínica. Ambos autores coincidieron con los resultados del componente C4 de este estudio, donde no está relacionado con la enfermedad, al contrario del C3 que sí tiene un papel directo en la fisiopatología de la DM y sus complicaciones.
La rama humoral de la inmunidad adquirida implica síntesis de anticuerpos. Los resultados obtenidos fueron variables en cuanto a las concentraciones sérica de la IgG. En un primer grupo de pacientes con valores normales se denotó la integridad de este mecanismo; en otro grupo con valores disminuidos, que reveló deterioro del sistema inmune y que fueron incapaces de defenderse adecuadamente, se recomendó reponer el déficit con una terapia basada en la administración de inmunoglobulinas de forma parenteral a intervalo de 21 a 28 días, por un período de 6 meses; y en un tercer grupo con concentraciones aumentadas de IgG se reflejó la conservación del sistema inmune, explicada por una activación policlonal de las células B.
Sá y otros18 estudiaron la asociación entre algunos parámetros inmunes y el control glucémico. En sus resultados describieron las concentraciones de IgG con una distribución variable: 50 % normal, 43,4 % elevadas y 3,8 % disminuido, los cuales coincidieron con este trabajo.
En tres pacientes se conjugaron la disminución de la IgG y del componente C3, elementos que deben orientar la toma de conducta alternativa de inmunoterapia.
El control metabólico constituye un factor esencial para la estabilidad del paciente diabético, así se evitan las complicaciones y secuelas. La mitad de la muestra analizada presentó un desbalance metabólico, que fue más notorio en los pacientes con pie diabético mixto. En correspondencia con el efecto negativo del desbalance, los pacientes se complicaban y eran ingresados para su tratamiento y rehabilitación. Además, en aquellos con descontrol metabólico se constató déficit inmunológico de C3 e IgG. Los autores Lepedda y otros15 describen mayor descontrol en los pacientes diabéticos con respecto a sus controles.
La hiperglucemia causa glucosilación no enzimática de las inmunoglobulinas, induce expresión de receptores tipo TOLL, inhibe la función de neutrófilos y la apoptosis, permite expresar a los gérmenes proteínas que facilitan la adherencia y dificultan la fagocitosis; estos hallazgos se derivan de las investigaciones de Jafar y otros2 y Llorente y otros.19
Peleg y otros20) señalaron que la hiperglucemia asociada a la vasculopatía altera el correcto accionar de las células polimorfonucleares y el aumento de la HbA1c tiene el mismo efecto en la biología de los anticuerpos, cuya influencia no ha sido demostrada en la clínica; estas sugieren alteraciones del funcionamiento de los linfocitos: cuando la HbA1c está por debajo del 8 % no se alteran los linfocitos T CD4 +. La hiperglucemia afecta el proceso inflamatorio en la diabetes mediante la inducción de la expresión de los genes que aumentan la producción de citocinas proinflamatorias, así como la defensa contra infecciones, lo que impide la producción de interferón (IFN) de tipo I.21,22
En este trabajo se observó que coincidieron en un mismo paciente el descontrol metabólico y las alteraciones en la respuesta inmune humoral, a pesar de que en algunos pacientes las concentraciones del complemento y de las inmunoglobulinas fueron adecuadas. La literatura refiere que un mal control glucémico se relaciona con un mayor riesgo de morbilidad y mortalidad asociadas a las infecciones, especialmente en la población longeva.15,20,23)
La respuesta inmune deteriorada influye en la severidad y evolución clínica del pie diabético. Es importante medir estos parámetros para seleccionar un tratamiento más integral en el paciente. Las limitaciones del estudio conciernen a que no se realiza una investigación directa de la inmunidad innata celular de los pacientes, no se miden otros elementos del sistema inmune, ni se trabaja con los valores puntuales de los parámetros evaluados, y el tamaño del grupo es pequeño.
Se concluye que existe un grupo de pacientes diagnosticados con pie diabético que presentan alteraciones inmunológicas variables y/o descontrol metabólico. Este grupo podría beneficiarse con un manejo integral a partir del uso de inmunoterapia y la prevención de complicaciones infecciosas del pie diabético. Los parámetros evaluados pueden considerarse al valorar terapias alternativas como la inmunoterapia de forma individualizada, en dependencia del tipo de alteración inmune.
Se recomienda extender el estudio a aspectos relacionados con la inmunidad innata celular y dosificar citocinas.