INTRODUCCIÓN
La covid-19, producida por el SARS-Cov-2, ha tomado forma de enfermedad infecciosa rápidamente propagable, afectando prácticamente a todos los países del mundo. La tasa de letalidad global de la covid-19 está en el rango del 1,4-2,9 %;1,2 sin embargo, varios grupos de riesgo han sido identificados como más vulnerables por presentar una forma más severa de la enfermedad, por consiguiente, tienen mortalidad superior. Según estudios sobre diferentes comorbilidades asociadas en los pacientes, como obesidad, diabetes mellitus, hipertensión, enfermedad cardiovascular, enfermedad renal crónica, cáncer y envejecimiento, estas parecen jugar un papel importante en las complicaciones de los pacientes con una mayor letalidad. En otras palabras, la mayor severidad ocurre precisamente en los individuos que integran padecimientos relacionados con el síndrome metabólico.3-7
El síndrome metabólico comprende un conjunto de factores de riesgo cardiovascular -representado por obesidad central, dislipidemias, desajustes en el metabolismo glucídico e hipertensión arterial-, estrechamente asociado a resistencia a la insulina; es considerado como predictor de morbilidad y mortalidad cardiovascular, y un estado que predispone a la evolución futura de diabetes mellitus tipo 2.8 Además, no se trata de una enfermedad única, sino de la asociación de varios problemas de salud que pueden aparecer de forma simultánea o secuencial en un mismo individuo, y que combinan factores genéticos y ambientales, asociados al estilo de vida, siendo la resistencia a la insulina el componente fisiopatogénico fundamental.9,10
El incremento del consumo de calorías y su relación con la obesidad, es considerado, en las últimas décadas, uno de los principales contribuyentes a las epidemias mundiales de síndrome metabólico.11,12) La obesidad constituye uno de los principales factores de riesgo y una amenaza para la salud pública, ya que globalmente uno de cada tres individuos, entre adultos y niños, son obesos o sobrepeso, y el predominio de sobrepeso y la obesidad continúa aumentando en países desarrollados y en desarrollo. Los estudios confirman que la obesidad predispone a varias complicaciones médicas relacionadas con el síndrome metabólico.8,13 Por ello, la Organización Mundial de la Salud la incluye con acierto entre las epidemias del siglo XXI, ya que en el mundo existen aproximadamente 1 600 millones de personas con sobrepeso y 400 millones de obesos. En Cuba, un estudio reciente del Instituto de Nutrición e Higiene de los Alimentos, estima que el 42,46 % de la población tiene sobrepeso, y que este es más frecuente en las mujeres que en los hombres.
Esto es preocupante, pues la obesidad es un factor de riesgo para enfermedades como la hipertensión arterial, la diabetes mellitus tipo 2, los accidentes vasculares encefálicos, que están entre las primeras causas de muerte en el mundo.14-17 La obesidad es a menudo considerada el resultado del fallo de los mecanismos homeostáticos que regulan el peso corporal en un ambiente de sobrealimentación calórica y sedentarismo. Recientemente, una de las claves en las investigaciones de la obesidad es reconocer que esta enfermedad está caracterizada por una predisposición al estado de inflamación crónica.
Comprender los mecanismos por los cuales los azúcares, como la glucosa, fructosa y sacarosa, por su elevado índice glicémico, podrían contribuir al incremento del síndrome metabólico, puede proveer de las interpretaciones de los mecanismos moleculares que pueden emplearse para desarrollar nuevas estrategias y procedimientos diagnósticos, preventivos y terapéuticos. Por consiguiente, el objetivo de la presente revisión temática es analizar el estado actual del conocimiento científico con relación a los fundamentos moleculares de los efectos patogénicos de la ingesta glucídica, por su principal aporte calórico, en los procesos de inflamación presentes en individuos que integran padecimientos relacionados con el síndrome metabólico y que juegan un papel importante en las actuales complicaciones de los pacientes de covid-19, incrementando la letalidad. Al mismo tiempo, revisaremos el metabolismo de los glúcidos, en especial la fructosa, por su mayor aporte lipogénico, todo lo cual puede contribuir a prevenir comorbilidades mediante cambios en el estilo de vida de la población.
Se ha realizado una búsqueda fundamentalmente en las bases de datos PubMed, SciELO, ClinicalKey y LILACS, utilizando los diferentes descriptores. En la misma se incluyeron artículos originales, originales breves, revisiones y metaanálisis, que fueron categorizados por año de publicación y revista. Se hallaron más de 200 publicaciones, de las cuales se seleccionaron, por su relevancia y actualidad, 47 artículosen su mayoría originales. De ellos, 45 fueron publicados a partir de 2017 (98 %) y de estos 38 a partir de 2018 (81 %); la mayoría se obtuvieron en la base de datos PubMed.
DESARROLLO
El consumo de azúcares, como parte del estilo de vida, contribuye al incremento de los procesos inflamatorios en humanos, que constituyen el principal factor de riesgo en la patogénesis de las enfermedades cardiovasculares y la diabetes mellitus.18-21
Los más recientes estudios revelan el mayor efecto lipogénico de la fructosa respecto a la glucosa, lo cual se relaciona con su rápida utilización por el hígado, propiciando la lipogénesis y la secreción de lipoproteína de muy baja densidad, las cuales finalmente causan dislipidemias.22,23
La glucosa es la forma predominante de azúcar circulante en organismos animales, mientras que la sacarosa -un disacárido compuesto de porciones iguales de glucosa y fructosa- es el azúcar circulante predominante en las plantas. Ambas constituyen la base de la cadena alimenticia. Los herbívoros y omnívoros están altamente adaptados para usar sacarosa para las necesidades energéticas y biosintéticas; por consiguiente, la fructosa no circula en altos niveles en animales, y la fructosa ingerida puede ser excepcionalmente empleada para comunicar señales relacionadas con el consumo de azúcar.24 Son múltiples las investigaciones desarrolladas en las últimas décadas para evaluar la posible asociación entre el consumo elevado de fructosa y los efectos adversos para la salud del ser humano, así como son múltiples también las hipótesis propuestas para tratar de explicar los hallazgos.
La fructosa presente en el organismo humano puede tener un doble origen: exógeno y endógeno. La de origen exógeno es la que ingresa con los alimentos, sean estos naturales o artificiales. En los alimentos naturales, la fructosa se puede encontrar en forma libre en las frutas, los vegetales y la miel de abejas, o formando parte del disacárido sacarosa, que es el alimento natural que mayor cantidad de fructosa aporta al hombre. Entre los alimentos artificiales que aportan mayor cantidad de fructosa están los refrescos y bebidas azucaradas -algunas de ellas con sirope de maíz rico en fructosa- y los jugos de frutas -los cuales, por término medio, contribuyen aproximadamente con un 7 % de calorías diarias y casi un 50 % de azúcares añadidas a la dieta.25,26 Otros contribuyentes principales son las confituras y los alimentos de repostería en general, que aportan entre el 4 y el 9 % de la ingesta diaria de energía, dependiendo de la edad.27
La fructosa endógena es la que se sintetiza en el metabolismo intermediario celular de los glúcidos, o por degradación de los aminoazúcares. En el metabolismo de los glúcidos, la fructosa se sintetiza como monosacárido derivado (fosforilado) en la vía glucolítica y en el ciclo de las pentosas.28
La fructosa libre ingerida presente en los alimentos no precisa digestión, a diferencia de la aportada por la sacarosa, la cual tiene lugar en el borde en cepillo de los enterocitos del intestino delgado bajo acción del complejo enzimático sacarasa-isomaltasa. La fructosa es absorbida pasivamente en la membrana apical del enterocito por el transportador de hexosas conocido como GLUT 5, que tiene alta afinidad para fructosa, mientras en la membrana basolateral se sitúa el transportador GLUT 2.29
Como resultado del proceso de absorción intestinal, la fructosa pasa rápidamente a la sangre portal, llega al hígado, y después al resto de las células de los tejidos, donde se metaboliza. El metabolismo de la fructosa ocurre principalmente en el hígado, órgano que metaboliza entre el 50 y el 75 % de la fructosa ingerida. Las concentraciones de fructosa en plasma periférico pueden aumentar 10 veces después del consumo de fructosa, y regresar rápidamente a los niveles iniciales en unas 2 horas; este rápido aclaramiento es mediado en gran parte por su extracción eficiente por el hígado. Mientras que este extrae solo del 15 al 30 % de la ingesta de glucosa, es capaz de extraer hasta un 75 % de la ingesta de fructosa.30
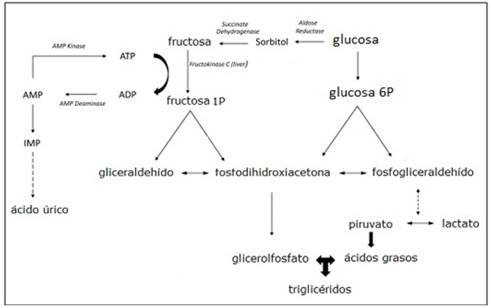
Una vez que la fructosa penetra las células de los tejidos que poseen el transportador GLUT 2, ocurre la fosforilación de la misma a expensas del consumo de ATP, mediante dos vías según la disponibilidad de enzimas del órgano: una vía emplea las hexoquinasas que fosforilan la fructosa en el carbono 6, dando lugar a la fructosa-6-fosfato (F6P), mientras que en el hígado, intestino, riñones y adipocitos se encuentra la fructoquinasa, altamente específica para la fructosa, produciendo fructosa-1-fosfato (F1P). La fructosa una vez fosforilada puede seguir diferentes destinos metabólicos; en requerimientos de alta demanda de energía, se acopla a la glucólisis, proceso regulado por la enzima fosfofructoquinasa, la cual limita el flujo de la glucólisis hepática; mientras que en bajos requerimientos de energía, la F1P se emplea en la síntesis de ácidos grasos y glicerol-3-fosfato, precursores de los triacilglicéridos.30
La incorporación de la fructosa a la vía glucolítica mediante su transformación en F1P se regula por disponibilidad de sustrato. Teniendo en cuenta que esta es la forma en que se metaboliza la fructosa predominantemente en el hígado, al aumentar la entrada del monosacárido al órgano por incremento de su ingestión, se favorece el destino anabólico, mediante la síntesis y salida de triacilglicéridos a través de las lipoproteínas de muy baja densidad. Por lo tanto, los altos niveles de fructosa en el sistema portal y su metabolismo en el hígado conducen al alto flujo de triosas fosfatadas, que secundariamente se convierten en lactato o glucosa por gluconeogénesis y se liberan a la circulación, así como la estimulación de la síntesis “de novo” de ácidos grasos; por consiguiente, la fructosa resulta ser más lipogénica que la glucosa.24
La eficiencia y la rapidez con las que el hígado puede extraer y fosforilar la fructosa ingerida, pueden tener repercusiones deletéreas, como por ejemplo las disminuciones en fosfato intracelular (ATP). Debido a la fosforilación rápida de la fructosa, puede aumentar la producción de ácido úrico a través de la activación de la enzima adenosín-desaminasa, lo cual conduce al catabolismo de AMP para formar ácido úrico. Por consiguiente, el consumo de fructosa estimula la síntesis de purinas, contribuyendo a la producción de ácido úrico. Los niveles de ácido úrico circulantes aumentados, constituyen la hiperuricemia, incrementando el riesgo de gota, una condición inflamatoria de las articulaciones.31
El hígado está en un cruce de caminos metabólicos y es crucial para calibrar el consumo de nutrientes y su estado periférico, para regular el almacenamiento sistémico de combustible vs. consumo. Mientras las hormonas insulina y glucagón informan al hígado del estado sistémico de combustible, el hígado está también configurado para integrar señales derivadas directamente de sustratos combustibles.24
La producción endógena de fructosa se produce en los animales a través de la vía sorbitol (poliol), a partir de glucosa. En esta vía, la glucosa se reduce primero al sorbitol por la aldosa reductasa, mientras que el sorbitol es luego oxidado a fructosa por la enzima sorbitol deshidrogenasa, tal como se muestra en la siguiente figura.
La síntesis endógena de fructosa y los metabolitos polioles son considerados cruciales en el auge de complicaciones microvasculares diabéticas, ya que la vía sorbitol aumenta su actividad durante la hiperglicemia diabética.32
Recientes estudios revelan el mayor efecto lipogénico de la fructosa respecto a la glucosa, lo cual se relaciona con su rápida utilización por el hígado, propiciando la lipogénesis, la obesidad y las dislipidemias.22,23 Se asume como premisa que el consumo de azúcar dietético contribuye al aumento de procesos inflamatorios en el organismo humano, señalando específicamente fructosa en sirope de maíz con alto contenido de fructosa (HFCS, por sus siglas en inglés), o contenido en la sacarosa conjuntamente con glucosa.
Las diferencias en el metabolismo de fructosa individualmente o encontrada en la sacarosa, en comparación con la glucosa deberían ser consideradas, para distinguir cuál es el papel potencial de cada uno en el desarrollo de los procesos inflamatorios relacionados con el síndrome metabólico.
Por consiguiente, parte de la revisión realizada de la literatura científica consistió en evaluar, mediante la información disponible, la relevancia de fructosa, sacarosa y consumo de glucosa para niveles sistémicos de biomarcadores de inflamación.
La fructosa se convierte en el hígado en glucosa, lactato, glucógeno y lípidos, los cuales subsiguientemente aparecen en la circulación. El metabolismo hepático de fructosa también difiere de metabolismo hepático de glucosa en su regulación por insulina. El metabolismo hepático de glucosa (glucólisis) está regulado por insulina, el estado celular de energía (ATP) y las concentraciones de citrato, mientras que el metabolismo hepático de la fructosa es independiente de tales factores.19
Como ha sido previamente discutido, el metabolismo de fructosa dietética (aisladamente o contenida en la sacarosa) ha sido reportado en la promoción de la síntesis de “novo ácidos” grasos libres en el hígado cuando se consume en cantidades elevadas.24 El triglicérido hepático resultante de la lipogénesis después de una simple ingesta de fructosa, es almacenado y acumulado, constituyendo un síntoma benigno de esteatosis, ya que hay evidencias de que los metabolitos procedentes de los ácidos grasos libres pueden contribuir a la progresión de enfermedad del hígado graso no alcohólica (en inglés, NAFLD), esteatohepatitis no alcohólica (en inglés, NASH) por los procesos inflamatorios provocados, y adicionalmente, en la formación de especies reactivas de oxígeno (EROS) y apoptosis.22 Los estudios de biopsias de tejidos muestran un incremento gradual en niveles sistémicos de biomarcadores de inflamación, como son la proteína C reactiva (en inglés, CRP), interleuquina-6 (IL-6), proteína quimioatrayente de monocitos 1 (en inglés, MCP-1), y factor de necrosis tumoral α (en inglés, TNF-α) del tejido adiposo e hígado.24 Por consiguiente, se confirma la hipótesis de que la fructosa dietética ejerce efectos inflamatorios adversos.
En un reciente metaanálisis relacionado con el efecto del consumo de azúcares en biomarcadores de procesos inflamatorios, se analizan 8 estudios destinados a la ingesta de fructosa, 3 al HFCS, 7 a la sacarosa y 6 a la glucosa, con un diseño variado de participantes en cuanto a sexo, edad, índice de masa corporal (IMC), entre otros aspectos.20 En vista de los resultados de los estudios revisados, en general hay una asociación positiva entre el nivel de ingesta de los azúcares y los parámetros de los procesos inflamatorios; por tanto, tampoco se sostiene la hipótesis de que la fructosa dietética libre o en sirope de maíz (HFCS) es mucho más perjudicial respecto a los procesos inflamatorios que la glucosa dietética o sacarosa.
Por otra parte, al observar los estudios de los efectos de la glucosa dietética en los procesos inflamatorios, hay evidencias para asociar el papel específico de la misma en los indicadores producto de glicación avanzada (PGA) y estrés oxidativo, lo cual también conduce a los incrementos en biomarcadores de la inflamación crónica.33,34 El elevado índice glicémico dietético (en inglés, GI) ha estado relacionado con el aumento de respuestas inflamatorias por medio de recurrentes respuestas hiperglucémicas en los inicios de la fase posprandial, así como también los niveles elevados de ácidos grasos libres a finales de la fase posprandial. Ambos se consideran resultantes de una sobreproducción de radicales libres y generación de citoquinas proinflamatorias, lo cual, a su vez, puede inducir la inflamación y el daño vascular.35
Una revisión científica realizada por un grupo de expertos de la Agencia Nacional de Seguridad Sanitaria de Alimentos, de Francia, concluye que no hay asociación entre la ingesta de azúcar y LDL colesterol o HDL. En contraste, sí hay una asociación entre la ingesta de azúcar y la concentración postprandial de triglicérido en sangre, siendo recomendada la dosis mínima estimada de fructosa diaria asociada a la hipertrigliceridemia en 50 g/día, correspondiente a 100 g/día de sacarosa.36
La patogénesis del síndrome metabólico es compleja e intervienen factores genéticos y ambientales. Los estudios destacan el papel de los factores ambientales y su influencia en la expresión del síndrome metabólico, principalmente el estilo de vida y un régimen de alimentación sano, considerando que el exceso de glúcidos es dañino por sus efectos inflamatorios, señalando particularmente la fructosa contenida en refrescos, comidas rápidas y jugos de frutas, la cual es mayormente responsable del alto predominio de la obesidad, la hipertensión y la enfermedad cardiaca en todo el mundo.37,38
Los hallazgos sugieren que la obesidad tiene un papel importante, ya que el tejido adiposo, sobre todo el visceral o abdominal, libera distintas sustancias que pueden favorecer la aparición de un estado proinflamatorio de resistencia a la insulina y de daño endotelial. Los ácidos grasos libres no esterificados que se generan, aumentan en el plasma y promueven el aumento de la gluconeogénesis, de la producción de triglicéridos, de sustancias con actividad protrombótica y la disminución de las lipoproteínas de alta densidad (HDL-colesterol).39,40
En una revisión relacionada con individuos mayores de edad, se confirmó que, en solo dos semanas de inactividad física, se produjeron incrementos en los parámetros proinflamatorios: TNF-α, IL6 y CRP.41 Como es conocido, los TNF-α e IL-6 (citoquinas con funciones endocrinas, autocrinas y paracrinas) y su expresión génica, son aumentados en los adipocitos, macrófagos y linfocitos de individuos obesos, mientras que la TNF-α actúa localmente en adipocitos y reduce sensibilidad de insulina por diferentes mecanismos, aumenta los niveles ácidos grasos libres, e inhibe liberación de la adiponectina; esta citoquina también atenúa la vasodilación mediada por óxido nítrico y está involucrada en la patología vascular de síndrome metabólico, aterosclerosis y enfermedad coronaria.
Los estudios destacan que la IL-6 crea resistencia de insulina en el hígado y eleva la síntesis hepática de proteínas de fase aguda, como la proteína C reactiva (CRP) y el fibrinógeno. La CRP aumenta dramáticamente en estados inflamatorios agudos asociados al síndrome metabólico, la diabetes mellitus y la enfermedad cerebrovascular, conduciendo a un estado protrombótico.42
Según las evidencias recientes, la inactividad física y el balance positivo del consumo de energía se puede reflejar en el síndrome metabólico y sus comorbilidades.43,44 El sedentarismo es muy común entre personas mayores, y, consecuentemente con el aumento de la obesidad, posee una asociación positiva con el riesgo de enfermedades crónicas relacionadas con el síndrome metabólico. Basado en los datos de recientes estudios, los individuos obesos están también siendo considerados de alto riesgo para complicaciones severas de covid-19, ya que en los mismos hay una condición sistémica proinflamatoria, la cual es exacerbada con la presencia de SARS-CoV-2, que se demuestra por la exagerada elevación de las citoquinas -síndrome denominado “tormenta de citoquinas”-, empeorando la evolución clínica del covid-19 hasta límites letales, según los reportes sistemáticos de las agencias de salud de todo el mundo.45-47
CONCLUSIONES
Se evidencia que los niveles elevados de metabolitos procedentes de la fructólisis y la glucólisis son factores peligrosos directos e indirectos, los cuales aumentan la producción de citoquinas inflamatorias, adiponectina, leptina y endotoxinas, causando inflamación crónica, disfunción endotelial y estrés oxidativo, y agravando el síndrome metabólico con disfunciones de tejidos y órganos. Al respecto, confirmamos que al tratar de reducir la condición inflamatoria de pacientes que padecen el síndrome metabólico, mediante modificaciones en el estilo de vida -evitando la alimentación hipercalórica de glucosa y fructosa y el sedentarismo, factores asociados a la obesidad-, estos presentarán un menor riesgo de complicaciones por enfermedades infecciosas -tal como la covid-19-, y que con un mayor factor de protección, se reducirá la gravedad asociada a los procesos inflamatorios inherentes. Estos conocimientos permitirían implementar acciones de salud pública orientadas a la prevención del desarrollo de las enfermedades crónicas no transmisibles asociadas al síndrome metabólico.