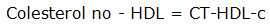INTRODUCCIÓN
Se ha planteado el uso del perfil lipídico, el valor de las lipoproteínas y los índices aterogénicos generados entre cada una de ellas, como una medida para evaluar el riesgo cardiovascular. Ha quedado demostrado que poseen capacidad predictiva de daño del endotelio y, por tanto, son de utilidad para el diagnóstico y pronóstico de la enfermedad cardiovascular.1,2
Otros autores sugieren que el índice TG/HDL-c podría utilizarse como un marcador secundario de insulinorresistencia, dada su aceptable sensibilidad y especificidad.1,3
Eugene Kennedy y colaboradores establecieron en 1950 el esquema general de la biosíntesis de fosfolípidos y su papel en la regulación del metabolismo de los lípidos.4 En esta vía, la colina se fosfatidilcolina (PC), siendo la enzima fosfocolina citidilil-transferasa el paso regulado y limitador de velocidad en la ruta.5 En este contexto, se sugiere que la dieta con aceite de soya altera la expresión de genes involucrados en la lipólisis del tejido adiposo, partiendo del efecto de ácidos grasos poliinsaturados,6 para modular la actividad de determinados microARN, con regulación positiva de los receptores activados por el proliferador de peroxisoma.7 Al respecto, varios metanálisis de ensayos controlados aleatorios y revisiones sistemáticas, han resultado contradictorios en sus resultados y recomendaciones para manejo de dislipemias.8
La lipoproteína lipasa (LPL) está regulada tanto a nivel transcripcional como postraduccional, y es condicionante de la aterogenicidad de las lipoproteínas circulantes, pero su función más significativa radica en la capacidad de unirse a lipoproteínas y componentes específicos de la superficie celular, participar en el metabolismo y transporte de las mismas, generando ácidos grasos libres y glicerol que se utilizan para el almacenamiento energético.9
También la proteína convertasa subtilisina kexina de tipo 9 (PCSK9) como diana terapéutica, es un regulador primordial de la cantidad de receptores de LDL (lipoproteínas de baja densidad), al aumentar su densidad y su reciclaje en los hepatocitos.10
Los productos naturales han contribuido históricamente al descubrimiento de fármacos como fuente de moléculas bioactivas y la química combinatoria, y conjuntamente con el desarrollo de las técnicas computacionales, han llevado al abordaje multidimensional del proceso.11 A partir de estos elementos, el presente trabajo estuvo dirigido a realizar una evaluación in vivo e in silico del efecto y el riesgo aterogénico de la lecitina de soya en ratas, a partir de parámetros e índices de aterogenicidad y estudio predictivo de acoplamiento molecular de sus constituyentes, con proteínas dianas.
MÉTODOS
Se realizó un estudio experimental de farmacología preclínica en el Laboratorio de Ciencias Básicas de la Universidad de Ciencias Médicas de Santiago de Cuba y de la Universidad de Oriente, durante el año 2022. Se utilizó la lecitina de soya, suministrada como materia prima por la Planta Procesadora de Soya a los Laboratorios Farmacéuticos Oriente, para la producción del suplemento nutricional registrado LECISAN®.12
Para el estudio se utilizaron 18 ratas Wistar de sexo femenino, peso 200 ± 70 gramos y 10 semanas, suministradas por el Centro de Producción de Animales de Laboratorio, pertenecientes a la categoría sanitaria convencional, con sus correspondientes certificados de calidad higiénico-sanitaria y genética.
En el diseño experimental, los animales fueron seleccionados al azar y se dividieron en tres grupos de seis ratas cada uno. Los grupos experimentales recibieron lecitina de soya por vía oral mediante cánula intragástrica 16 G durante 30 días, a dosis consideradas como máximas y mínimas, equivalentes a 600 (8,57 mg/kg) y 300 (4,29 mg/kg) miligramos/día12 en un humano de peso promedio 70 kg. El grupo control para comparación solo recibió la alimentación habitual y el mismo volumen de agua destilada en el momento de la administración.
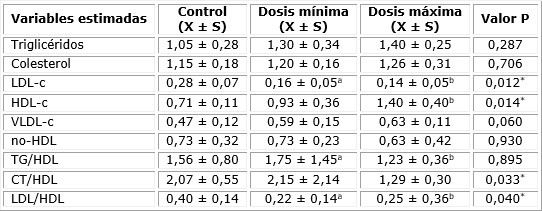
En cuanto a las técnicas y procedimientos para determinar el perfil lipídico e índices de riesgo de aterogenicidad, los parámetros seleccionados (colesterol, triglicéridos, LDL-c, HDL-c, VLDL-c) fueron procesados por el analizador de química sanguínea Hitachi® 902 del Hospital General Dr. Juan Bruno Zayas. La determinación de triglicéridos se realizó mediante el método enzimático colorimétrico (GPO-PAP) con muestras de suero (no ictérico ni hemolítico), y el colesterol por el método enzimático (CHOD-PAP). Según Dos Prazeres-Almeida et al.13 se utilizó la fracción del colesterol no-HDL como estimación del número total de partículas aterogénicas en el plasma (VLDL + VDL + LDL). El colesterol no-HDL se calculó por la resta:
Donde, CT: colesterol total; HDL-c: lipoproteínas de alta densidad.
Se determinaron los siguientes índices de aterogenicidad:2,3
Índice de Castelli I o relación colesterol total/lipoproteínas de alta densidad (CT/HDL-c).
Índice de Castelli II o relación lipoproteínas de baja densidad/lipoproteínas de alta densidad (LDL/HDL-c).
Relación triglicéridos/lipoproteínas de alta densidad (TG/HDL-c).
Coeficiente aterogénico (Índice de Castelli I /HDL-c).
Índice aterogénico: Logaritmo de la relación TG/HDL.
El estudio de acoplamiento molecular se llevó a cabo a través de los programas AutoDock 4.2 (http://autodock.scripps.edu), utilizando las capacidades de cómputo de alto rendimiento de la Universidad de Oriente (https://portal.uo.hpc.cu/website/). Los programas AutoDock Tools 1.5.6 (http://autodock.scripps.edu) y UCSF Chimera 1.16 (https://www.ch.cam.ac.uk/computing/software/ucsf-chimera) se emplearon para la preparación y ajuste del ligando y proteínas, preparación del centro grid y acoplamientos moleculares e identificar los residuos que podían interferir con sus centros activos. Para la representación y optimización de la estructura de la lisofosfatidilcolina (LPC) se empleó el software ChemDraw Professional 17.0 (https://perkinelmerinformatics.com/products/research/chemdraw).
Las estructuras de las proteínas fueron extraídas de la Protein Data Bank (PDB por sus siglas en inglés), obtenidas mediante cristalografía de rayos X,14 y se exportaron en el formato pdbqt.15 El Algoritmo Genético Lamarckiano (LGA) permitió explorar el mejor espacio conformacional para el ligando, con 100 corridas para cada uno de los acoplamientos.
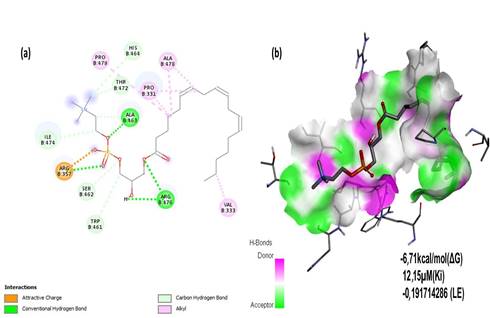
Las cifras de los parámetros de estabilidad y representaciones 2D-3D de las interacciones intermoleculares se generaron con el programa BIOVIA Discovery Studio Visualizer 20.1.0 (https://biovia-discovery-studio-2020-client.software.informer.com/20.1/). En la tabla 1 se muestran las coordenadas y tamaño de la caja enrejada (grid box) del sitio activo para las proteínas dianas.
Tabla 1 Configuración de la caja enrejada para el acoplamiento molecular
*Método de difracción de rayos X.
Como criterios de estabilidad de las interacciones intermoleculares se tomaron los parámetros: constante de disociación (Ki), cuyo valor más bajo indicó mayor afinidad y unión a su objetivo biológico; energía libre de Gibbs (ΔG), para la unión del complejo ligando-sitio activo, cuyos valores más negativos indican mayores energías de unión;16 y eficiencia del ligando (efficiency ligand, LE por sus siglas en inglés), según los valores definidos por Hopkins et al. (LE ≤ -0,2 malos; LE > -0,3 buenos y, LE > -0,4 excelentes).17 La interpretación de estos parámetros se basó en la relación entre las magnitudes químico-físicas y la fortaleza de interacción del complejo enzima-sustrato.18
Los registros en base de datos permitieron el procesamiento estadístico-matemático de los resultados con el sistema SS versión 23.0 (SPSS, Inc., Philadelphia). Se establecieron diferencias entre los grupos de estudio mediante ANOVA de Kruskal-Wallis para muestras independientes y test de Dunn (post hoc). El coeficiente de correlación de Pearson (r) permitió determinar la relación estadística entre variables, tomando un rango de valores de +1 a -1. Se consideró el nivel de significación menor del 5 % en todas los test.
Todos los protocolos en el estudio estuvieron sometidos a la consideración, análisis y aprobación de la comisión de ética en el ámbito institucional. Este trabajo forma parte del proyecto Efectos nutricionales, farmacología y toxicología preclínica del LECISAN®, que tiene el propósito de aportar elementos que avalen el producto, registrado actualmente como suplemento nutricional.
RESULTADOS
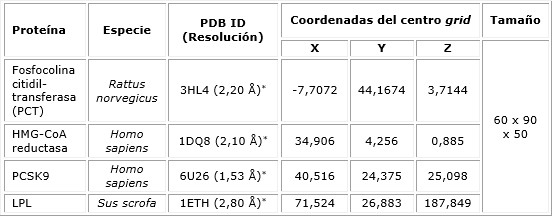
El efecto de la administración de lecitina de soya sobre los lípidos séricos se muestra en la tabla 2. Respecto al control, en el grupo que recibió dosis mínima solo fue significativo el valor de las LDL-c; en el grupo suplementado la dosis máxima, las LDL-c y HDL-c, y los índices TG/HDL y LDL/HDL resultaron significativos en ambos grupos. De manera general, la comparación entre grupos resultó significativa para los índices CT/HDL, LDL/HDL y los parámetros LDL-c y HDL-c.
Tabla 2 Efectos de la lecitina de soya sobre los lípidos séricos, según grupos del estudio experimental
* p < 0,05, prueba ANOVA de Kruskal-Wallis; letras distintas identifican diferencias en las comparaciones entre grupos, test de Dunn.
El análisis del perfil lipídico, del riesgo global y de los índices de riesgo evidencia, aunque incrementan de TG y CT con el aumento de la dosis, el riesgo global parece bajo por el aumento del HDL-c, lo que resulta beneficioso. Esto se confirma al observar la tendencia hacia la reducción de los índices de aterogenicidad, aspecto que puede estar relacionado con la composición del producto. (Fig. 1)
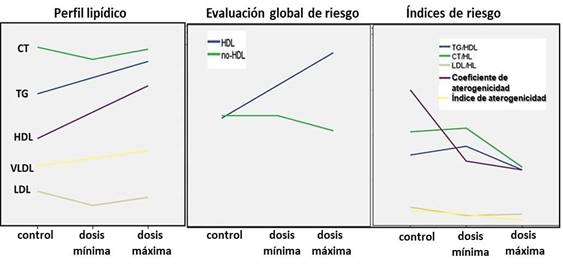
Fig. 1 Tendencia del riesgo de aterogenicidad, a partir de los parámetros del perfil lipídico e índices estimados.
La tabla 3 muestra correlaciones entre el índice de Castelli I, como variable dependiente, y los parámetros del perfil lipídico y otros índices de aterogenicidad estudiados, según grupos del estudio experimental. En el grupo suplementado con dosis mínima mostró una relación inversa muy alta con HDL y directa con no-HDL y el índice LDL/HDL. En el grupo suplementado con dosis máxima, la significación estadística se evidenció de manera positiva con LDL y de igual manera con el índice LDL/HDL.
Tabla 3 Correlación entre el índice de Castelli I y los parámetros del perfil lipídico, según grupos del estudio experimental
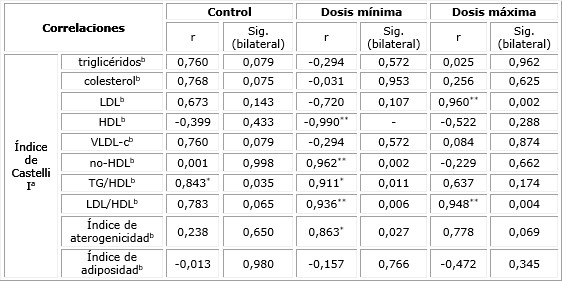
r: coeficiente de correlación; a: variable dependiente; b: variable predictora; * La correlación es significativa al nivel 0,05 (bilateral); ** La correlación es significativa al nivel 0,01 (bilateral).
La tabla 4 muestra correlaciones entre el índice de Castelli II y los parámetros del perfil lipídico y los índices estudiados. Se observaron correlaciones positivas altas y muy significativas con los índices en ambos grupos experimentales. Para HDL y LDL las correlaciones mostraron un comportamiento similar al que se obtuvo para el índice Castelli I, de manera adicional se evidenció una correlación muy alta y significativa con el colesterol no-HDL en el grupo que recibió dosis mínima.
Tabla 4 Correlación entre el índice de Castelli II y los parámetros del perfil lipídico, según grupos del estudio experimental
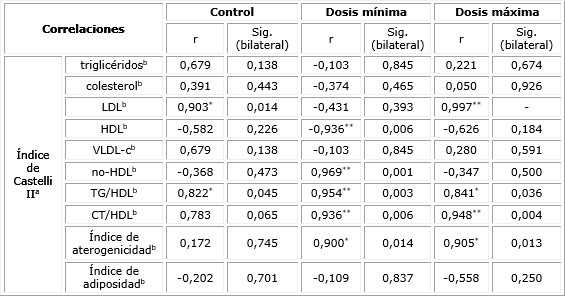
r: coeficiente de correlación; a: variable dependiente; b: variable predictora; * La correlación es significativa al nivel 0,05 (bilateral); ** La correlación es significativa al nivel 0,01 (bilateral).
En la tabla 5 se exponen las correlaciones entre el índice de aterogenicidad, como variable dependiente y los parámetros del perfil lipídico, así como su relación con los otros índices estudiados como variables predictoras. Se observaron relaciones similares a los mostradas con los índices analizados en las tablas 3 y 4, excepto para el índice CT/HDL que no mostró significación estadística en su relación con el índice de aterogenicidad en el grupo suplementado con dosis máxima.
Tabla 5 Correlación entre el índice de aterogenicidad y los parámetros del perfil lipídico, según grupos del estudio experimental
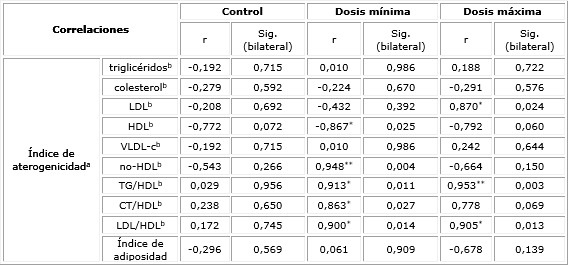
r: coeficiente de correlación; a: variable dependiente; b: variable predictora; * La correlación es significativa al nivel 0,05 (bilateral); ** La correlación es significativa al nivel 0,01 (bilateral).
En el acoplamiento molecular, la enzima PCT mostró valores que indican fortaleza de unión a la proteína (figura 2). Esto podría estar basado en la existencia de cinco interacciones por puentes de hidrógeno, cuatro enlaces C-H y cuatro enlaces covalentes débiles (uno de ellos π-sigma), que se encuentran cerca del sitio activo. Se destaca la presencia de algunos residuos de aminoácidos, tales como Tyr-173, Arg-193, His-168, His-92, ILe-84410 y Lys-122, con una interacción catión-π que juega un rol importante en el reconocimiento molecular (figura 2). El estudio de la estructura de PCT con un fragmento soluble (CCT236) que contiene los dominios N-terminal y catalítico (dominios N y C), mostró en el dominio catalítico residuos His-168 y Tyr-173 del sitio activo dentro de un área altamente conservada. La predicción in silico mostró unión de la LPC con estos dos residuos mediante puentes de hidrógeno.
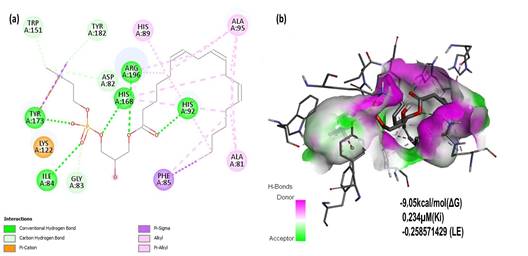
Fig. 2 Cavidad del sitio activo de la enzima PCT (PDB: 3HL4) en complejo con LPC. Interacciones 2D (a) y 3D (b) del complejo
El análisis de las interacciones entre el complejo LPL/LPC mostró puentes salinos con interacciones de cargas electrostáticas y uniones C-H, con los residuos Glu-371, Arg-65 y Lys-42. Con este último, establece además una unión mediante puente de hidrógeno. Muestra también otras tres interacciones mediante uniones alquil (Arg-368, Tyr-370 y Phe 387). (Fig. 3)
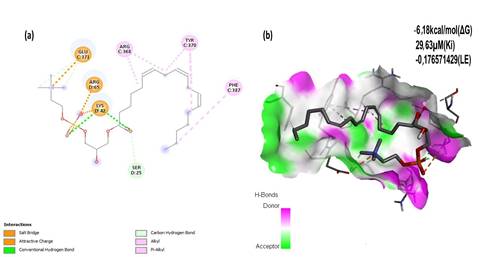
Fig. 3 Cavidad del sitio activo de LPL (PDB: 1ETH) en complejo con LPC. Interacciones 2D (a) y 3D (b) del complejo.
La figura 4 refleja las interacciones del complejo PCSK9/LPC. Se muestra una interacción mediante cargas electrostáticas y tres por puente de hidrógeno con el residuo Arg-357, Arg-475 y Ala-466, seis uniones C-H (Ile-474, Ser-462, His-464, Pro-331, Trp-461 y Thr-472) y cuatro uniones amino alquil (Pro-479, Pro-331, Ala-478 y Val-333).
DISCUSIÓN
Los investigadores que registraron el producto suponen que los fosfolípidos más comunes en esta mezcla son fosfatidilcolina (PC), fosfatidiletanolamina (PE), fosfatidilinositol (PI) y fosfatidilserina (PS).12 Tomando esto en consideración, es de suponer que sus efectos se deban a estos constituyentes. Teóricamente, la lecitina tiene capacidad emulgente, forma lipoproteínas de transporte de grasas y reduce el colesterol en sangre.19
El uso de los valores del perfil lipídico solo aporta una información cuantitativa, sin brindar el balance existente entre las lipoproteínas aterogénicas y antiaterogénicas.2,3 En ratas Wistar macho, los efectos de una dieta rica en grasas saturadas mostró elevados niveles sanguíneos de lípidos; sin embargo, mejoró las señales de desequilibrio metabólico,20 aspecto coincidente con los hallazgos aquí presentados, y que puede generar cuestionamientos acerca de la eficacia de la lecitina de soya.
Aunque la lecitina de soya no posee colesterol en su formulación, el incremento de este podría estar relacionado con el hecho de que niveles elevados de TG administrados de forma exógena, pueden inducir la síntesis de lipoproteínas en el hígado. 21 Lo antes descrito puede dar explicación a lo observado, y sugiere que las HDL-c participan en el catabolismo de la lecitina de soya.
Los índices aterogénicos son indicadores bioquímicos relacionados con la adiposidad corporal y con el desarrollo de enfermedades cardiometabólicas. 3 Un estudio publicado en 2018, sugiere su uso en la hipercolesterolemia, al reducir la absorción intestinal de grasas por el aumento de ácidos grasos biliares formados a partir de los fosfolípidos que contiene, pero que, al mismo tiempo, pudiera estimular la síntesis de ácidos grasos, ocasionando elevados niveles de colesterol.21
Para Díaz-Ortega et al.,2 el índice de TG/HDL es el indicador con mejor predicción del síndrome metabólico. Los hallazgos de Zhao et al.,22 documentaron asociaciones directas entre el índice de Castelli II y la presencia de placa ateromatosa en la carótida. Sin embargo, Dreier et al.,23 plantean que interacciones con la señalización basada en datos transcriptómicos producen cambios en la biosíntesis y el metabolismo lipídico, lo que destaca la necesidad de investigaciones en este campo.
La actividad de la enzima PCT contribuye a la homeostasis y síntesis de PC intestinal de novo, y la absorción de lípidos en la dieta durante una alimentación rica en grasas.24 Un estudio para evaluar la actividad biológica de un aceite esencial mediante docking (molecular) con potencial inhibición de la LPL mostró valores ΔG entre -6,2 a -9,8 kcal/mol de sus principios activos. El enlace de hidrógeno con Ser-153 es una interacción clave, ya que este residuo, junto con Asp-177 e His-264, constituye la tríada catalítica del sitio activo de LPL, aunque no existió correspondencia en los sitos por donde presentó interacciones el sustrato con la enzima. En su conformación activa, las lipasas tienen una tríada catalítica altamente conservada que comprende el Ser como nucleófilo,24 que coinciden con la predicción de este estudio.
Diversas investigaciones señalan que en el dominio catalítico de la PCSK9 se encuentran los residuos Asp-360 y Arg-357, estando Arg-458 en el dominio C-terminal.13 En este sentido, se muestra una coincidencia con los resultados de este trabajo, a través de la interacción mediante cargas atractivas y por puente de hidrógeno con el residuo Arg-357.
Los autores concluyeron que el estudio de predicción in silico con la enzima 3-hidroxi-3-metilglutaril-coenzima A reductasa (HMG-CoA) como paso limitante en la síntesis de colesterol endógeno, no resultó promisorio. En este contexto, los datos preclínicos presentados aquí ofrecen resultados alentadores en cuanto al impacto de las dosis nutricionales de LECISAN® en los parámetros analizados.
Se concluye que la administración oral del suplemento redujo los índices de aterogenicidad, asociado a un incremento de los niveles de lípidos séricos, según aumentó la dosis. El estudio predictivo reveló potencialidades de la LPC como posible inhibidor de la enzima LPL.