Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Cubana de Anestesiología y Reanimación
versión On-line ISSN 1726-6718
Rev cuba anestesiol reanim vol.15 no.3 Ciudad de la Habana sept.-dic. 2016
Rev Cubana de Anestesiología y Reanimación. 2016;15(3)
ARTÍCULO ORIGINAL
Eficacia analgésica y seguridad de dosis única de morfina intratecal
Analgesic effectiveness and safety of single-dose intrathecal morphine
Yasel Gonzalez Brizuela, Katia Velázquez González, Teddy Osmin Tamargo Barbeito
Hospital Clínico Quirúrgico Hermanos Ameijeiras. La Habana, Cuba.
RESUMEN
Introducción: el dolor posoperatorio del hemiabdomen superior es intenso y su control es imprescindible para evitar complicaciones.
Objetivos: evaluar la eficacia analgésica y seguridad de dosis única de morfina intratecal en el posoperatorio de la cirugía de hemiabdomen superior de gran envergadura.
Método: ensayo clínico aleatorizado a simple ciegas en 40 pacientes, tras intervenciones de hemiabdomen superior. Se emplearon dosis única de morfina intratecal (MIT) de 1 o 2 µg/kg de peso del paciente de acuerdo al grupo de tratamiento. Análisis estadístico con las pruebas Chi cuadrado (c2), exacta de Fisher, análisis de varianza univariado, la prueba de W de Mauchly y la prueba F univariada; nivel de significación de 0,05.
Resultados: la administración de opioides durante el acto quirúrgico fue similar en ambos grupos (3,1 ± 2,2 mL vs 4,1 ± 2,7 mL). En el grupo de dosis de 2 µg/kg de peso de MIT a las 12 y 24 h los pacientes no refirieron dolor; existieron diferencias entre los tratamientos en cuanto al alivio del dolor (p< 0,001) y también entre los momentos en que se midió el mismo (p= 0,001). Se utilizó analgesia de rescate en 25 % de los pacientes. Sólo se presentó como complicación la depresión respiratoria.
Conclusiones: la dosis única de 2 μg /kg de morfina intratecal es un método eficaz para la analgesia posoperatoria en la cirugía de hemiabdomen superior, la incidencia de complicaciones fue baja y se demostró que ambas dosis son seguras.
Palabras clave: morfina intratecal; dolor posoperatorio.
ABSTRACT
Introduction: The superior hemiabdomen postoperative pain is severe and essential to be managed in order to avoid complications.
Objectives: To assess the analgesic effectiveness and safety of single-dose intrathecal morphine in the postoperative period of the upper hemiabdomen major surgery.
Method: Single-blind randomized clinical trial in 40 patients, after upper hemiabdomen interventions. We used single doses of intrathecal morphine (ITM) of 1 or 2 mg/kg per patient weight according to the treatment group. The statistical analysis used the Chi-square test, Fisher's exact test, univariate analysis of variance, Mauchly's test and Univariate F-test; the significance level was 0.05.
Results: Opioids administration during surgery was similar in both groups (3.1 ± 2.2 mL vs 4.1 ± 2.7 mL). In the 2 mg/kg of ITM dose group, the patients reported no pain after 12 and 14 hours; there were differences between treatments regarding pain relief (p< 0.001) and also between the time when it was measured (p= 0.001). Rescue analgesia was used in 25 % of the patients. Respiratory depression was the only onset complication.
Conclusions: ITM at a single dose of 2 μg/kg is an effective method for postoperative analgesia in upper hemiabdomen surgery, the incidence of complications was low and both doses proved safe.
Key words: intrathecal morphine; postoperative pain.
INTRODUCCIÓN
Numerosas son las alternativas terapéuticas para el adecuado control del dolor posoperatorio intenso. Este es el que acompaña a las intervenciones quirúrgicas del tórax, hemiabdomen superior y la columna vertebral.1
La relación que existe entre el dolor y la presentación de complicaciones está bien documentada. El dolor provoca parálisis diafragmática, en las intervenciones de abdomen superior o tórax, disminuye hasta 50 % la capacidad vital y ocasiona atelectasias e infecciones respiratorias en 65 %; aumentan los tiempos de asistencia ventilatoria y la estadía en las unidades de recuperación posanestésica.2-4 Según la medicina basada en la evidencia, el adecuado tratamiento del dolor, logra disminuir la morbilidad posoperatoria (nivel de evidencia 2a) y por tanto constituye una recomendación B.5
Los diferentes protocolos y guías prácticas de actuación coinciden en considerar como alternativas los bloqueos regionales con anestésicos locales y opioides vs opioides parenterales mediante técnicas de infusión continua. Ambas se sustentan con una evidencia científica Ia y se consideran recomendación A para el tratamiento del dolor intenso.6,7 El primero en utilizarlos fue Wang en 1979, en pacientes con tumores genitourinarios. En 1984, la FDA aprobó la utilización de morfina por vía neuroaxial (NA) con fines analgésicos. Sin embargo, actualmente, existen más de 2000 referencias de la administración intratecal de fármacos opioides.8
Se les atribuye la propiedad de garantizar la analgesia posoperatoria ante el dolor intenso, que en el caso de la morfina puede llegar a ser de aproximadamente 24 h, tras inyección única.9 Además de disminuir la intensidad del dolor de manera prolongada, disminuye la necesidad de analgesia de rescate y el consumo de opioides.10-12
Es por ello que las guías de prácticas clínicas basadas en la evidencia (GPC) la ubican como alternativa a la analgesia epidural continua para analgesia posoperatoria, por la eficacia en cuanto a alivio del dolor en reposo y dinámico, aunque con mayor incidencia de complicaciones.13
Sin embargo, la acción supra-espinal y central que funciona como aditiva a los efectos espinales directos para la analgesia eficaz y prolongada es también la causante de las principales complicaciones atribuibles y temidas de los opioides, sobre todo la depresión respiratoria (DR). Se reconoció que el complejo preBötzinger localizado en la médula tiene una participación fundamental en la DR vinculada con el uso de opioides. Las neuronas de dicho complejo expresan receptores para la neuroquinina 1 que son bloqueados en forma selectiva por los agentes opiáceos.14
Estas complicaciones son dosis dependientes y más frecuentes en pacientes con factores de riesgo. No está bien explicada la variabilidad individual de respuestas a diferentes dosis de morfina intratecal. Existe una superposición de efectos espinales y supraespinales dependientes de la dosis, de los factores de riesgo del paciente, la tolerancia a los efectos de los opioides, la relación del sitio de punción y de la incisión quirúrgica, del volumen y la dilución de la morfina y otros no bien esclarecidos en la literatura.8,15
La analgesia que provee la morfina intratecal es efectiva y prolongada. A pesar de ello la probabilidad de que aparezcan sus efectos colaterales limitan su uso seguro. Varios estudios tienen el objetivo de encontrar la mejor dosis de morfina intratecal. Ello consiste en determinar la menor dosis suficiente para garantizar la analgesia con el menor número de eventos adversos.
Es por ello que consideramos interesante realizar un estudio que compare diferentes dosis de morfina para administración intratecal según el peso del paciente. Además de identificar las complicaciones atribuibles a esta técnica.
Constituye el objetivo de esta investigación, evaluar la eficacia analgésica y seguridad de dosis única de morfina intratecal en el posoperatorio de la cirugía de hemiabdomen superior de gran envergadura, así como la calidad de la analgesia conseguida con dosis única de morfina de 1 µg/kg o 2 µg/kg administradas intratecal e identificar si existe relación entre la frecuencia de complicaciones y el tipo de dosis de morfina intratecal utilizada.
MÉTODOS
Se realizó un ensayo clínico aleatorizado a ciegas con el propósito de evaluar la eficacia analgésica y seguridad de la administración de morfina intratecal (MIT) en la analgesia posoperatoria tras las intervenciones de gran envergadura de hemiabdomen superior, en el Hospital Hermanos Ameijeiras, en el periodo de abril de 2013 hasta abril de 2014.
Universo: conformado por los pacientes intervenidos de hemiabdomen superior: intervenciones hepáticas, gástrica, pancreática y de vías biliares.
Criterios de selección
Criterios de inclusión: pacientes con estado físico I-III según la Sociedad americana de anestesiólogos (ASA). Menores de 65 años y programados para cirugía electiva sin contraindicaciones para la técnica regional.
Criterios de exclusión: pacientes que se negaron a recibir anestesia regional. Anafilaxia a los opioides.
Criterios de salida: falla de la técnica neuroaxial.
Se solicitó el consentimiento de participación de forma libre e informada, documento que firmaron y que garantiza confidencialidad y anonimato.
Muestra: quedó conformada por dos grupos de tratamiento de 20 pacientes cada uno, los cuales fueron intervenidos quirúrgicamente por cirugía de hemiabdomen superior de gran envergadura, según los criterios antes expuestos, en el periodo 2013- 2014.
Los pacientes fueron divididos aleatoriamente:
Grupos de tratamiento
Grupo I (n= 20): recibió morfina intratecal a 1 µg/kg de peso del paciente.
Grupo II (n= 20): recibió morfina intratecal a 2 µg/kg de peso del paciente.
Operacionalización de las variables
Técnicas anestésicas: la conducción de la anestesia se realizó de la siguiente forma:
- se le canalizó vena periférica e hidratación electrolítica 10 mL/kg de peso del paciente. Medicación pre-anestésica con midazolam a razón de 0,1 mg/kg de peso del paciente intravenoso.
- se realizó monitorización no invasiva de rutina. Se inició la inducción de la anestesia general orotraqueal balanceada, luego se procedió al traslado a la unidad de cuidados posanestésicos, donde se evaluaron las variables principales y de complicaciones posoperatorias.
- se pautó como medida farmacológica para la analgesia posoperatoria, el empleo de dipirona. Como analgésicos de rescate se prescribieron: tramadol y/o diclofenaco sódico.
Técnica subaracnoidea: se realizó asepsia y antisepsia de la piel con hibithane alcohólico. Se infiltró lidocaína al 1 % en piel y tejido celular subcutáneo en espacio intervertebral seleccionado entre L1-L5. Se introdujo trocar No. 22-25 G hasta espacio subaracnoideo, el cual fue identificado por la salida del LCR. Se administró la morfina calculada según grupo de tratamiento en un minuto.
Análisis estadístico: para la conformación de los grupos se determinó el tamaño de la muestra por la expresión:
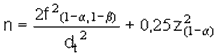
En donde:
f2 (1-a, 1-ß)= [z (1-a) + z (1-ß)]2.
z (1-a)= fue el valor de la desviación normalizada correspondiente al riesgo alfa= 1,96
z (1-ß)= fue el valor de la desviación normalizada correspondiente al riesgo beta= 1,28dt= d/S
donde:
S= Desviación típica poblacional= 1,0,
d= (x1 - x2).Diferencia relevante= 2-1.
X1= Estimado de la media que se obtuvo en el grupo experimental I= 2,
X2= Estimado de la media que se obtuvo en el grupo experimental II= 1.dt es la diferencia estandarizada.
(Tomó en consideración la magnitud de la diferencia relevante en relación a la desviación típica de la respuesta S).
El número de sujetos a reclutar al comienzo del ensayo, según un 10 % de pérdidas concebidas estuvo dado por la siguiente expresión:
![]()
En donde:
Este valor n' garantizó n sujetos evaluables estadísticamente.
Finalmente el tamaño de muestra calculado fue de 22 para reclutar 25, pero sólo se pudieron incluir en el ensayo 20 pacientes por grupo.
La asignación aleatoria a cada tratamiento se realizó mediante Epidat 3. Una vez que estuvo el resultado se tomaron sobres opacos, los cuales tenían la identificación del número del paciente y el tratamiento correspondiente. Estos sobres sellados se guardaron en la secretaría del salón. De acuerdo al orden de llegada y según los criterios de inclusión y exclusión, se procedió a la apertura del sobre y se informó el tratamiento al anestesiólogo actuante. Los resultados se recogieron por el autor en el posoperatorio.
Se determinaron para las variables cualitativas las frecuencias absolutas y relativas expresadas en porcentajes y para las variables cuantitativas se calcularon las medias y desviación estándar.
En el caso de las variables cualitativas para la comparación se utilizó la prueba Chi cuadrado (c2). Cuando existieron 25 % o más de frecuencias esperadas menores que 5, se utilizó la prueba exacta de Fisher.
Para evaluar si existía relación entre el alivio del dolor y el tipo de tratamiento en los diferentes momentos (tiempo) se utilizó el análisis de varianza univariado. Se decidió utilizar la prueba F univariada. Se determinó si existió efecto del tiempo, del tratamiento, pero no de la interacción entre estos dos factores. En todas las pruebas de hipótesis se fijó un nivel de significación de 0,05.
Criterios bioéticos: se respetaron los principios de beneficencia, no maleficencia y autonomía y no se realizó ninguna intervención fuera del procedimiento establecido.
RESULTADOS
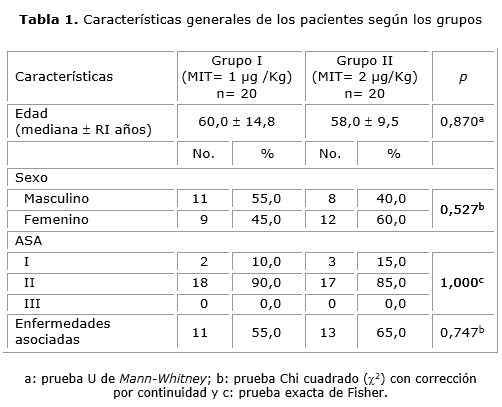
La investigación que se presenta reclutó a 20 pacientes por cada grupo de tratamiento. No se encontraron diferencias estadísticamente significativas (p< 0,05) entre los dos grupos de tratamiento en cuanto al conjunto de variables basales. Las características generales de los pacientes, según los grupos, se muestran en la tabla 1.
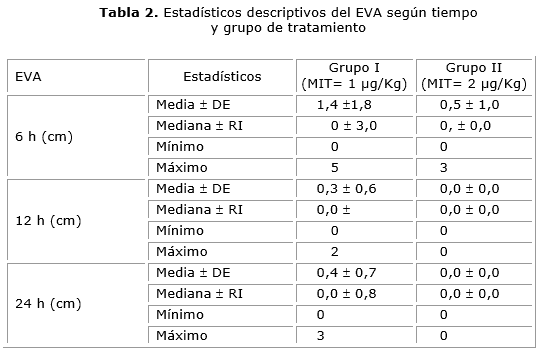
La administración de opioides durante el acto quirúrgico fue similar en ambos grupos de tratamiento (3,1 ± 2,2 mL vs 4,1 ± 2,7 mL), no existieron diferencias estadísticamente significativas (p= 0,201) (tabla 2).
La comparación de las medias del EVA entre los grupos de tratamiento según los diferentes momentos, al no existir interacción entre el grupo de tratamiento y el tiempo (p= 0,159), se pudo demostrar que hay un efecto del tratamiento y del tiempo. Lo anterior significa que existieron diferencias entre los dos tratamientos en cuanto al alivio del dolor (p< 0,001) y también entre los diferentes momentos en que se midió el mismo (p= 0,001). En el grupo de la dosis de 2 microgramos a las 12 y 24 h los pacientes no refirieron dolor (tabla 2 y 3).
Se utilizó analgesia de rescate en 25 % de los pacientes incluidos, y en ambos grupos las diferencias no resultaron significativas (p= 0,068).
En el posoperatorio inmediato se presentó como complicación sólo la depresión respiratoria. La mayoría ocurrió en el grupo II mientras que en el grupo I fue menor, sin ser las diferencias significativas (p= 0,127).
DISCUSIÓN
El grupo de pacientes estudiados componen una muestra homogénea por existir características similares en cuanto a edad, sexo, estado físico y enfermedades asociadas. Este hecho reviste importancia en lo referente a la influencia que tienen la edad y el sexo en la percepción del dolor. De igual forma las variables mencionadas modifican la presencia de complicaciones asociadas al uso de opioides neuroaxiales y constituyen factores de riesgo de depresión respiratoria en el posoperatorio.
La relación entre el sexo y el dolor es controvertida. Algunos autores, no encuentran relación entre el sexo y el alivio del dolor experimentado por los pacientes tras la intervención. En estudio multicéntrico,16 se concluyó que las mujeres refieren dolor de mayor intensidad que los hombres. Del mismo modo ocurre con la edad, Gagliese,25 en estudio que incluyó 246 pacientes intervenidos quirúrgicamente, comprendidos entre 18 a 82 años, informó mayor incidencia de dolor en pacientes ancianas y los más jóvenes consumieron más analgésicos para el alivio del dolor. En una revisión sistemática18 de 48 estudios, que incluyó 23 037 pacientes, identificaron la edad, el dolor preoperatorio, la ansiedad y el tipo de proceder quirúrgico como cuatro predictores de significación para la presencia de dolor posoperatorio. Al ser ésta muestra homogénea esto no fue comparable. Sin embargo, sí es necesario explicar la creencia que en las edades extremas de la vida el dolor no es percibido con igual intensidad, a pesar de los estudios que indican que a partir de las 29 semanas de gestación, las vías corticales y subcorticales involucradas en la percepción están desarrolladas para las sensaciones dolorosas.19
Están identificados algunos factores de riesgo de depresión respiratoria como la edad avanzada, el uso concomitante de otros fármacos depresores por vía parenteral (opioides o benzodiacepinas), enfermedades sistémicas como la obesidad, diabetes mellitus o el síndrome de apnea obstructiva del sueño, entre otros.20 En 2009, la Sociedad Americana de Anestesiólogos publicó pautas específicas para la prevención, la detección y el tratamiento de la depresión respiratoria asociada con la administración de opioides por vía neuroaxial.21Es discutible la relación entre la administración de morfina intratecal y el consumo de opioides intravenosos en el intraoperatorio. Un metaanálisis de nueve ensayos que incluyó 422 pacientes, concluyó que el uso de morfina intratecal disminuye los requerimientos de opioides intravenosos. Ello puede estar sustentado en la influencia de esta estrategia anestésica en los niveles de norepinefrina y adrenalina perioperatorios. Sin embargo, la evidencia científica no es concluyente pues en otros estudios no se llegaron a iguales resultados.15
De modo que el consumo de opioides intraoperatorio se basa en gran medida en elementos subjetivos. Según los resultados en esta serie, no existieron diferencias en el consumo intraoperatorio de opioides para uno y otro grupo.
Es indiscutible, la eficacia de la morfina subaracnoidea en la analgesia posoperatoria incluso tras intervenciones que causan dolor intenso. Resulta técnicamente más sencilla que la epidural, garantiza el alivio del dolor por más de 24 h después de una punción única y logra la analgesia con escasos efectos colaterales.22
En un metaanálisis13 que incluyó 77 ensayos clínicos y 1205 pacientes en los que se emplearon dosis de 100 - 4000 μg de MIT, concluyó que todas ellas lograron el control adecuado del dolor que se expresó por reducción de las puntuaciones del EVA de 1,9 a 0,8 cm a las 4 h, 0,8 a 0,1 cm a las 12 h y de 1,0 a 0,4 cm a las 24 h; sin embargo, con incrementos del riesgo de depresión respiratoria y prurito en comparación con el grupo control.
En un ensayo clínico12 que incluyó 60 pacientes, se comparó la administración intratecal de 0,3 mg de morfina vs placebo en relación con el alivio del dolor, consumo de otros opioides de rescate y satisfacción y se encontró mejor resultado con la primera.
Sin embargo, la mejor dosis eficaz en el alivio del dolor muestra resultados variables en la literatura científica. En un estudio de revisión,23 se enumeraron varios ensayos clínicos que concluyeron que la administración intratecal de 0,1 y 0,2 mg se asoció con el mismo efecto analgésico; en cambio, el uso de 0,05 mg fue menos eficaz. La frecuencia de efectos adversos fue mayor entre las pacientes que recibieron 0,2 mg. Se comprobó una importante variabilidad en la respuesta analgésica de un enfermo a otro.
Otro ensayo clínico24 en los que se utilizaron dosis de 25 y 50 μg de morfina mostró resultados semejantes en cuanto a alivio del dolor con menos incidencia de prurito en el primer grupo. Hallazgos similares se obtuvieron en otro ensayo clínico25 con 70 pacientes en los que se comparó 75 y 150 μg de MIT. En ambos grupos, se consiguieron bajos niveles de intensidad del dolor y número de complicaciones; sin embargo, con mayores requerimientos de analgesia de rescate en el grupo de dosis inferiores de MIT.
Un estudio26 similar que incluyó 130 gestantes con dosis de 50 y 100 μg de MIT, se encontraron niveles de intensidad dolorosa bajos con iguales requerimientos de analgesia de rescate, pero mayor incidencia de prurito con la dosis superior.
Gheling27 con dos grupos de 60 pacientes cada uno, tuvo que administrar menos opioides de rescate en las siguientes 24 h con la dosis de 0,2 mg, aunque con mayor frecuencia de prurito.
Otro ensayo clínico11 con 42 pacientes en los que se comparó la analgesia con morfina intratecal y la anestesia general, se demostró que en ambos grupos ocurrió reducción de la capacidad vital posoperatoria (3,24 L a 1,38 L en el grupo control; 2,72 L a 1,18 L en el grupo de la morfina), así como en otras variables espirométricas, aunque sin diferencias significativas. Sin embargo, la intensidad del dolor fue menor en el grupo de la morfina intratecal.
Un metaanálisis que incluyó más de 1200 pacientes, realizado por Gehling y Tryba28 concluyó que dosis menores de 0,3 mg de morfina intratecal no produjo incremento significativo de complicaciones cuando se comparó con placebo, pero si las dosis son mayores, estas se incrementan, sobre todo la depresión respiratoria que de 1 % en el grupo de menos de 0,3 mg se elevó a 9 % para dosis mayores de 0,3 mg. En otro,10 que incluyó 60 pacientes, se administró 0,3 mg de morfina intratecal vs placebo y no se encontraron diferencias significativas en cuanto a los efectos colaterales.
Los resultados de esta investigación, muestran que la dosis de 2 μg/kg de MIT logró niveles de alivio del dolor adecuados con EVA de cero a las 12 y 24 h al compararla con la dosis de 1 μg/kg, con menor consumo de analgésicos de rescate durante las primeras 24 h. En dicho grupo de tratamiento se apreció una insignificante incidencia de depresión respiratoria.
De cualquier modo, el dolor es un fenómeno tan complejo, que es difícil imaginar que un solo analgésico pueda eliminar completamente el dolor posoperatorio, de hecho no existen evidencias en la literatura que un método o analgésico único logren el control completo del dolor. El efecto aditivo o sinérgico que se logra es claramente demostrable para la asociación AINE-opioide. En la analgesia balanceada se combinan AINEs, que alteran la transducción, anestésicos locales que afectan la transmisión y narcóticos que afectan la modulación del dolor.29,30 Diferentes estudios demuestran que al utilizar combinaciones de analgésicos con mecanismos de acción diferentes y por diferentes vías de administración se incrementa la calidad de la analgesia con dosis menores y disminuye el consumo de opioides potentes. Tal es el caso de investigaciones31,32 que incluyeron a más de 2500 pacientes. Anestésicos locales y opioides neuroaxiales logran disminuir las complicaciones posoperatorias y los tiempos de intubación y estadía en recuperación.33-35 Las Guías de Prácticas Clínicas basadas en la evidencia recomiendan la analgesia multimodal o balanceada como estrategia de tratamiento del dolor posoperatorio.6,7
Se concluye que la dosis única de 2 μg/kg de morfina intratecal es un método eficaz para la analgesia posoperatoria en la cirugía de hemiabdomen superior. La incidencia de complicaciones fue baja y se demostró que ambas dosis son seguras.
REFERENCIAS BIBLIOGRÁFICAS
1. Neugebauer E, Schug S. Procedure specific postoperative pain management. [Internet]. [Citado en mayo de 2010]. Disponible en: http://journals.lww.com/ejanaesthesiology/fulltext/2006/06001/procedure_specific_postoperative_pain_management.20.aspx
2. Block B, Liu S, Rowlingson A, Cowan A, Cowan Jr J, et al. Efficacy of postoperative epidural analgesia: A meta-analysis. JAMA 2003;290:2455-63.
3. Joshi GP, Bonnet F, Shah R, Wilkinson R, Camu F, Fischer B, et al. A systematic review of randomized trials evaluating regional techniques for postthoracotomy analgesia. Anesth Analg. 2008;107:1026-40.
4. Martínez-Vázquez J, Torres LM. Prevalencia del dolor posoperatorio. Repercusiones fisiopatológicas. Rev Soc Esp Dolor. 2007;7:465-76.
5. Bader P, Echtle D, Fonteyne V, Livadas K, De Meerleer G, Paez Borda A, et al. Post-operative pain management. In: Guidelines on pain management. Arnhem. The Netherlands: European Association of Urology. (EAU); 2010;35:61-82.
6. Practice guidelines for acute pain management in the perioperative setting: a report by the American Society of Anaesthesiologists Task Force on Pain Management, Acute Pain Section. [Internet]. [Citado en octubre de 2007]. Disponible en: http//www.asahq.org/publicationsServices.htm
7. VHA/DoD Clinical practice guideline for the management of postoperative pain. Working group. Veterans Health Administration. Department of Defense. [Internet]. [Citado en julio de 2001] Disponible en: http//www.ncbi.nlm.nih.gov/pubmed/22227789
8. Escobar J. Opioides intratecales para el manejo del dolor agudo postquirúrgico. Rev Chil Anesth. 2011;40:283-91.
9. Cruz Correa MA. Opioides intratecales. En: Opioides en la Práctica médica. Ed: Asociación Colombiana para el estudio del dolor. Bogotá. 2009. p. 135-52.
10. Nuri Deniz M, Erhan E, Ugur G. Intrathecal morphine reduces postoperative tramadol consumption in patients undergoing radical retropubic prostatectomy: a randomized trial. Eur Rev Med Pharmacol Sci. 2013r;17:834-8.
11. dos Santos LM, Santos VC, Santos SR, Malbouisson LM, Carmona MJ. Intrathecal morphine plus general anesthesia in cardiac surgery: effects on pulmonary function, postoperative analgesia, and plasma morphine concentration. Clinics (Sao Paulo) 2009;64:279-8.
12. Kara I, Apiliogullari S, Oc B, Celik JB, Duman A, Celik C, Dogan NU. The effects of intrathecal morphine on patient-controlled analgesia, morphine consumption, postoperative pain and satisfaction scores in patients undergoing gynaecological oncological surgery. J Int Med Res. 2012;40(2):666-72.
13. Meylan N, Elia N, Lysakowski C, Tramer MR. Benefit and risk of intrathecal morphine without local anaesthetic in patients undergoing major surgery: meta-analysis of randomized trials. Br J Anaesth. 2009;102(2):156-67.
14. Pöpping D, Elia N, Marret E, Wenka M, Tramèr M. Opioids added to local anesthetics for single-shot intrathecal anesthesia in patients undergoing minor surgery: A meta-analysis of randomized trials. Pain 2012;153:784-93.
15. Agüero O. Métodos anestésicos multimodales en el procedimiento quirúrgico de revascularización miocárdica sin circulación extracorpórea. Ensayo clínico aleatorizado y meta-análisis. Rev Cubana Anest Rean. 2013. [Internet]. [Citado en octubre de 2014]. Disponible en: http://scielo.sld.cu/pdf/scar/v12n3/scar08313.pdf
16. Riley JL, Robinson ME, Wise EA, Myers CD, Fillingim RB. Sex differences in the perception of noxius experimental stimuli: a meta-analysis. Pain. 1998;74:181-7.
17. Gagliese EA. Correlates of postoperative pain and intravenous patient- controlled analgesia use in younger and older surgical patients. Pain Med. 2008;9(3):299-314.
18. Ip HY, Abrishami A, Peng PW, Wong J, Chung F. Predictors of postoperative pain and analgesic consumption: a qualitative systematic review. Anesthesiology. 2009 Sep; 111:657-77.
19. Llamas A. El dolor pertenece a la vida del hombre. [Internet]. [Citado en octubre de 2014] Disponible en: http//www.familiaqueesyquenoes.org
20. Bujedo M, González Santos S, Uría Azpiazu A, Torán García L. Actualizaciones en el manejo clínico de los opioides espinales en el dolor agudo postoperatorio. Rev. Soc. Esp. Dolor. 2012;19(2):112-21.
21. An updated report by the American Society of Anesthesiologists Task Force on neuraxial opioids. Practice Guidelines for the prevention, detection and management of respiratory depression associated with neuraxial opioid administration. Anesthesiology. 2009;110:218-30.
22. Hernández R, González O, Hidalgo P, Marrero I, Rodríguez J, Nazco O, et al. Valor de la morfina liofilizada intratecal en la revascularización miocárdica quirúrgica. CorSalud. 2013;5:252-60.
23. Pervez S, Gutiérrez M, Carvalho B. Revisan las dosis óptimas de la morfina administrada por vía intratecal o epidural. Drugs. 2011;71(14):1807-19.
24. Duman A, Apiliogullari S, Balasar M, Gürbüz R, Karcioglu M. Comparison of 50 micrograms and 25 micrograms doses of intrathecal morphine on postoperative analgesic requirements in patients undergoing transurethral resection of the prostate with intrathecal anesthesia. J Clin Anesth. 2010;22(5):329-33.
25. Ozbek H, Deniz M, Erakgun A, Erhan E. Comparison of 75 and 150 μg doses of intrathecal morphine for postoperative analgesia after transurethral resection of the prostate under spinal anesthesia. J Opioid Manag. 2013;9(6):415-20.
26. Amaral F, Tenório S. Estudo comparativo entre doses de morfina intratecal para analgesia após cesariana. Rev Bras Anestesiol. 2013;63(6). [Internet]. [Citado en enero de 2015] Disponible en: http://dx.doi.org/10.1016/j.bjan.2013.01.001
27. Gehling MH, Luesebrink T, Kulka PJ, Tryba M. The effective duration of analgesia after intrathecal morphine in patients without additional opioid analgesia: a randomized double-blind multicentre study on orthopaedic patients. Eur J Anaesthesiol. 2009;26:683-8.
28. Gehling M, Tryba M. Risk and side effects of intratecal morphine combined with spinal anaesthesia: a meta-analysis. Anaesthesia. 2009;64:643-51.
29. Bisgaard T. Analgesic treatment after laparoscopic cholecystectomy: a critical assessment of the evidence. Anesthesiology. 2006;104(4):835-6.
30. González de Mejía N. Postoperative multimodal analgesia. Rev Soc Esp. Dolor. 2005;12:112-8.
31. Labrada A, Jiménez- GarcÍa Y. Analgesia Multimodal Preventiva: estudio comparativo. Rev Soc Esp Dolor. 2004;11:122-8.
32. Mota F, Marcolan J, Pereira M, Milanez A, Dallan L, Diccini S. Comparison study of two different patient-controlled anesthesia regiments after cardiac surgery. Rev Bras Cir Cardiovasc. 2010;25(1):38-44.
33. Ready L. Acute Perioperative Pain. En: Miller RD. Anesthesia. New York. Ed: Interamericana. Mc Graw Hill. 5ta. Ed. 2000. p. 215-35.
34. Jorgensen H, Wetterslev J, Moiniche S, Dahl J. Anestésicos locales epidurales versus regímenes analgésicos basados en opiáceos sobre la parálisis gastrointestinal, las NVPO y dolor posoperatorios después de la cirugía abdominal (Revisión Cochrane traducida). En: La Biblioteca Cochrane Plus, número1, 2005. Oxford, Update Software Ltd. Disponible en: http://www.update-software.com
35. De Cosmo G, Aceto P, Gualtieri E, Congedo E. Analgesia in thoracic surgery: review. Minerva Anestesiol. 2009;75(6):393-400.
Recibido: 2 de enero de 2016.
Modificado: 22 de enero de 2016.
Aprobado: 25 de febrero de 2016.
Yasel Gonzalez Brizuela. Hospital Clínico Quirúrgico "Hermanos Ameijeiras". La Habana, Cuba. Correo electrónico: ygbrizuela@infomed.sld.cu