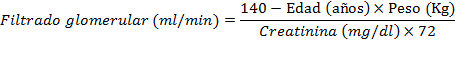INTRODUCCIÓN
La esperanza de vida en Cuba y en el resto del mundo en los últimos años ha aumentado, por lo que la existencia de enfermedades asociadas, conocidas como enfermedades crónicas no transmisibles en pacientes que se remiten a cirugía es mayor, también se ha incrementado.
La hipertensión arterial, la insuficiencia renal crónica y la diabetes mellitus son factores de riesgo conocidos de enfermedades cardiovasculares que requieren tratamiento quirúrgico como son: la cardiopatía isquémica, las enfermedades valvulares de origen degenerativo o reumático, entre otras.
El estudio de los pacientes con enfermedad renal y su efecto en el sistema cardiovascular es objetivo primordial de The National Kidney Foundation. Estos parámetros deben sumarse a los riesgos inherentes al procedimiento quirúrgico con el fin de optimizar los factores de riesgo en la consulta preanestésica.1
Después de una cirugía cardíaca la lesión renal aguda persiste como causa importante de morbilidad y mortalidad posoperatoria y aunado a ello, se produce un aumento de los costos de la atención, la estadía hospitalaria y el desarrollo ulterior de enfermedad renal crónica la cual puede ser causante de mortalidad a corto o largo plazo.
Los riñones reciben aproximadamente 15-25 % del gasto cardíaco total o 1-1,25 L/min de sangre a través de las arterias renales, dependiente de las condiciones del organismo. La mayor parte de la sangre la recibe la corteza renal y sólo 5 % del gasto cardíaco fluye hacia la médula renal, lo que hace que las papilas renales sean vulnerables a las lesiones isquémicas.
La estimulación simpática por la intervención quirúrgica puede aumentar la resistencia vascular y reducir el flujo sanguíneo renal, mientras que los anestésicos reducen el flujo renal mediante la reducción del gasto cardíaco.2 Una presión arterial media baja persistente, pero mayor de 60 mmHg afecta el flujo sanguíneo renal, sin afectar el filtrado glomerular (FG), secundario a la autorregulación intrínseca, la cual mantiene la presión arterial media entre 60 y 160 mmHg en riñones intactos.
Entre los factores de riesgo preoperatorios que se asocian a la disfunción renal posoperatoria (DRP) después de intervenciones cardíacas se encuentra la insuficiencia renal preexistente, la diabetes mellitus de tipo 1, la edad superior a 65 años, anemia, cirugía vascular mayor, la arteriopatía, la predisposición genética y la exposición reciente a fármacos nefrotóxicos.3
Varios factores intraoperatorios pueden predisponer a un paciente a la DRP, como son: la intervención quirúrgica de urgencia, reintervenciones, cirugía valvular y un tiempo de circulación extracorpórea (CEC) superior a 3 h. Otros factores de riesgo de DRP después de una cirugía cardíaca son hipovolemia e hipotensión derivada de síndrome de bajo gasto cardiaco (SBGC), así como fenómenos embólicos. Además, los daños en las nefronas en la región medular del riñón provocan necrosis tubular aguda; la hipoxia es una causa frecuente de lesión en las nefronas de esta región.4
Los objetivos de esta revisión son: ampliar los conocimientos actuales sobre el paciente con insuficiencia renal aguda en relación con los aspectos principales de su incidencia después de la cirugía cardíaca asociada o no a la circulación extracorpórea y su influencia en la conducción anestésica y la conducta posoperatoria en la aparición del referido daño renal.
MÉTODOS
Para realizar la investigación se consultaron las bases de datos bibliográficas avanzadas Pubmed, Hinari, Clinicalkey, Lilacs, libros de textos de la especialidad y tesis doctorales que se complementaron con artículos referenciados de las anteriores búsquedas en su mayoría actualizadas. El colectivo de autores envió los artículos recuperados a tres expertos en el tema a tratar. Posteriormente, los expertos seleccionaron 27 artículos que quedaron finalmente incluidos como bibliografía en la revisión. La escasa publicación del tema responsabiliza a los autores del presente artículo a proporcionar la información básica recogida, analizada y sustentada científicamente en esta revisión.
ESTRATEGIAS PARA REDUCIR EL RIESGO DE INSUFICIENCIA RENAL PREVIA A LA INTERVENCIÓN QUIRÚRGICA CARDIOVASCULAR
El éxito en la prevención de complicaciones durante el perioperatorio incluye la identificación y optimización de los pacientes con riesgos, una correcta conducción anestésica, la monitorización de la función renal e intervenciones oportunas. Las principales estrategias de protección renal para esta población son la normovolemia y un estado de hidratación que asegure adecuada perfusión renal y gasto cardiaco.
Evaluar la función renal en los enfermos con insuficiencia renal crónica en el preoperatorio y trazar las estrategias de acuerdo a los resultados encontrados resulta de vital importancia y a tener en cuenta en la intervención quirúrgica cardiovascular con el fin de evitar la aparición de la insuficiencia renal aguda en el posoperatorio. (Tabla 1).
Tabla 1 Clasificación de la enfermedad renal crónica según la Kidney Disease Outcomes Quality Initiative
| Estadio | FG (mL/min/1,73 m2) | Descripción |
|---|---|---|
| 1 | ≥90 | Daño renal con FG normal |
| 2 | 60-89 | Daño renal con ligero descenso de FG |
| 3 | 30-59 | Descenso moderado del FG |
| 4 | 15-29 | Descenso grave del FG |
| 5 | <15 o diálisis | Pre diálisis/diálisis |
FG: filtrado glomerular
The National Kidney Foundation y la Kidney Disease Outcomes Quality Initiative define la enfermedad renal crónica como el daño estructural o funcional del tejido renal que perdura durante más de tres meses, y se manifiesta por anormalidades estructurales o funcionales, o la disminución de la TFG por debajo de 60 mL/min/1,73m2.
El conocimiento del funcionamiento renal requiere tres premisas: perfusión sanguínea adecuada, la integridad del parénquima renal y la permeabilidad de las vías excretoras.5 Se clasifica la insuficiencia renal aguda como: prerrenal, renal y obstructiva o posrenal (Tabla No. 2).
Tabla 2 Causas frecuentes de la disminución de la diuresis y de la lesión renal aguda postoperatoria
| Prerenal | Renal | Posrenal |
|---|---|---|
| Hipotensión | Necrosis tubular aguada | Obstrucción de la sonda urinaria |
| Absoluta | Isquemia-reperfusión | Retorcimiento de la sonda |
| Relativa | Medios de contraste | Residuos |
| Hipovolemia | Radiológico | Hipertrofia prostática |
| Absoluta | Nefritis intersticial aguda | Espasmo vesical |
| Relativa (HIA) | Retención urinaria |
HIA: hipertensión intrabdominal
El perfil del paciente candidato a cirugía cardíaca6 es de una persona mayor de 65 años, asociado a otros factores de riesgo preoperatorio. Los pacientes de más de 75 años presentan una incidencia de insuficiencia renal aguda (IRA) superior a la de los pacientes de menor edad.
Igualmente se observó una asociación entre la clase funcional preoperatoria de los pacientes y la necesidad de depuración extra renal, de modo que los pacientes asintomáticos requieren menos técnicas de depuración en comparación con aquellos que presentan mayor deterioro preoperatorio. El SBGC y el síndrome de disfunción múltiple de órganos (SDMO) en el posoperatorio favorecen el desarrollo de IRA posoperatoria y la necesidad de terapias de reemplazo renal (TRR).
La incidencia de IRA en los pacientes intervenidos de cirugía cardíaca es de 30 %, aunque solo 1 % necesitan diálisis.7 A pesar de los avances en las técnicas de CEC, cuidados intensivos y hemodiálisis, la morbilidad y mortalidad asociada a la IRA no se han modificado en la última década; esto argumenta la necesidad de profundizar en el conocimiento de la fisiopatología de la IRA asociada a cirugía cardíaca y de las terapias específicas.
Diagnóstico de IRA
Clasificación funcional de IRA. La clasificación del grupo ADQI (Acute Dyalisis Quality Initiative)8 gradúa el deterioro funcional en cinco escalones a los que denomina: RIFLE (risk, injury, failure, loss, end) por sus siglas en inglés; risk, injury (daño), failure, loss (pérdida prolongada de la función renal) y end (fin irreversible de la función renal). Con ellas construyen el acrónimo RIFLE, como se denomina a esta clasificación.9
El deterioro agudo de la función renal se estratifica según el descenso del filtrado glomerular basal, el aumento de la creatinina sérica y la disminución de la diuresis en el caso de los tres primeros elementos del acrónimo (RIF), y la pérdida de la función renal a lo largo del tiempo de evolución en los dos últimos (LE). La clasificación AKIN es una modificación del sistema RIFLE y fue propuesta por la Acute Injury Network al emplear un sistema de estadios funcionales identificados por números que coinciden con los tres primeros del RIFLE.
El valor de la creatinina sérica no debe utilizarse de forma aislada para valorar la función renal, se debe valorar la edad, el sexo y el tamaño corporal. En una lesión aguda se necesita más información, ya que la creatinina sérica no se eleva por encima de 2,0 mg/dl hasta que el filtrado glomerular haya descendido a 40 mL/min/1,73 m2 de superficie corporal.
Filtrado glomerular. La fórmula más utilizada en la actualidad es la de Cockroft y Gault;10 que mediante sencillos parámetros y sin necesidad de obtener muestra de orina, ofrece una estimación ajustada del aclaramiento de creatinina.
En la mujer se multiplica el FG por 0,85 (debido a las diferencias en la proporción de músculo y grasa corporal entre los sexos) aunque está en la literatura consultada se considera menos exacta que otras desarrolladas posteriormente se continúan utilizando por la sencillez y facilidad de su uso en la práctica. En circunstancias normales, la concentración de creatinina aumenta gradualmente días después de la lesión renal mientras el filtrado glomerular disminuye. Es difícil detectar IRA de forma precoz tras cirugía cardíaca, pues la creatinina está diluida debido a la CEC.11
Existe significación estadística entre IRA y la hemodilución pos CEC en las que el hematocrito disminuye por debajo de 21 % pues la hemodilución reduce el contenido arterial de oxígeno a nivel sistémico y el aporte de oxígeno a los riñones y desencadenan IRA.12
Otros marcadores. El empleo de la cistatina C para evaluar la función renal tiene como ventaja identificar la presencia de IRA entre 24 a 48 h antes de que pueda hacerlo el incremento de la creatinina sérica;13 también se usa para ello la molécula 1 de daño renal [kidneyinjury molecule-1(KIM-1)], o la gelatinasa asociada a lipocalina del neutrófilo [neutrophil gelatinase-associated lipocalin (NGAL).
Insuficiencia renal secundaria a cirugía cardiovascular
La intervención quirúrgica coronaria es la de menor incidencia de IRA (2,5 %) y de TRR (1 %); seguida de la intervención quirúrgica valvular con una incidencia de (2,8 % y 1,7 %) respectivamente. Los pacientes con cirugía coronaria y valvular combinada, pertenecen al grupo de mayor riesgo con una incidencia de IRA de (4,6 %) y necesidad de terapia de reemplazo renal (TRR) de 3,3 %.14 Varios estudios han examinado los factores de riesgo asociados al desarrollo de IRA después de CEC.15 Dentro de ellos el sexo femenino, fracción de eyección (FEVI) disminuida o la presencia de insuficiencia cardiaca congestiva, diabetes, enfermedad vascular, uso de balón de contra pulsación, enfermedad pulmonar obstructiva crónica, cirugía urgente e insuficiencia renal crónica, aunque esté sin diagnosticar. Este último factor es el más predictivo, con necesidad de terapia de reemplazo renal entre 10-20 % si la creatinina preoperatoria se encuentra entre 2 y 4 mg/dl y de (25-28 %) si es superior a 4 mg/dl.
Un meta análisis que incluyó el estudio de 15 grupos evidenció que el inicio de la terapia de remplazo renal entre las 12 y 24 h posteriores a la cirugía cardíaca disminuía la mortalidad en 28 días, así como la estadía en la unidad de cuidados intensivos.16 Los factores predictivos independientes de necesidad de TRR fueron: insuficiencia renal previa, infarto de miocardio, diabetes mellitus, shock cardiogénico, urgencia quirúrgica, estadio ≥ III de la clasificación de la New York Heart Association, tiempo de circulación extracorpórea >120 min, bajo gasto cardíaco intraoperatorio y las transfusiones.
El estudio de Pérez-Valdivieso17 observó que la transfusión de concentrados de hematíes incrementó de forma independiente el riesgo de padecer insuficiencia renal aguda, necesidad de ventilación mecánica prolongada y apoyo hemodinámico en el posoperatorio inmediato.
Se recomienda programar la intervención quirúrgica después de 7 días de la administración del iodo para los estudios de hemodinámica, tratar la anemia, optimizar el gasto cardiaco durante el perioperatorio a través de los fluidos intravenosos de preferencia soluciones balanceadas y los inotrópicos; en caso de detectar la IRA en el posoperatorio instaurar la TRR tempranamente.
Medidas previas a la intervención quirúrgica
La optimización del gasto cardíaco, evitar la depleción de volumen intravascular e intensificar el tratamiento de la insuficiencia cardíaca congestiva son medidas que deben cumplirse antes de la realización de cualquier intervención quirúrgica cardiaca.
El uso de diuréticos previos a la intervención quirúrgica se asocia con mayor riesgo de TRR. La utilización de diuréticos osmóticos como el manitol no tiene indicación preoperatoria y su uso es más importante durante la intervención quirúrgica. La exposición a contrastes durante la coronariografía debe demorar la intervención quirúrgica. En un estudio reciente18 se observó como el cateterismo cardíaco realizado en los 5 días previos a la intervención quirúrgica duplicaba el riesgo de desarrollar IRA posoperatoria. Un estudio con 502 pacientes comparó la administración de bicarbonato de sodio en dextrosa versus infusión de solución salina al 0,9 % antes de la exposición de contraste en pacientes con TFG<60 mL/min/1,73 m2 y profilaxis oral con N-acetilcisteína. En ambos grupos no se encontraron diferencias significativas.19 Por otra parte, los antinflamatorios no esteroideos (AINEs), administrados previo a la intervención afectan la autorregulación del flujo sanguíneo renal. En los pacientes propuestos a cirugía cardíaca, la repercusión de los inhibidores de la enzima convertidora de angiotensina (IECAs) es controvertida. Algunos estudios demuestran la disminución en la aparición de complicaciones mayores y la mortalidad en pacientes llevados a cirugía cardíaca.20 Este grupo de medicamentos y los bloqueadores de los receptores de angiotensina (ARA I y ARA II) forman parte del grupo el cual algunos autores son partidarios de suspenderlos 24 h antes del procedimiento y reiniciarse en el posoperatorio en estado euvolémico, sin evidencia de lesión renal aguda ya que reduce el riesgo de muerte perioperatoria, daño miocárdico y accidente vascular encefálico.
Aunque faltan datos sólidos que lo confirmen, la administración de fenoldopam, a diferencia de la dopamina, ha demostrado reducir la mortalidad y la incidencia de terapia de remplazo renal.
Múltiples estudios han demostrado el efecto de las estatinas para la morbimortalidad perioperatoria basado en su efecto pleiotrópico.21
El uso profiláctico de terapia de reemplazo renal en pacientes con creatinina (Crs) 2-2.5 mg/dl disminuye la morbimortalidad.16
Medidas durante la intervención quirúrgica
La estrategia transfusional durante la intervención quirúrgica cardíaca nos pone en una situación paradójica. Por una parte, una hemoglobina baja es perjudicial para el riñón y el resto de los órganos, pero está demostrado que las transfusiones intraoperatorias se asocian a IRA, lesión pulmonar, cardíaca y neurológica en pacientes con anemia preoperatoria comparados con los no anémicos, con una estadía hospitalaria y riesgo de muerte mayor. Estas complicaciones se incrementan con el uso de estrategia transfusional restrictiva (hemoglobina entre 7-8 g/dl) en la población de alto riesgo.22
Un estudio retrospectivo23 en 410 pacientes mostró que mantener tensiones arteriales medias más bajas que el límite inferior de la autorregulación cerebral está asociado con IRA. Otros estudios como el de Kandler24 no encontró diferencias significativas entre la tensión arterial y la IRA, pero sí una tendencia a la IRA en pacientes con períodos mayores de tensión arterial por debajo de 60 mmHg. Se ha demostrado que el flujo pulsátil de la máquina de circulación extracorpórea es renoprotector con mayores cifras de aclaramiento renal y menores niveles de lactato. Sin embargo, contribuye a la patogénesis de la IRA mediante la activación de una respuesta inflamatoria. Además, disminuye la presión de perfusión renal efectiva hasta 30 %, contribuye a la isquemia y lesiones por reperfusión. La hemólisis y la liberación de hemoglobina libre durante la CEC es también un mecanismo nefrotóxico que da lugar a un aumento de la resistencia vascular sistémica, alteración de la coagulación, disfunción plaquetaria, daño tubular renal y aumento de la mortalidad.
La norepinefrina es utilizada para evitar la vasodilatación y aumentar la tensión arterial durante la circulación extracorpórea. En el estudio de Kandler y otros24 se observó aumento de IRA en pacientes con dosis de norepinefrina altas. El levosimendán, un nuevo fármaco inotrópico positivo, se empleó en un estudio realizado por Baysal y otros25 en cirugía de revascularización miocárdica (RVM) con FEVI <45 %, y se asoció con menor incremento de las creatininas en el tercer día de posoperatorio y menor necesidad de TRR.
Medidas posoperatorias
El uso temprano de TRR (0,78+0,2 días) después de cirugía cardíaca16 se ha asociado con una supervivencia mayor en pacientes que presentan daño renal agudo respecto al uso tardío (28±2.2 días). La TRR veno-venoso continuo es el más utilizado en estos pacientes, es una terapia de reemplazo renal similar a la hemodiálisis y es usada casi exclusivamente en unidades de críticos porque maneja pocos volúmenes de sangre en mayor unidad de tiempo y genera menos inestabilidad hemodinámica. Stein26 evaluó la relación de las sobrecargas de volumen y los cambios en la creatinina sérica como predictores de mortalidad y morbilidad, con marcadores pronósticos de relevancia. Balances hídricos muy positivos suponen una excesiva presión venosa en el riñón lo que reduce la perfusión y la filtración glomerular.
En la actualidad, no existe consenso respecto a la estrategia transfusional de glóbulos rojos en el postoperatorio de cirugía cardíaca. La American Society of Cardiotoracic Surgeons recomienda la transfusión en pacientes con niveles de hemoglobina por debajo de 7 gr/dl. Debido al alto riesgo de mortalidad y susceptibilidad de complicaciones isquémicas en pacientes operados por cirugía cardiaca, se aconseja transfusiones sanguíneas con niveles de hemoglobina más liberales (Hb. 9 gr/dl)27 y aumentar en dos puntos lo actualmente recomendado, lo cual podría resultar beneficioso.
El cuadro 1 resume los objetivos y modalidades de tratamiento para reducir o prevenir la enfermedad.
Cuadro Medidaspara evitar la disfunción renal posoperatoria
| Objetivos y modalidades de tratamiento para reducir o prevenir el desarrollo de disfunción renal posoperatoria |
|---|
| Mantener un suministro de oxígeno apropiado mediante valores adecuados del gasto cardíaco, garantizar una adecuada capacidad de transporte de oxígeno y la saturación de hemoglobina. Suprimir la constricción renovascular con una precarga de volumen adecuada y el uso de infusiones de manitol, bloqueantes de la entrada de calcio e inhibidores de la enzima conversora de la angiotensina. Promover la vasodilatación renal mediante fármacos dopaminérgicos, prostaglandinas y péptido natriurético auricular. Mantener el flujo en los túbulos renales con diuréticos de asa y manitol (que pueden actuar para prevenir la obstrucción tubular, susceptible de provocar inflamación celular, isquemia y muerte). Disminuir la demanda de oxigeno mediante el uso de diuréticos de asa y enfriamiento ligero. Atenuar la lesión por isquemia y reperfusión que se produce como consecuencia de la liberación de radicales libres de oxígeno e iones de calcio. |
Se concluye que la identificación de los factores de riesgo preoperatorios asociados a la aparición de insuficiencia renal aguda en el posoperatorio de la cirugía cardiovascular con o sin circulación extracorpórea, así como la preparación de las condiciones para enfrentar las posibles complicaciones en estos pacientes; disminuye la morbimortalidad, los costos y la estadía hospitalaria. Una elección correcta de los medicamentos de uso común, la monitorización periódica de parámetros hematológicos y clínicos durante el perioperatorio; contribuye a una recuperación a corto y mediano plazo satisfactoria.