Introducción
Hace más de 10 años, el resultado de tres bloqueos terapéuticos de ganglio estrellado (GE) seriados en un paciente con enfermedad de Sudeck de la mano derecha, estimuló en el orden personal la continuidad y la investigación de esta práctica. En ese caso se usó lidocaína más betametasona con la hipótesis de que el esteroide, tal cual sus efectos neuronales a nivel peridural, prolongaría el bloqueo nervioso al ejercer similares efectos farmacológicos sobre las neuronas a nivel ganglionar, y al perdurar los efectos simpaticolítico y analgésico, propiciaría una mejor y más rápida respuesta terapéutica con un riesgo mínimo de complicaciones.
La historia acumula unos 140 años de experiencias en bloqueos nerviosos con anestésicos locales y otras sustancias, con sus múltiples aplicaciones en el tratamiento del dolor crónico.1,2
El bloqueo de GE es un procedimiento que el anestesiólogo realiza muy frecuentemente, pues interrumpir mediante drogas o medios físicos el impulso nervioso en las fibras preganglionares que hacen sinapsis en este, permite el control del dolor en la cabeza, el cuello y los miembros superiores.3 Sus efectos representan una opción para pacientes con dolor crónico (en dichas zonas) resistente a tratamiento convencional y otras alteraciones susceptibles que interfieren su calidad de vida.4,5,6,7
El bloqueo de GE es un procedimiento seguro no exento de riesgos. El abordaje paratraqueal a nivel de C6 es la técnica más utilizada, la más segura y la de menor complejidad en su ejecución.7 La mayoría de sus complicaciones son poco frecuentes y de corta duración. La proximidad de estructuras vitales hace ineludible su correcta localización anatómica.8,9,10,11,12
El ganglio cervical inferior se fusiona con el primer ganglio torácico para formar un gran ganglio cervicotorácico (GE) de aproximadamente 2,5 x 1 x 0,5 cm, en 80% de la población.1,2,3,4,5,6,7,)
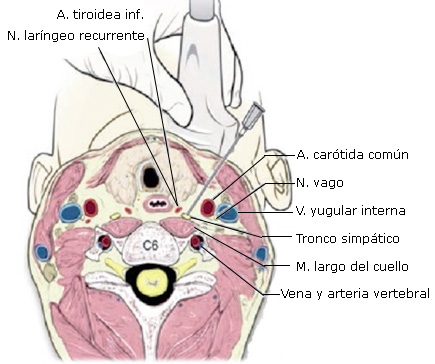
Muy próximos al GE de cada lado se encuentran: la arteria y vena vertebrales; nervios espinales cervicales y vago; la duramadre; la carótida común; la faringe; la laringe; el nervio recurrente; la arteria tiroidea inferior; la cúpula pleural; el borde superior de la arteria subclavia; y la vena yugular interna, entre otras estructuras (Fig.).
La noradrenalina que liberan sus terminales nerviosas posganglionares simpáticas manipula el tono vasomotor, la contracción pupilar, el ritmo y la contractilidad del corazón.
Para que se produzca dolor debe haber irritación química y/o inflamación de los nervios y/o tejidos. A diferencia del dolor crónico, el dolor agudo suele ser transitorio y tener una causa conocida, localizarse en el área de la lesión y remediar espontáneamente.
Existen dos tipos de Síndrome de Dolor Regional Complejo (SDRC), y cada uno exhibe similares síntomas y signos, pero causas diferentes. El SDRC tipo 1 se presenta sin una enfermedad o daño evidente sobre los nervios del miembro sintomático. Los receptores de dolor en estos pacientes se tornan muy sensibles a los neurotransmisores de las ramas simpáticas del sistema nervioso autónomo (catecolaminas). El SDRC tipo 2 se presenta después de una lesión neurológica. La incidencia del SDRC tipo 1 en el mundo va en ascenso entre adolescentes y adultos jóvenes, y muchos casos son potencialmente tributarios de bloqueo de GE.13
Entre las dolencias en que la realización de bloqueos de GE es una alternativa loable se encuentra: hiperhidrosis, neuralgias posherpéticas;14 SDRC tipo 1 (distrofia simpática refleja);3 migrañas cervicales;15 arritmias agudas;16 ansiedad; dolor del miembro fantasma; dolor cicatricial neuropático; vasculopatías; insuficiencias vasculares; arteriospasmos posembolectomía o secundario a inyección intrarterial de tiopental; fenómeno de Raynaud; dolores cefálicos, faciales y oculares; dolores de miembros superiores; y anginas refractarias, entre otros.
Sin embargo, en un metaanálisis de 2017 que abarcó 9 estudios de diferentes autores, Kim HG y otros no encontraron resultados positivos cuando se realizaron bloqueos de GE a pacientes que padecían de neuralgia posherpética.17
Proveer una analgesia eficiente disminuye los costos que se derivan del ingreso y las complicaciones inherentes a la injuria del dolor agudo o crónico.18
Por todo lo antes expuesto, el objetivo de este artículo es cotejar información reciente sobre la pertinencia del uso de anestésicos locales con adyuvantes, para estimular la actualización de su práctica nacional acorde a las rutinas y los resultados de esta pericia en el contexto internacional.
Métodos
Para promover un acercamiento y profundizar en este tema, se realizó una búsqueda de fuentes en bibliotecas y en internet, con descriptores como: bloqueo nervioso, ganglio estrellado, dolor crónico, distrofia simpática y síndrome de dolor regional complejo. Se analizaron más de 150 monografías, libros, revistas, artículos científicos y se hicieron consultas a expertos referentes a los últimos 40 años de esta técnica a nivel mundial, en español, portugués e inglés, con énfasis en las drogas que usaron, la técnica en sí, sus indicaciones y resultados terapéuticos. Se seleccionaron algunos artículos, según los propósitos de este análisis a la luz de las circunstancias nacionales.
Adyuvantes en el bloqueo terapéutico de ganglio estrellado: antecedentes y contexto actual
En todo este tiempo fue sorprendente corroborar el gran número de estudios foráneos acerca del uso rutinario de diferentes adyuvantes de los anestésicos locales en el bloqueo del GE: usar únicamente un anestésico local, casi siempre tiene sólo fines diagnósticos.19 Igualmente notable fue el no reconocimiento del uso de adyuvantes en este tipo de bloqueo en las consultas personales a una decena de colegas nacionales expertos y en la literatura médica nacional impresa o en línea disponibles.
El resultado exitoso de los bloqueos anestésicos en la disminución del dolor y del consumo de analgésicos,20 precisa el conocimiento de las propiedades farmacológicas de los diferentes anestésicos locales, así como habilidades prácticas para efectuarlo. Las necesidades del anestésico local varían considerablemente y dependen de factores como el tipo de bloqueo y la situación psicológica del paciente. Uno de los anestésicos locales del grupo aminoamidas que más frecuentemente se utiliza es la bupivacaína.21
La mayoría de los anestésicos locales pueden ser antagonistas del glutamato a través de los receptores N-methyl-d-aspartato (NMDA) y α-amino-3-hydroxy-5-methyl-4-isoxazole propionic acid (AMPA), y también pueden potenciar la actividad de los receptores inhibitorios del ácido-gamma-amino-butírico (GABA).22
Los anestésicos locales pueden reducir la severidad del insulto isquémico. Su efecto principal es la estabilización de la membrana neuronal. Además de la acción analgésica, los anestésicos locales tienen una acción antiinflamatoria, lo que justifica su uso para modular el dolor que provoca la respuesta inflamatoria.23
Los anestésicos locales se unen a una parte precisa de la subunidad alfa (la proteína funcional más importante del canal de sodio) e inhiben los canales de sodio dependientes de voltaje, lo que hace imposible su activación y el ingreso de sodio, debido a la despolarización de la envoltura celular. En estado de reposo, este complemento sodio-anestésico local no genera cambios en el potencial de membrana. A medida que aumenta la concentración del anestésico local, una cantidad cada vez mayor de canales de sodio de la envoltura celular se une a moléculas de anestésico local que los inhabilita para trasladar iones de sodio. Esto provoca que la rapidez de la conducción del estímulo nervioso disminuya: la secuencia de incremento y amplitud del potencial de acción disminuye, y el umbral para la estimulación y la transmisión del estímulo se incrementa continuamente.24
Con el objetivo de mejorar los síntomas que aquejan a pacientes con dolor crónico se usan también opioides como buprenorfina, fentanilo y morfina, solos y en combinación con anestésicos locales.25
Los opioides se unen a receptores estereoespecíficos mu, kappa, delta y sigma con una alta afinidad por ellos en el SNC y SNP (sustancia gris periacueductal, sistema límbico, tálamo, hipotálamo, bulbo y sustancia gelatinosa de la médula espinal). Los receptores para opioides se acoplan a proteínas G y esta interacción produce: cierre del canal de calcio operado por voltaje, lo que disminuye la liberación de neurotransmisores (acetilcolina, noradrenalina, glutamato, serotonina y sustancia P); e hiperpolarización con inhibición de neuronas postsinápticas por apertura de canales de potasio.
Existen péptidos analgésicos endógenos que se unen a receptores opioides y que se distribuyen en el sistema nervioso en 3 grupos: encefalinas (leu-encefalina y met-encefalina); dinorfinas (tienen acción analgésica más potente); y endorfinas (β endorfinas; pueden actuar como neurotransmisores o como neurohormonas de larga duración).
Los opioides que se unen fuertemente a los receptores que se encuentran en regiones supraespinales producen analgesia, euforia, depresión respiratoria y dependencia física. Aun cuando su mecanismo de acción y su eficacia analgésica se comprenden pobremente, autores como Kim, Park y otros advierten un significativo alivio del edema después de bloqueos de GE con bupivacaína + triamcinolona, en casos de linfedema en brazos secundario a cáncer de mama, lo que sustenta la presencia de opioides endógenos en ganglios simpáticos.26,27 Otros autores concluyen que los efectos clínicos después de una inyección única de buprenorfina para una analgesia ganglionar opioide local (GLOA, por sus siglas en inglés), improbablemente se deben a una acción específica de la buprenorfina sobre el ganglio estrellado.28
A propósito de este panegírico sobre el uso de adyuvantes en el bloqueo de GE, Abdel OT y cols. (2014), al tratar grupos de 20 pacientes con dolor neuropático posmastectomía, divididos en: grupo bupivacaína (B), grupo bupivacaína + morfina (BM) y grupo bupivacaína + ketamina (BK); obtuvieron los siguientes resultados: exitosa disminución del dolor según escala visual análoga, aumento del rango de movimientos de la articulación del hombro y disminución en el consumo de analgésicos, en el grupo BK respecto al grupo BM, y en éste respecto al grupo B.29
El efecto analgésico de la droga anestésica ketamina, fundamentalmente se atribuye al bloqueo de receptores NMDA (subtipo de receptor glutamato que participa en la sensibilización central ante un estímulo nocivo). Algunos estudios muestran que la administración de ketamina a dosis menores de 1 mg/Kg. de peso corporal por vías epidural, IV o IM reduce el dolor postoperatorio y el consumo de opioides.30
Se tienen sospechas de que altas dosis de solución de ketamina o la toxicidad de la mezcla usada, o ambas, pueden causar cambios histopatológicos locales (vasculitis linfocítica focal).31 En contraste, la inyección única de una baja dosis de ketamina es segura para el tejido neural.32 Esta visión se refuerza por estudios en animales. El daño local es probablemente una secuela del clorobutanol (un preservante que se encuentra en la solución de ketamina), más que por la droga misma.33
Varios autores informan acerca de estudios más recientes sobre su utilización eficaz como adyuvante en bloqueos simpaticolíticos, en sujetos que sufrían un SDRC y concluyen que la ketamina tiene una función especial en pacientes con alodinia debilitante (que en estos casos se acompañaba de inusuales síntomas cognitivos: la estimulación visual de la fricción de la herida evocaba un dolor severo en el miembro afectado; lo que se denomina "dolor vicariante"), mediante su acción sobre las vías centrales del dolor, sin efectos neurosiquiátricos colaterales significativos.34
Por su parte, los corticoides estabilizan la membrana celular neuronal al bloquear la actividad de la fosfolipasa A2, lo que prolonga la inhibición de la descarga neuronal y suprime la sensibilización neuronal del asta dorsal de la médula espinal.35
Los corticoides son los antiinflamatorios más eficaces: pueden inhibir las manifestaciones inmediatas y tardías de la inflamación; inhiben la vasodilatación; disminuyen la trasudación líquida y el edema; reducen el exudado celular y el depósito de fibrina en el área inflamada. Los mecanismos responsables de estas acciones son: un descenso en la acumulación de leucocitos y una disminución de su actividad en el lugar de la inflamación, lo que produce una declinación en la liberación de histamina por parte de basófilos y mastocitos; una reducción de la activación de los macrófagos y de la liberación de metabolitos tóxicos de oxígeno; y una inhibición de la síntesis y secreción de interleucina 1 en los macrófagos.
Diversas series evalúan a los esteroides que se administran por vías neuroaxiales, perineurales y plexales de forma independiente.3,36-39
Estos fármacos producen alivio del dolor. Sus mecanismos parecen relacionarse con la reducción del edema inflamatorio del nervio de la raíz dañada y mejorar de este modo la microcirculación, lo que resulta en la recuperación de la isquemia; por otro lado, al inhibir a la fosfolipasa A2, los esteroides inhiben directamente la excitación neuronal.39,40
YaDeau y otros propusieron que los esteroides suprimen la transmisión de fibras C nociceptivas normales por la acción directa en la membrana en un modelo experimental.39
En el presente estudio hallamos más evidencias de significativa efectividad del bloqueo del GE cuando se usaron adyuvantes de los anestésicos locales, y aunque algunos autores publican que el uso de adyuvantes no superó ciertos aspectos del resultado terapéutico,28 no se encontraron pruebas de que con adyuvantes hubo peores resultados, o secuelas que hicieran desestimar utilizarlos por su gravedad o su frecuencia.
Se concluye que los resultados terapéuticos que se obtienen al aplicar anestésico local más adyuvante son más intensos y duraderos que los que se consiguen al aplicar sólo el anestésico local. Desde el punto de vista bioético, para un cambio de perspectivas protocolares sobre este tema en el país, conviene considerar que el estado de salud de los pacientes no debe empeorar por la aplicación de anestésicos locales con adyuvantes, al atenerse a los resultados que se verifican en la bibliografía médica más reciente; y que se someterían a un riesgo mínimo de complicaciones potencialmente reversibles. Se debe informar a todos los pacientes, explicándoles en qué consiste el procedimiento y las ventajas teóricas del bloqueo terapéutico de GE. Ellos deben firmar un modelo concreto de consentimiento informado. Se deben utilizar monitores y dispositivos normados y calibrados, además del método clínico estandarizado por el sistema de salud cubano.