Introducción
La analgesia perioperatoria efectiva y segura es uno de los retos y compromisos más importantes para el anestesiólogo. La búsqueda constante de nuevos fármacos que permitan un adecuado control del dolor con escasos efectos adversos se vuelve imperativo para este propósito.1
En este contexto surge el concepto de anestesia y/o analgesia multimodal, cuyas estrategias se basan en tratar el dolor sobre una variedad de receptores, más allá de los μ-1 y μ-2 que, comúnmente, son abordados por los opioides. Entre los fármacos más usados por el anestesiólogo para reemplazar a los opioides se encuentran los llamados “adyuvantes analgésicos”. Su mecanismo de acción principal no es producir analgesia; sin embargo, pueden ser analgésicos por sí mismos y al ser administrados junto a un opioide, son capaces de potenciar la acción de este. El nivel de evidencia que apoya la implementación de los diferentes adyuvantes no opioides es variable. Su uso está respaldado por los datos publicados, pero otros requieren una investigación continua o confirmatoria a largo plazo.2,3,4
En las últimas décadas, el sulfato de magnesio como fármaco ha tomado auge con una amplia gama de posibilidades de usos en cardiología, obstetricia, neumología, cuidados críticos y en anestesiología.5
Este fármaco cuenta con una serie de características que lo hacen útil en los cuidados perioperatorios: efecto modulador de la respuesta hemodinámica al estrés (bloquea los canales de calcio con efecto vasodilatador, broncodilatador y antiarrítmico, inhibidor de la liberación de catecolaminas), efecto anestésico, analgésico y por ende, ahorrador de opioides (antagonista de los receptores N-metil-D-Aspartato [NMDA], antinflamatorio (reduce los niveles plasmáticos de interleukina 6 [IL-6], tromboxano A2 y factor de necrosis tumoral alfa [TNF-alfa]) y potenciador de los bloqueadores neuromusculares (inhibe la liberación de acetilcolina en la placa motora terminal).6,7,8
Su uso ha mostrado un efecto benéfico en la reducción de la intensidad de dolor posoperatorio y requerimientos anestésicos, con una reducción constante en el uso de morfina y antiinflamatorios no esteroideos posoperatorios.9,10
El estudio de Guo BL y otros,11 publicado en 2015 en la Pain Physician Journal, concluye que el magnesio utilizado durante la anestesia general disminuye significativamente el dolor posoperatorio (medido por escalas de dolor como la Visual Analogue Scale [VAS], Numerical Rating Scale [NRS], Objective Pain Score [OPS] y Faces Pain Scale Revised [FPS-R]) sin aumentar los efectos adversos; sobre todo en intervenciones urogenital, ortopédica y cardiovascular, mientras que en la cirugía gastrointestinal no fue notable la mejoría. No obstante, dentro de las limitaciones que tuvo esa investigación es que no se estandarizaron las dosis de sulfato de magnesio y que la vía de administración que se utilizó solo fue la intravenosa.
En el meta-análisis de De Oliveira y otros,12 se analizaron 20 estudios con un total de 1300 pacientes en los que se evaluaron la dosis de magnesio y su duración, el tamaño de la muestra, el número de pacientes en el grupo de tratamiento, el periodo de seguimiento, el tipo de intervención quirúrgica, el dolor a las 4 y a las 24 h en reposo y al movimiento, la cantidad de opioide consumido y los eventos adversos. Observaron que el uso de sulfato de magnesio contra placebo demostró un mayor índice de control del dolor tanto en reposo como en movimiento, y disminución significativa del consumo de opioides vía intravenosa. La heterogeneidad dentro de estos grupos se vio reflejada sobre todo por el tiempo de aplicación de la infusión de magnesio, ya fuera en el preoperatorio, intraoperatorio o posoperatorio.
Desde la sistematización realizada a la obra de autores que en el ámbito nacional e internacional han investigado el efecto del sulfato de magnesio como adyuvante de la analgesia en la práctica de diferentes intervenciones quirúrgicas, se identificó que aún es un tema en debate y estudio constante con el fin de probar su eficacia, efectividad y seguridad en la mejora de la evolución posoperatoria de los pacientes. En el servicio de Anestesia del Hospital Universitario “General Calixto García” no existen protocolos establecidos de analgesia multimodal intraoperatoria con el uso del sulfato de magnesio en la cirugía mayor abdominal convencional electiva.
El objetivo de la investigación fue evaluar la efectividad y seguridad del sulfato de magnesio como ahorrador de opioides en la anestesia general de pacientes intervenidos por cirugía mayor abdominal electiva.
Métodos
Se realizó un estudio cuasiexperimental, prospectivo y longitudinal en el Hospital Universitario “General Calixto García”, desde diciembre de 2019 hasta diciembre de 2020, en 44 pacientes programados para cirugía abdominal mayor electiva. Se incluyeron pacientes de ambos sexos, entre 20 y 59 años de edad, estado físico ASA I y II, normopeso y que dieron su consentimiento a participar en la investigación. Fueron excluidos aquellos con antecedentes de cualquier tipo de dolor crónico, alergia a cualquier fármaco de los utilizados, pacientes con enfermedades neuromusculares (miastenia grave, esclerosis lateral amiotrófica, esclerosis múltiple, distrofia muscular progresiva) y polineuropatías de cualquier etiología, y pacientes con disfunción cognitiva o incapacidad para interpretar la escala de dolor aplicada.
Los pacientes seleccionados por muestreo no probabilístico a criterio del investigador, fueron asignados a dos grupos: grupo estudio (E) al que se le administró el sulfato de magnesio y grupo control (C) que no se le administró.
Las variables analizadas fueron: edad, sexo, estado físico, analgesia intraoperatoria (evaluada a través de la respuesta hemodinámica al estímulo quirúrgico y evidenciado por las variaciones de la tensión arterial media [TAM], la frecuencia cardiaca [FC], índice de shock [IS] e índice de perfusión [IP]; antes e inmediatamente después de la incisión quirúrgica, y cada 10 min durante el intraoperatorio); analgesia posoperatoria (evaluada según Escala Verbal Análoga [EVA]: 0: Ausencia de dolor, 1 - 3: dolor leve, 4 - 6 dolor moderado y 7 - 10: dolor intenso.
Se evaluó en cinco momentos: inmediatamente después de extubado el paciente [M0], de forma horaria en las primeras 3 h [M1, M2, M3], y a las 6 h [M6]. Con un valor de la EVA por debajo o igual a tres puntos se administró dipirona 1,8 gr intravenoso y con valores mayores o igual a 4 puntos, se administró tramadol 1 mg/Kg peso y se registró momento y número de dosis); consumo intraoperatorio total de fentanil (según cantidad de microgramos usados en el intraoperatorio); necesidad de analgesia de rescate (según la necesidad o no de utilizar opioides posoperatorio). Se contabilizó el número de dosis de analgesia de rescate en: 1, 2 o 3 dosis) y complicaciones perioperatorias.
Todos los pacientes recibieron medicación preanestésica con metoclopramida 10 mg y midazolam 0,04 mg/kg, 30 min antes de entrar al quirófano. En los dos grupos se utilizó, desde el intraoperatorio, dexametasona 8 mg y ondansetrón 4 mg, todos vía intravenosa.
Grupo GC. Inducción: lidocaína 2 % 1,5 mg/kg, propofol 1,5 mg/kg, rocuronio 0,6 mg/kg y fentanilo 5 mcg/kg. Mantenimiento: Isofluorano 1 - 1,5 vol. % que se ajustó según requerimientos del paciente, fentanilo bolos de 1 mcg/kg según necesidades.
Grupo GE. Se realizó igual al grupo control, pero se administró además un bolo de sulfato de magnesio 30 mg/kg durante 10 min. El mantenimiento igual que el grupo C, solo que se agregó una infusión continua de sulfato de magnesio a 10 mg/Kg/hr, que se descontinuó al término del último punto de piel.
Al finalizar la intervención quirúrgica, en ambos grupos se administró diclofenaco 75 mg diluido en 100 mL de solución salina al 0,9 %. Se antagonizó el efecto del bloqueante neuromuscular en caso necesario con neostigmina 0,03 mg/kg y atropina 1 mg intravenoso. Todos los pacientes fueron extubados dentro del quirófano, conscientes y con hemodinamia estable. Fueron trasladados a la UCPA para la recuperación total, hasta que reunieron los requisitos establecidos para el alta anestésica según protocolo de trabajo de dicho lugar.
El procesamiento se realizó mediante el paquete estadístico SPSS para Windows versión 15. Incluyó el cálculo de medidas de resumen para variables cualitativas (frecuencias absolutas y porcentajes) y para las cuantitativas media y desviación estándar. Para las variables cualitativas se empleó el test Ji Cuadrado para el contraste de hipótesis de homogeneidad entre los grupos de estudio y la prueba exacta de Fisher cuando lo requirió en función del cumplimiento del supuesto sobre las frecuencias esperadas. Para las variables cuantitativas se empleó la prueba paramétrica t de student para muestras independientes. Para el estudio de la evolución en los diferentes momentos de las variables estudiadas se utilizó la prueba paramétrica ANOVA de medidas repetidas. Para su correcta aplicación fue necesario estudiar primero sus presupuestos de aplicación, es decir, la normalidad de la variable (prueba de Shapiro-Wilk), la homogeneidad de las varianzas (prueba de Levene), la homocedasticidad de la matriz de la covarianza (prueba M de Box) y la esfericidad de la matriz de covarianza (test de esfericidad de Mauchly). En el caso de no fuera posible asumir la esfericidad (p≤0,05) se utilizó el Epsilon de Greenhouse-Geisser de la ANOVA de medidas repetidas. Se utilizó en todos los casos como nivel de significación p≤0,05.
La investigación fue analizada y aprobada en el servicio de Anestesiología y luego por el Comité científico y Comité de ética de la institución.
Resultados
Las variables edad, sexo y estado físico tuvieron similar comportamiento en ambos grupos. El 38,6 % de los pacientes se encontraron entre los 50 y 59 años. En los dos grupos predominó el sexo masculino (68,2 %) y el estado físico ASA II (65,9 %). Ninguno de estos resultados mostró diferencias significativas.
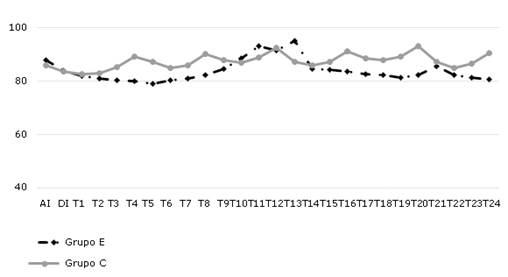
En ambos grupos, luego de la inducción de la anestesia, hubo una ligera disminución de la TAM respecto a los valores basales sin caer en el rango de la anormalidad. Fue más evidente y prolongada en el grupo E, cuyos valores se mantuvieron por debajo de la media del total de los pacientes (84 ± 4,16) desde los primeros 10 min hasta, aproximadamente, 100 min del intraoperatorio.
En el grupo C los valores se incrementaron respecto a la media total (87 ± 2,69) en intervalos de 40 min con tendencia a mantenerse por encima de esta media. Estos resultados expresaron diferencias significativas (p<0,001), entre los diferentes momentos y entre los dos grupos de estudio (Fig. 1).
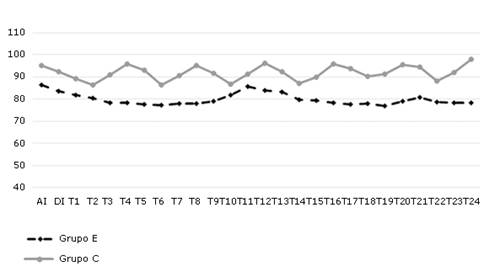
La figura 2 representa las variaciones en las cifras medias de FC intraoperatoria según momentos y grupos. Luego de la inducción anestésica hubo una ligera disminución respecto a los valores basales en ambos grupos. Esta fue más evidente y prolongada en el grupo E, cuyos valores se mantuvieron por debajo de la media del total de pacientes (80 ± 2,66) desde los primeros 10 min hasta, aproximadamente, los 100 min. En el grupo C los valores se incrementaron respecto a la media total (92 ± 3,28) a los 40 y 80 min con tendencia a mantenerse por encima después de los 120 min. Las diferencias fueron significativas (p<0,001), entre los diferentes momentos y entre los grupos.
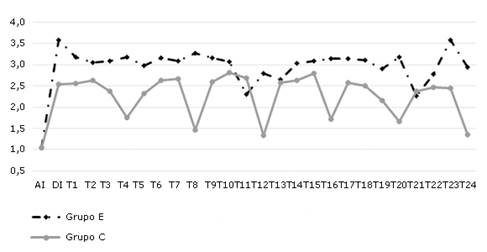
Las variaciones en el IP fueron similar a la TAM y FC. Luego de la inducción hubo un incremento respecto a los valores basales en ambos grupos, el cual fue más evidente y prolongado en el grupo E, cuyos valores se mantuvieron por encima de la media del total (3,0 ± 0,49) desde los primeros 10 min hasta, aproximadamente, los 110 min, con tendencia a mantenerse o estar por encima durante el resto del intraoperatorio. En el grupo C, los valores disminuyeron respecto a la media total (2,3 ± 0,52) a los 40 y 80 min con tendencia a mantenerse o estar por debajo después de los 90 min. Las diferencias fueron significativas (p<0,001) entre los diferentes momentos y entre los grupos (Fig. 3).
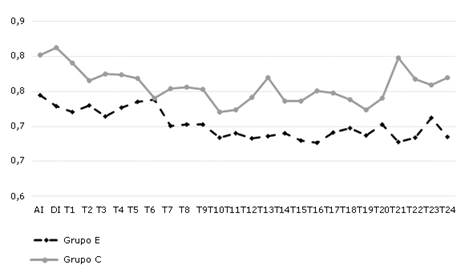
Con respecto al índice de shock (IS), la figura 4 representa sus variaciones. Luego de la inducción, el grupo E mantuvo valores por encima de la media total del grupo (0,7 ± 0,02) hasta alrededor de los 110 min, en que disminuye en todos los momentos por debajo de la media. El grupo C mantuvo valores por encima de la media del total de los pacientes del grupo (0,76 ± 0,02) luego de la inducción de la anestesia y hasta cerca de los 60 min, en que disminuye. Resultados similares se encuentran a los 100, 140 y 190 min del intraoperatorio. Igualmente, las diferencias fueron significativas (p=0,002) entre los diferentes momentos y entre los grupos.
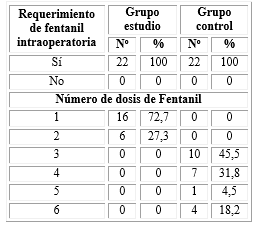
La tabla 1 muestra el requerimiento en el consumo de fentanil intraoperatorio y el total de dosis por paciente y grupo. El 100 % de los pacientes en ambos grupos requirió el uso de fentanil intraoperatorio. Sin embargo, en el grupo E, el 72,7 % requirieron solo una dosis y el 27,3 % requirieron dos dosis. Mientras que en el grupo C todos los pacientes requirieron más de tres y hasta seis dosis de analgesia de rescate. Las diferencias encontradas fueron significativas (p<0,001).
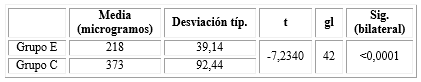
El consumo intraoperatorio total de fentanil en microgramos por pacientes se recoge en la tabla 2. La media de dicho consumo en el grupo E fue de 218 ± 39,14 en el total de pacientes y en el grupo C fue de 373 ± 92,44. Las diferencias fueron significativas (p<0,001) con una confiabilidad del 95 %.
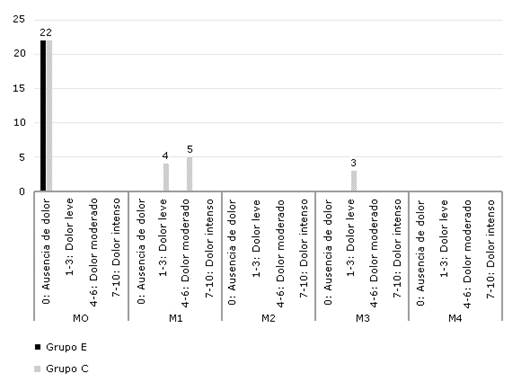
La figura 5 muestra los valores de la Escala Verbal Análoga (EVA) según intensidad del dolor posoperatorio referido por el paciente. En el grupo E la totalidad de los pacientes (22) refirió ausencia de dolor en los cinco momentos evaluados. En el grupo C, refirieron dolor leve cuatro pacientes en la primera hora y tres pacientes en la tercera hora y refirieron dolor moderado cinco pacientes en la primera hora. Ningún paciente refirió dolor intenso.
Esos resultados explican el hecho que en ningún paciente del grupo E fue necesaria la analgesia de rescate en el posoperatorio, mientras que en el grupo C la necesitaron 14 pacientes (63,6 %), entre una y dos dosis.
En el grupo E dos pacientes presentaron hipotensión como complicación intraoperatoria y ningún paciente presentó complicaciones en el posoperatorio inmediato. En el grupo C ningún paciente presentó complicaciones intraoperatorias y en nueve se registraron complicaciones posoperatorias como hipertensión arterial y arritmias, que respondieron inmediatamente al tratamiento.
Discusión
El estado de protección neurovegetativa intraoperatorio se evaluó a través de variables hemodinámicas como expresión de la analgesia intraoperatoria o grado de nocicepción. En la presente investigación se pudo comprobar que tanto la TAM, la FC y el IS tuvieron una tendencia a mantenerse por debajo de la media global sobre todo entre los 10 y los 100 min en el grupo que se administró magnesio. De igual forma se comportó el IP, que aumentó y mantuvo esa tendencia en los pacientes que se les administró el magnesio.
Esto corrobora lo publidado por Ghezel V y otros,13 sobre el grado de protección y estabilidad hemodinámica que brinda el sulfato de magnesio. Por su parte, Seyhan TO y otros,14 estudiaron 80 mujeres intervenidas por cirugía ginecológica, divididas en cuatros grupos; un grupo control que se le adminstró placebo y otros tres a los que se les administró sulfato de magnesio a dosis de 40, 20 y 10 mg/Kg. Sus resultados mostraron una disminución de la tensión arterial media en los grupos de magnesio comparados con el grupo control, sobre todo a los 60 y 90 min (p<0,001 y p<0,05, respectivamente) y más evidente en el grupo que recibió la dosis de 20 mg/Kg. La frecuencia cardíaca se comportó de igual forma, con valores más bajos en el grupo que recibió una dosis de 20 mg/Kg respecto al resto de los grupos y a partir de los 15 min en adelante. Solo cuatro pacientes fueron tratados con atropina para la bradicardia y en nigún caso hubo necesidad de usar efedrina para tratar la hipotensión. Resultados que fueron similares a los encontrados en la presente investigación.
La investigación de Wei T y otros,15 tuvo como objetivo evaluar si diferentes dosis de sulfato de magnesio podían atenuar eficazmente los cambios hemodinámicos relacionados con el neumoperitoneo y la liberación de vasopresina en pacientes bajo cirugía gastrointestinal laparoscópica. Sesenta y nueve pacientes fueron aleatorizados en tres grupos: el grupo L recibió sulfato de magnesio en dosis de carga de 30 mg/kg seguido de infusión continua de 15 mg/kg/h durante una hora; el grupo H recibió 50 mg/kg de sulfato de magnesio seguido de 30 mg/kg/h durante una hora; y el grupo S (grupo de control) recibió el mismo volumen de infusión de solución salina al 0,9 %, inmediatamente antes de la inducción del neumoperitoneo. Midieron la resistencia vascular sistémica, el gasto cardíaco, la presión arterial media, la frecuencia cardíaca, la presión venosa central, los niveles de vasopresina sérica y las concentraciones de magnesio. También evaluaron el tiempo de extubación y la escala analógica visual. La presión arterial media, la resistencia vascular sistémica, la presión venosa central y el nivel de vasopresina sérica fueron, significativamente, menores (p<0,05) y el gasto cardíaco fue, significativamente, mayor (p<0,05) en el grupo H que en el grupo de control. Por otro lado, la presión arterial media, la resistencia vascular sistémica y la presión venosa central fueron significativamente más bajas en el grupo H que en el grupo L (p <0,05). La escala analógica visual a los 5 y 20 min, el nivel de vasopresina y la dosis de remifentanilo disminuyeron en el grupo H en comparación con el grupo de control y el grupo L (p<0,01). Por esas razones pudieron concluir que el sulfato de magnesio puede atenuar de manera segura y eficaz la inestabilidad hemodinámica relacionada con el neumoperitoneo durante la laparoscopia gastrointestinal y mejorar el dolor posoperatorio a concentraciones de magnesio sérico por encima de 2 mmol/L.
Rodríguez Rubio y otros,16 concluyeron que el uso del sulfato de magnesio perioperatorio disminuye los requerimientos anestésicos intraoperatorios tanto para fármacos opioides, bloqueantes neuromusculares e hipnóticos; atenúa la respuesta hemodinámica a la intubación orotraqueal con un valor de presión arterial media y frecuencia cardiaca posintubación menor.
Por su parte, Mahajan y otros,17 usaron el sulfato de magnesio para atenuar la respuesta refleja simpática a la laringoscopia e intubación endotraqueal y otras situaciones de riesgo hipertensivo; mientras otros autores lo han utilizado con buenos resultados para la hipotensión controlada intraoperatoria.18,19
El magnesio tampoco causa taquicardia refleja cuando se usa como agente hipotensor en el período intraoperatorio, no produce hipertensión refleja y no disminuye el gasto cardíaco. Esto lo demostraron Elsharnouby NM y otros,20 en un estudio clínico, aleatorizado y doble ciego controlado con placebo, realizado con 60 pacientes programados para la cirugía endoscópica, donde evidenciaron valores, significativamente, bajos de FC y TAM, en el grupo que recibió sulfato de magnesio contra el grupo control.
Por otro lado, se sabe que el magnesio puede inducir hipotensión directamente por vasodilatación, así como indirectamente por bloqueo simpático e inhibición de la liberación de catecolaminas. Sin embargo, en la presente investigación hubo disminución significativa de las variables hemodinámicas con respecto al grupo C, pero sin caer en el rango de la anormalidad; por lo tanto, ningún paciente requirió tratamiento médico por estas causas. Se considera que esto se debe a la dosis que se utilizó para mantenimiento de 10 mg/Kg/hora, dosis que se aproxima a casi todo lo recogido en la literatura.14,21
El elevado consumo intraoperatorio de opioides es un factor de riesgo para el uso prolongado de opioides después de cirugía mayor, así como de los estados de hiperalgesia posoperatoria inducida por opioides.22,23
Albrecht E y otros,24 realizaron una revisión sistemática cuantitativa con el objetivo de evaluar si la administración perioperatoria de magnesio intravenoso puede reducir el dolor posoperatorio. Se identificaron veinticinco ensayos que comparan magnesio con placebo. Independientemente del modo de administración (bolo o infusión continua), el magnesio perioperatorio redujo el consumo acumulado de morfina intravenosa en un 24,4 % (diferencia media: 7,6 mg, IC del 95 %: -9,5 a -5,8 mg; p<0,00001) a las 24 h del posoperatorio. Las puntuaciones numéricas de dolor en reposo y en movimiento a las 24 h del posoperatorio se redujeron en 4,2 (IC del 95 %: -6,3 a -2,1; p <0,0001) y 9,2 (IC del 95 %: -16,1 a -2,3; p=0,009) de 100, respectivamente. Concluyeron que el magnesio intravenoso perioperatorio reduce el consumo de opioides y, en menor medida, las puntuaciones de dolor en las primeras 24 h del posoperatorio, sin que se hubieran informado efectos adversos graves.
En la presente investigación, a pesar que todos los pacientes requirieron la administración de fentanil intraoperatorio, los pacientes que recibieron magnesio tuvieron menor consumo de fentanil en relación a número de dosis y cantidad de microgramos significativamente menor con respecto al grupo C. Lo que confirma los resultados de estudios previos sobre el efecto potenciador de la analgesia del sulfato de magnesio.11,12,21,24
En relación con la intensidad del dolor posoperatorio los resultados de diferentes estudios no son concluyentes, le dan cierto valor al sulfato de magnesio para el dolor crónico oncológico y el no oncológico, pero en estudios relacionados al dolor agudo posoperatorio hay variabilidad en cuanto al efecto analgésico. En el presente estudio la analgesia posoperatoria no mostró diferencias significativas al término de la intervención quirúrgica entre los grupos. Sin embargo, en el grupo C hubo pacientes que refirieron dolor leve a moderado después de la primera hora del posoperatorio. Lo que tuvo relación directa con la necesidad de rescate en el posoperatorio, mayor para el grupo C de manera significativa.
Fuentes Díaz Z y otros,25 estudiaron la efectividad adyuvante del sulfato de magnesio en 180 pacientes de 60 años y más intervenidos por fractura de cadera en el Hospital General Docente “Manuel Ascunce Domenech” de la provincia Camagüey, en un período de cuatro años. Crearon dos grupos de 90 pacientes cada uno, un grupo de estudio al que le administraron preoperatoriamente una dosis de 30 mg/Kg de sulfato de magnesio para continuar durante el intraoperatorio con 10 mg/Kg/h. Al grupo control no se le administró el magnesio. Evaluaron parámetros vitales perioperatorios (TAM, FC, presión del pulso y FR) y duración de la analgesia. No obtuvieron diferencias significativas en los parámetros vitales; sin embargo, la duración de la analgesia a las 12 h del posoperatorio fue siete veces mayor en los del grupo de estudio con respecto al control.
Flores G26 evaluó la eficacia del sulfato de magnesio como coadyuvante en la analgesia posoperatoria en pacientes intervenidos por colecistectomía abierta. Realizó un ensayo clínico controlado simple ciego con una muestra de 50 pacientes aleatorizados en dos grupos: grupo experimental que recibió sulfato de magnesio a 50 mg/kg más ketoprofeno 100 mg y grupo control que recibió solo ketoprofeno 100 mg. La intensidad basal del dolor fue menor en el grupo experimental. Las dosis analgésicas de rescate requeridas fueron superiores en el grupo control (p< 0,05). El 62,5 % de los pacientes del grupo control con EVA mayor a 4 ameritó medicación de rescate entre 30 min a 12 h poscirugía y el 37,5 % de los pacientes del grupo experimental la requirió entre 8 a 24 h (p<0,05). Los resultados evidenciaron que el sulfato de magnesio es una alternativa efectiva en el tratamiento del dolor posoperatorio, lo cual fue similar a la presente investigación.
Sousa AM y otros,27 realizaron otro ensayo clínico controlado doble ciego en 60 mujeres bajo cirugía oncológica ginecológica laparoscópica y compararon el efecto analgésico de la infusión intravenosa de sulfato de magnesio con el ketorolaco. En un grupo administraron 30 mg en bolo intravenoso de ketorolaco seguido de infusión de solución salina (grupo K), en un segundo grupo sulfato de magnesio intravenoso 20 mg/kg en bolo seguido de una infusión de 2 mg/kg/h (grupo M) y en el tercer grupo solución salina intravenosa 20 ml en bolo seguido de infusión salina durante todo el procedimiento (grupo S). El sulfato de magnesio redujo el consumo de opioides en comparación con el placebo en el posoperatorio, pero no en el intraoperatorio. La intensidad del dolor fue mayor en el placebo que en los otros dos grupos durante todos los períodos de observación. En los primeros 60 min, la intensidad del dolor fue menor en el grupo de magnesio que en el grupo de ketorolaco o placebo. Concluyeron que el sulfato de magnesio intraoperatorio mejora el control del dolor posoperatorio, actúa como adyuvante ahorrador de opioides, y es similar al ketorolaco administrado al inicio de la cirugía.
Las complicaciones descritas asociadas al uso del sulfato de magnesio en el perioperatorio están dadas por sus interacciones farmacológicas, como en el caso de los bloqueadores neuromusculares y en menor medida por sus efectos farmacodinámicos. Entre estos últimos los más citados son la bradicardia dosis dependiente, la hipotensión y el paro sinusal, sobre todo cuando se utilizan dosis por encima de 30 mg/Kg.28 Por esta razón se recomienda mantener una concentración plasmática de 1,5 a 2,5 mg/dL, ya que los efectos adversos aparecen a concentraciones plasmáticas mayores a 4 µmol/L. En general se sabe que la depresión respiratoria ocurre con concentraciones mayores a 6 µmol/l y el paro cardiaco por arriba de 8 µmol/L.16
En la presente investigación se comprobó que el grupo de pacientes que recibieron sulfato de magnesio no presentaron efectos adversos en el posoperatorio inmediato a diferencia de los pacientes del grupo C. Estos resultados guardan correspondencia con los expuestos por Trejos E,29 quien refiere entre, otros aspectos, que el uso del sulfato de magnesio disminuye el requerimiento de dosis analgésicas de rescate sin ocasionar reacciones adversas secundarias a su administración lo que significa que tiene un gran valor como adyuvante analgésico, sin producir efectos secundarios.
Se concluye que la administración de sulfato de magnesio resultó efectivo y seguro, pues brindó mayor analgesia perioperatoria, estabilidad hemodinámica, menor consumo de opioides intraoperatorio y menor rescate analgésico posoperatorio que cuando no se usó. La incidencia de complicaciones fue baja y sin repercusión clínica.