Introducción
La infección por el virus SARS-CoV-2 se caracteriza por poseer un amplio espectro de síntomas clínicos y enfermedad leve del tracto respiratorio superior. Algunos pacientes en su presentación clínica más grave desarrollan síndrome de dificultad respiratoria aguda (SDRA), representa el estado más crítico de la enfermedad, requiere el ingreso en la Unidad de Cuidados Intensivos (UCI) y el aporte de ventilación mecánica artificial (VMA) de preferencia invasiva.1,2
Un informe reciente de colaboración entre China y la Organización Mundial de la Salud (OMS), reportó que de 555 mil 924 casos confirmados de COVID-19 en ese país, el 6,1 % presentó una condición muy crítica y el 13,8 % mostró manifestaciones clínicas tales como disnea, frecuencia respiratoria >30 respiraciones por minuto, aumento de infiltrados pulmonares > 50 % en las primeras 48 h del inicio de los síntomas y bajos niveles en la relación presión parcial de oxígeno (PaO2) y fracción inspiratoria de O2 (FiO2) [PaO2/FiO2]. Lo que generó traslado y tratamiento en la UCI.3
La mortalidad de los pacientes con COVID-19 se ha concentrado fundamentalmente en los ingresados en estas unidades y muy especialmente en aquellos que requirieron ventilación mecánica por SDRA. Ferrando y otros4 señalaron que la mortalidad a los 28 días es del 32 % en una serie de 742 pacientes de 36 hospitales. Xie y otros5 encontraron una mortalidad a los 28 días del 53,8 % en una muestra de 733 pacientes/UCI de 19 hospitales.
Al igual que otros países, México comenzó a experimentar una tercera ola de hospitalizaciones por la enfermedad del COVID-19, por lo que ocupa el cuarto lugar a nivel mundial en número de muertes por la pandemia, después de Estados Unidos, Brasil e India. Desde finales de mayo hasta el 20 de agosto de 2021, durante la fase de crecimiento exponencial, en el análisis un total 65 952 pacientes el 8,5 % requirieron VMA (p < 0,001). La mortalidad hospitalaria de los pacientes con enfermedad por coronavirus 2019 que requirieron ventilación mecánica invasiva se mantuvo por encima del 82 %.6,7
La IRA se define como la incapacidad del aparato respiratorio para mantener un adecuado intercambio gaseoso, necesario para satisfacer las necesidades metabólicas del organismo. Como forma de presentación de tal gravedad, se encuentra el SDRA, un daño pulmonar inflamatorio agudo y difuso, que conlleva al aumento de la permeabilidad vascular, del peso pulmonar, pérdida del tejido aireado, aumento del espacio muerto fisiológico y disminución de la distensibilidad pulmonar (DstP).8
Actualmente la VMA es la piedra angular para el tratamiento del SDRA. Sus inicios se remontan al concepto de respiración artificial descrito en el siglo xvi de mano de Andreas Vesalius. Sin embargo, es en el siglo xx cuando se promueve a utilizar como medida terapéutica. Sus ajustes son destinados a intentar restaurar parcialmente la pérdida en el volumen pulmonar aireado y revertir el deterioro en la oxigenación. Representa un método terapéutico que permite modificar las presiones intrapulmonares.9,10,11,12
El objetivo de la VMA en el SDRA consiste en asegurar el adecuado intercambio de gases, minimizando el riesgo de daño pulmonar. Aunque es constante el flujo de estudios que intentan esclarecer el óptimo ajuste de los parámetros ventilatorios, continúa siendo un reto.13
La VMA no está exenta de efectos secundarios, por lo que es necesario establecer parámetros de seguridad para evitar complicaciones, como es la lesión pulmonar inducido por el ventilador (LPIV). Este fenómeno es clínicamente indistinguible de las lesiones producidas por otras causas. Los mecanismos principales del tipo de daño pulmonar son: volutrauma (aplicación de volúmenes tidal altos en la vía aérea), barotrauma (aplicación de presiones elevadas en la vía aérea), atelectrauma (daño pulmonar por colapso alveolar repetitivo), biotrauma y más recientemente descrito, el ergotrauma.14
La presión de distensión alveolar (driving pressure [DP] por sus siglas en inglés) es definida como la relación del volumen tidal (Vt) con la DstP, o sea, la relación entre el Vt y el tamaño funcional del pulmón, más que con el peso corporal ideal (IBW por sus siglas en inglés). Es una herramienta disponible para estimar la tensión dinámica del pulmón, además, se puede utilizar como variable complementaria para titular la presión positiva al final de la expiración (PEEP) evitando la sobre-distensión alveolar. Su utilización se ha asociado con la sobrevida en pacientes ventilados con SDRA. También ayuda a identificar el riesgo de la LPIV. Se recomienda utilizar DP, no como un objetivo, sino como un parámetro de seguridad a estimar al lado del paciente para optimizar la ventilación mecánica.15,16
Ante la necesidad de establecer estrategias de protección pulmonar que mejoren la sobrevida en pacientes ventilados con patologías pulmonares graves como el SDRA, se realiza esta revisión narrativa. Se sustenta en lo descrito sobre el tema a la luz de la medicina basada en la evidencia. Por tanto, el objetivo fue actualizar contenidos referentes a la DP en el SDRA y otros escenarios clínicos. Los elementos descritos pueden ser útiles en la implementación de esta variable en todas las instituciones hospitalarias del país.
Métodos
Estrategia de búsqueda y criterios de selección
Se realizó una revisión narrativa de la literatura mediante una búsqueda sin restricciones en idiomas español e inglés. El período de búsqueda incluyó los últimos 10 años.
Se realizó una pesquisa en las bases de datos de SciELO, Pubmed/Medline, Google académico, en los idiomas en español e inglés. Se utilizaron como descriptores los siguientes: “mechanic ventilation”, “acute respiratory distress syndrome”, “COVID-19”, “mortality” y sus traducciones al español.
Los criterios de inclusión fueron los artículos de acceso libre, originales, revisiones narrativas y sistemáticas (con/sin meta-análisis), ensayos clínicos, editoriales, casos clínicos, cartas al editor/director y documentos de consenso. Se excluyeron para la presente revisión los artículos resúmenes y aquellos que describen el tema en la población pediátrica.
Se seleccionaron 65 referencias que cumplieron con los criterios de selección.
Protección pulmonar en pacientes ventilados
La importancia de proteger al pulmón se enfatiza por las consecuencias de su daño. El término biotrauma se ha acuñado para describir el concepto de que el daño pulmonar puede contribuir a la lesión de órganos remotos y al fallo de órganos multisistémicos a través de liberación de factores inflamatorios y otros mediadores. Por lo tanto, la optimización de la configuración de la VMA puede tener beneficios más allá de la protección pulmonar y puede proteger la función sistémica de los órganos.17,18
Durante la actual pandemia se ha evidenciado una mayor incidencia de complicaciones pulmonares durante la VMA como es el caso del barotrauma.19)
Estudios realizados por Xyang20 y Yang21 informan una incidencia de barotrauma de 3,1 % en pacientes ventilados con COVID-19, y de 3,8 % de los pacientes respectivamente. Ninguna de estas publicaciones realizó una serie de casos de barotrauma con informes detallados sobre su presentación, tratamiento o entornos ventilatorios.
Sin embargo, se ha demostrado que los pacientes con SDRA resultante de la neumonía por el virus SARS-Cov-2 pueden desarrollar barotrauma temprano, ya que generalmente requieren alta PEEP para mantener oxigenación, aumentando así el riesgo de esta complicación. Los informes de casos de China también describieron neumomediastino en pacientes con COVID-19.22
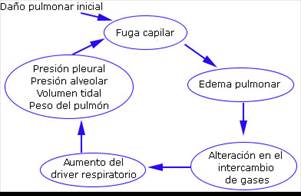
Brochard y otros23 describe el mecanismo del daño auto infligido y lo compara con el daño realizado por el ventilador al proporcionar grandes Vt. Este daño es generado por el mismo paciente, desarrollado en respuesta a la exigencia de un drive respiratorio hiperactivo con necesidad de satisfacer las demandas de oxigenación. A esto se suma una bomba respiratoria dispuesta a poner su mayor esfuerzo en lograr estos objetivos (Fig. 1).
La multiplicidad de los factores responsables de la injuria pulmonar en el paciente con COVID-19 que es llevado a VMA obliga a establecer metas muy específicas durante el soporte respiratorio. Es recomendado en pacientes con SDRA, la vigilancia de variables como la presión meseta (Pm), el nivel de PEEP óptimo, la frecuencia respiratoria y la DP, esta última de gran importancia en la actualidad.24
En el tratamiento del SDRA se ha abogado el uso de estrategias de protección pulmonar, de modo que se evite la LPIV, las cuales están destinadas a reducir las complicaciones de la ventilación mecánica. Tienen como objetivo mantener una ventilación en pulmones con DstP baja, basados en los siguientes parámetros ventilatorios: presión plateau (Pplt) por debajo de 35 cmH2O (idealmente por debajo de 30 cmH2O), una DP < 15 cmH2O y un Vt bajo (6 ml/kg).25,26
En el SDRA, la proporción de alvéolos disponibles para la ventilación se reduce notablemente. Se refleja una disminución de la compliance del sistema respiratorio (Crs); por lo tanto, una relación del Vt según la Crs sería un mejor predictor del pronóstico, comparado solo con el Vt. Esta relación se manifiesta como la DP, que puede ser obtenida fácilmente y de manera rutinaria en los pacientes que no están generando esfuerzo inspiratorio.
Presión de distensión alveolar, elementos fisiopatológicos de interés
La Pm o presión plateau (Pplt) representa la suma total de la presión entregada por el Vt y la PEEP. La DP refleja la presión a la que está sometida la vía aérea para vencer el retroceso elástico del sistema respiratorio a medida que el Vt es insuflado, por lo que permitiría estimar si el Vt aplicado con un nivel de PEEP dado es efectivamente protector.27
El ajuste en la configuración mediante una DP específica ha avanzado, es un método que puede minimizar el posterior daño pulmonar y una clave determinante en el Vt entregado.
La distinción entre la DP y presión trans-pulmonar (Ptp) es importante, ya que la primera refleja la diferencia de presión dentro del pulmón en una respiración, en contraposición a la última que refleja la diferencia de presión a través del pulmón. Se supone que ambos valores están implicados en el estrés pulmonar, aunque la presión transpulmonar transmite más directamente este concepto. La DP, aunque se mide directamente desde el ventilador, es una función tanto del Vt como de la DstP. El aumento del Vt y una disminución de la DstP (pulmón y pared torácica) pueden aumentar la DP. De manera similar, la DP aumenta con una Pm más alta, así como una PEEP más baja, en igualdad de condiciones. Por lo tanto, los médicos en la práctica deben conocer los componentes de la DP y considerar los mecanismos subyacentes en lugar de tratar una sola variable de forma aislada.28
Medición de la DP
Para su medición es necesario el cálculo del valor de la Pm y el valor de la PEEP (Fig. 2).
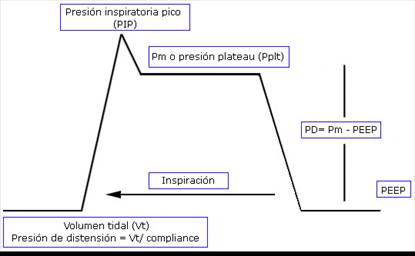
Fig. 2 Diagrama de forma de onda inspiratoria durante la ventilación mecánica controlada por volumen. La Pm se basa en una pausa inspiratoria. La DP se puede ver como la diferencia entre Pm y la PEEP, además, se puede calcular como la relación entre Vt y la Crs.
Durante la ventilación controlada, cuando el paciente se encuentre sin esfuerzo respiratorio, sin asincronías y sin hiper-insuflación dinámica evidente, la DP se determina con mayor precisión, obteniéndose por la diferencia entre Pm menos PEEP. También puede ser expresada como el cociente del Vt entre la distensibilidad del sistema respiratorio (Vt/Crs). Una pausa inspiratoria de 2 a 3 segundos es suficiente para calcular la Pm, mientras que el valor del PEEP es el programado en lugar del PEEP total29,30) (Fig. 3).
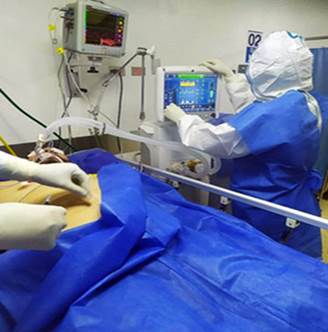
Fig. 3 Monitoreo gráfico de la Pm y PEEP, para el cálculo de la DP. Paciente con SDRA/COVID-19 severo, sin esfuerzo respiratorio, con VMA controlada por volumen. Se constata riesgo elevado de estrés pulmonar, con una DP calculada superior a 18 cmH2O. Unidad de Cuidados Intensivos del Hospital Universitario de Maracaibo, Venezuela.
La Pm es la presión existente en los alvéolos cuando el flujo es igual a 0 cmH2O, su máximo valor debe ser inferior a 30 cmH2O. Se consigue dando una breve pausa tele inspiratoria al final de la inspiración. Si el valor de la DP es superior a 15 cmH2O significa que el paciente está cursando con injuria pulmonar o problemas de la distensibilidad pulmonar, que pueden ser solucionadas con elevación de la PEEP, disminución del Vt o cambio en el modo ventilatorio donde la variable de control sea la presión. Una secuencia propuesta de protección alveolar en paciente con SDRA severo en VMA sería:31
Programar modo de VMA Asisto-controlado por volumen (Vt: 6-8 mlKg de peso predicho y PEEP inicial: 5-8 cmH2O).
Medir Pm y DP (si DP ≤ 13 cmH2O: Protección alveolar. si DP ≥ 13 cmH2O: disminuir Vt, optimizar PEEP, considerar uso de decúbito prono y repetir la estrategia).
La DP puede ser una herramienta valiosa para la titulación de la PEEP, independientemente de la estrategia utilizada. Una disminución en la DP después de aumentar la PEEP reflejará reclutamiento y disminución de la tensión cíclica. Por el contrario, un aumento en la DP sugerirá un pulmón no reclutable, en el que prevalece la distensión sobre el reclutamiento. Se debe considerar el impacto sobre la DP cuando se realizan cambios en los niveles de PEEP.32,33,34
En el contexto de la actual pandemia, donde la incidencia del SDRA es variable y las conductas ventilatorias son vitales para el manejo de pacientes en estado crítico, se han realizados enfoques de parámetros ventilatorios siguiendo las recomendaciones actuales sobre la DP y conductas sobre el riesgo elevado de injuria pulmonar con valores superior a 15 cmH2O. En la experiencia de los autores de esta comunicación, se han logrado metas de oxigenación y estabilidad ventilatoria, tras el reajuste de la PEEP, Vt y posición del paciente en el lecho, alcanzando una disminución en los días de soporte ventilatorio (Fig. 4).
Factores influyentes en la medición de la DP
La DP básicamente revela el grado de estiramiento pulmonar durante la entrega del Vt en cada respiración. Esta se ve afectada por la elastancia de la pared torácica, que puede variar marcadamente entre los pacientes. Por eso se debe realizar una meticulosa revisión de las variables mientras se evalúa la DP para estimar las características del pulmón.
Medir la DP en una modalidad ventilatoria asistida o espontánea puede no ser exacto en comparación con la ventilación controlada. La presiones de las vías respiratorias suministrada por el respirador artificial durante las respiraciones asistidas es siempre menor en comparación con una respiración totalmente controlada.35
Fisiológicamente hay una fluctuación masiva en la presión transpulmonar durante cualquier esfuerzo espontáneo debido a una fuerza inspiratoria de esfuerzo, que puede contribuir a mostrar valores diversos. Sin embargo, cuando la DP se mide desde la Pm cuando el flujo no es cero, la presión trans pulmonar dinámica refleja las propiedades elásticas de la pared torácica, así como la resistencia de las vías respiratorias. Esto es evidencia de que la resistencia de las vías respiratorias varía considerablemente con los cambios en el flujo, lo que afectará la medición de la DP hasta cierto punto. En el transcurso de una respiración asistida, el paciente realiza una parte del trabajo respiratorio por lo tanto, la Pm medida puede limitar una medición indirecta de la DP.36,37
La estimación de la DP cuando el paciente se encuentra ventilado en una modalidad asistida o espontánea y se realiza una pausa inspiratoria puede generar lo siguiente:30
Si el paciente no tiene esfuerzo espontáneo resulta en una disminución de la presión inspiratoria (que representa la presión generada por el volumen pulmonar estático).
En cambio cuando se realiza la pausa inspiratoria durante presión positiva con esfuerzo espontáneo resulta en un incremento de la presión de las vías aéreas, el cual es la verdadera Pm (que refleja el tamaño del Vt y la contribución adicional escondida del esfuerzo espontáneo).
DP y su relación con la supervivencia en el SDRA
En pacientes con SDRA, en los que se aplicaron estrategias ventilatorias de acuerdo con lo propuesto por la ARDS-net, el uso de Vt bajos provocó una disminución de la DP y de la presión transpulmonar, argumentando que la limitación del Vt disminuye todos los mecanismos físicos implicados en la génesis de LPIV.38,39
La DP proporciona una imagen de la mecánica pulmonar óptima en SDRA lo que estima el Vt corregido por compliance respiratoria en el estado de la enfermedad, en lugar de basarse únicamente en el IBW y demuestra una asociación entre DP y la mortalidad en el SDRA.40,41,42
Ha recibido considerable atención la DP al ser la variable de mejor correlación con la supervivencia en los pacientes que padecen SDRA, pues representa la ecuación física y fisiológica del movimiento que rige el desplazamiento de gases durante la ventilación controlada. De acuerdo con este sustento, se considera como un límite de seguridad más que un objetivo al interpretar el Vt corregido para la distensibilidad estática pulmonar y al disminuir la tensión mecánica suscitada durante la ventilación.27,29
Las evidencias sobre la medición de la DP y los resultados de investigaciones han demostrado que está fuertemente asociado al riesgo de daño pulmonar y a la mortalidad en pacientes con SDRA en ventilación mecánica. Blondonnet y otros43 publicaron recientemente un estudio observacional multicéntrico prospectivo de pacientes con riesgo de desarrollar SDRA mediante el análisis de la DP al inicio del estudio y a las 24 h siguientes. Se inscribieron 221 pacientes, de los cuales el 15 % desarrolló SDRA el día 7 (tiempo medio). Estos pacientes tuvieron mayor DP de referencia (media 15,6 cmH2O, p < 0,001). El análisis sugiere que una DP > 16,5 cmH2O es predictiva del desarrollo de SDRA (p < 0,001) con especificidad del 90 %. Del mismo modo, una DP de referencia < 7,5 cmH2O fue muy sensible al predecir quiénes no desarrollaría SDRA. Este estudio apunta a la DP elevada como marcador de riesgo del daño pulmonar.
Se ha sugerido que la DP a través del sistema respiratorio sea el predictor más fuerte de mortalidad hospitalaria en pacientes con SDRA. En un informe realizado por Amato y otros donde hace mención de la DP y su asociación con la mortalidad; la DP adquiere validez demostrada no solo como parámetro de seguridad en pacientes con VMA, sino que fue el mejor predictor de mortalidad, al compararla con la Pm y la Crs. También se determinó que el aumento en la mortalidad fue significativamente mayor al superar el umbral de 15 cmH2O, por lo que se sugirió mantener los valores de DP menores a esta cifra.40,44
Cavalcanti y otros45 realizaron un estudio controlado, aleatorizado y multicéntrico de 1010 pacientes, cuyo objetivo primario fue evaluar la mortalidad a los 28 días de los pacientes con SDRA moderado a severo. Otros objetivos fueron los días de estancia en UCI, la estadía hospitalaria y los días libres de VMA. Para ello emplearon una estrategia experimental con una maniobra de reclutamiento pulmonar y titulación de PEEP, según la mejor distensibilidad pulmonar, o bien, una estrategia de control con PEEP bajo.
Los resultados demostraron que la estrategia del grupo experimental aumentó la mortalidad; sin embargo, disminuyó el número de días sin VMA (5,3 Vs 6,4 días, IC: 95 % 2,1- 0,1; p = 0,03). En el análisis de las variables respiratorias durante los primeros siete días de la intervención, la DP fue más baja en los primeros (grupo experimental: 11,5, 11,7, 12,1 y 12,5 vs 13, 13,5, 13,5 y 13,6 del grupo control). Por esta razón se infiere con el análisis de los resultados que mantener una PD más baja está asociado con la disminución de los días de ventilación mecánica en pacientes con SDRA.
El estudio observacional de Villar y otros46 en 778 pacientes con SDRA moderado a grave tuvo como objetivo identificar los factores de riesgo asociados a la mortalidad según los valores de Vt, PEEP, Pm y DP estimados 24 h después del diagnóstico del SDRA mientras se ventilaba con ventilación protectora pulmonar estandarizada. Se derivó en modelos utilizando datos individuales de 478 pacientes con SDRA y se evaluó su replicabilidad en una cohorte separada de 300 pacientes con SDRA. El Vt y la PEEP no influyeron en la mortalidad, se identificó un valor de cohorte de Pm de 29 cmH2O, por encima del cual un incremento ordinal iba acompañado de un incremento del riesgo de muerte. Además, la DP ≥ 19 cmH2O estuvo acompañado de un riesgo mayor de mortalidad. Cuando se realizó una tabulación cruzada de pacientes con Pm mayor o igual y menor de 30 cmH2O y una DP ≥ 19 cmH2O, la Pm proporcionó una predicción del resultado ligeramente mejor que la DP tanto en cohorte de derivación como en la de validación (p < 0,001).
En un ensayo adicional del LUNG SAFE,47 estudio centrado en los factores de riesgo potencialmente modificables para mortalidad en el SDRA se analizaron datos de 2377 pacientes ventilados de forma invasiva diagnosticado el día 1 (n = 2243) o el día 2 (n = 134) después el desarrollo de la falla y del inicio de la VMA. La mortalidad hospitalaria fue del 35 % en pacientes con SDRA leve, 40 % en SDRA moderado y 46 % en el severo. El análisis multivariado reveló que la Pm < 25 cmH2O en el SDRA grave (RR: 0,69, IC 95 %: 0,49-0,97) y una DP ≤ 14 cmH2O tanto en el SDRA moderado (RR: 0,75; IC 95 %: 0,59-0,96) como en grave (RR: 0,67; IC 95 %: 0,47-0,95) se asociaron a un menor riesgo de mortalidad.
Se han realizado varias investigaciones con la intención de demostrar que la DP se asocia a desenlaces clínicos relevantes en otros escenarios clínicos relacionados o no al SDRA.
Oxigenación por membrana extracorpórea (ECMO, siglas en inglés)
Durante los últimos años, el uso de ECMO se ha generalizado, es utilizada como terapia de rescate en pacientes con SDRA por la refractariedad de la hipoxemia. El proceder permite mejor oxigenación y eliminación de dióxido de carbono (CO2), favorece la recuperación pulmonar y la resolución de la enfermedad subyacente.
Gruta y otros48 en un estudio retrospectivo, tuvo como objetivo evaluar la asociación de la mortalidad con DP en pacientes en ECMO y comparar el cambio en DP antes y después del inicio de ECMO. En el análisis univariado, una DP más alto en ECMO fue asociado con un aumento en las probabilidades de mortalidad a 30 días (OR 1,09, CI 95 %: 1,03-1,16, p = 0,002) entre todos los pacientes con ECMO. Esa asociación fue significativa entre aquellos con SDRA (OR 1,10, IC 95 %: 1,00-1,21, p = 0,034) y aquellos sin SDRA (OR 1,04; IC 95 %: 1,04-1,24, p = 0,004). En el análisis multivariable, una DP más alto en pacientes con ECMO fue significativamente asociado con un aumento en la mortalidad después del ajuste de variables como edad, sexo, ECMO con acceso veno-arterial/veno-venosa (VA / VV-ECMO) y días en el hospital antes del inicio de ECMO, (OR: 1,15, IC 75 %: 1,07-1,24, p ≤ 0,001).
Los datos interesantes de este estudio indican que todavía hay un potencial significativo de mejora mediante la corrección de factores modificables asociados con aumento de la mortalidad, incluida la DP.
Cheu y otros49 en su estudio sobre pacientes con SDRA grave que recibieron ECMO, donde se analizaron los ajustes seriales del respirador mecánico antes y después de la ECMO y los factores asociados a la supervivencia; demostró que después del inicio del poyo con ECMO los no supervivientes tuvieron una DP significativamente mayor hasta el día 7 que los supervivientes, y que una DP más alta durante los primeros 3 días de con ECMO se asoció de forma independiente en la mortalidad en UCI (OR: 1,070; IC 95 %: 1,026-1,116; p = 0,002).
Neurocríticos
En pacientes neurocríticos con VMA, el desarrollo del SDRA es un factor importante que contribuye a la morbi-mortalidad, por lo que es importante una estrategia de ventilación protectora. Se recomienda la administración de Vt de 6-7 ml/kg para mantener una Pm de menos de 25 cmH2O y una DP de menos de 15 cmH2O.50
Tejerina E y otros51 en su análisis multivariado evaluaron la asociación del Vt, el nivel de PEEP y la DP con el desarrollo de SDRA en una población de pacientes con daño cerebral. Se incluyeron 986 pacientes ventilados mecánicamente por daño cerebral agudo (ictus hemorrágico, isquémico o traumatismo craneoencefálico). La incidencia de SDRA fue del 3 %, si bien la incidencia de SDRA era muy baja, se asoció con un aumento de la mortalidad, una mayor duración de la ventilación mecánica y una mayor duración de la estancia en la UCI. Los pacientes que desarrollaron SDRA presentaron niveles de PD por encima de 14 cmH2O (OR 1,12; IC del 95 %: 1,01 a 1,23), mientras que no se observan asociación para el volumen corriente o nivel de PEEP, siendo un dato significativo al ser un factor que puede ser modificado.
Anestesia general
Los procedimientos quirúrgicos son intervenciones médicas muy comunes, pueden ser electivas o de emergencia, requiriendo anestesia general y soporte ventilatorio en un gran porcentaje de los casos.
Neto y otros52 publicaron un meta-análisis de 17 ensayos controlados aleatorios de ventilación protectora (n = 2250) en pacientes quirúrgicos. El análisis sugirió que la DP se asoció con el desarrollo de complicaciones pulmonares posoperatorias (p < 0001), no así con el Vt (p = 0,179) o la PEEP. La razón de probabilidades de las complicaciones pulmonares posoperatorias fue de 1,16 para cada aumento de 1 cmH2O en la DP (IC 95 %: 1,13-1,19). La DP fue el único mediador significativo de los efectos de la ventilación protectora sobre el desarrollo de complicaciones pulmonares (p = 0,027). La PEEP alta con aumento de la DP se relacionó con un mayor riesgo de enfermedad pulmonar posoperatoria (OR: 3,11; IC 95 %: 1,39-6,96; p = 0,006) en comparación con el grupo de PEEP baja. Una titulación alta de PEEP con disminución de la DP, se asoció a menor complicaciones pulmonares (OR: 0,19; IC 95 %: 0,02-1,50; p = 0,154) en comparación con PEEP baja. Estos resultados demuestran que mantener niveles más bajos de DP se asocia con mejores resultados pulmonares en la etapa posquirúrgica. Lo que podría disminuir el tiempo de la VMA para este tipo de pacientes.
Recientemente se ha sugerido que la complicación pulmonar está relacionada con la DP más que cualquier otro parámetro ventilatorio.
Park y otros53 en un ensayo aleatorizado y controlado incluyeron 292 pacientes programados para cirugía torácica electiva. Se comparó la ventilación protectora convencional (n = 147) con la VMA guiada por DP (n = 145). El grupo de ventilación protectora convencional durante la ventilación unipulmonar, se prefijó un Vt de 6 ml/kg de IBW, PEEP: 5 cmH2O y maniobra de reclutamiento, el otro grupo recibió el mismo Vt y reclutamiento, pero con PEEP individualizada que producía una PD más baja durante la ventilación unipulmonar. Las complicaciones pulmonares medidas por la escala de Melbourne se presentaron en el 12,2 % con la ventilación de protección pulmonar convencional (18 de 147 pacientes, OR: 0,42; IC 95 %: 0,18 - 0,99; p = 0,047), y solo el 5,5 % (8 de 145 pacientes) con la ventilación guiada por DP. El número de pacientes que desarrollaron neumonía o SDRA fue menor en el grupo de DP (10 de 145 pacientes) que en el grupo de ventilación protectora (22 de 147) [OR: 0,42; IC 95 %: 0,19-0,92; p = 0,028].
Paciente crítico sin SDRA
Se ha propuesto que en pacientes sin SDRA que son sometidos a ventilación mecánica, la DP y la presión meseta inspiratoria son factores de riesgo para un aumento en la mortalidad y el desarrollo de SDRA.
La mayoría de pacientes que ingresan a la UCI no tienen SDRA. Se ha propuesto que en pacientes sin SDRA que son sometidos a ventilación mecánica, la DP y la presión meseta inspiratoria son factores de riesgo para un aumento en la mortalidad.54
Wu y otros55 en su estudio de 207 pacientes con neumonía grave sin distrés tuvieron el objetivo de evaluar la asociación de mortalidad a los 28 días y la DP mediante análisis de regresión logística. Fue registrada la DP diaria por 21 días o hasta ya no se requiriera asistencia respiratoria. Se pudo demostrar que los pacientes con una DP < 19 cmH2O el día uno, mostraron tasas de supervivencia significativamente más altas que aquellos con una DP de > 19 cmH2O (p = 0,002). La sensibilidad y especificidad de la DP para predecir la mortalidad a los 28 días fue 62,5 % y 60,9 % (OR, 1,110; IC del 95 %, 1.013 e 1.217, p = 0,026).
Schmidt y otros56 en un análisis retrospectivo de 5 UCIs y 622 pacientes adultos determinaron la asociación entre DP y los resultados en pacientes con VMA sin SDRA desde el primer día de VMA. Se constató que en pacientes sin SDRA en el día 1 de VMA, la DP no se asoció de forma independiente con la mortalidad hospitalaria (OR: 1,01; IC 95 %: 0,97-1,05).
Múltiples estudios deben generarse a fin de dilucidar mejor esta relación.
Hipertensión abdominal (HIA)
La HIA afecta tanto la funcionalidad de los órganos de la cavidad abdominal como fuera de ella. Además tiene gran impacto en la mecánica respiratoria ya que incrementa las presiones intra-torácicas, reduce la compliance de la pared torácica y disminuye los volúmenes pulmonares.
Mazzinari y otros57 estudiaron pacientes con neumo-peritoneo para cirugía laparoscópica, con el objetivo evaluar los efectos de la PEEP sobre la DP a diferentes niveles de presión intra-abdominal (PIA). La PEEP dirigida fue 10, 14 y 17 cmH2O a una presión intra-abdominal de 8, 12 y 15 mmHg, respectivamente. En comparación con la PEEP estándar, la PEEP dirigida dio como resultado una DP transpulmonar media más baja a una PIA de 8 mmHg (7 [5 a 8] frente a 9 [7 a 11] cmH2O; p = 0,010; diferencia 2 [IC 95 %: 0,5 a 4 cmH2O]); 12 mmHg (7 [4 a 9] frente a 10 [7 a 12] cm H2O; p = 0,002; diferencia 3 [1 a 5] cmH2O); y 15 mmHg (7 [6 a 9] frente a 12 [8 a 15] cmH2O; p < 0,001; diferencia 4 [2 a 6] cmH2O). Los efectos de la PEEP dirigida en comparación con la PEEP estándar sobre la DP del sistema respiratorio fueron comparables a los efectos sobre la presión de conducción transpulmonar, aunque la DP del sistema respiratorio fue más alta que la presión de conducción transpulmonar en todos los niveles de presión intra-abdominal. La DP aumenta con un aumento en la presión intra-abdominal, un efecto que puede contrarrestarse con la PEEP dirigida.
Paciente obeso
La admisión a UCI de pacientes obesos se ha incrementado progresivamente, ya sea por causas médicas o quirúrgicas. El soporte ventilatorio es una de las principales indicaciones del ingreso. En un estudio reciente, retrospectivo y unicéntrico, no se encontró asociación entre DP y mortalidad a 90 días en pacientes obesos ventilados con SDRA.58
La titulación de niveles de PEEP en estos pacientes es controversial. La aplicación de PEEP alta podría asegurar una buena oxigenación, sin embargo, dicha titulación no debería resultar en un incremento del DP. Aunque no haya estudios sobre que rangos de DP son protectores. Los expertos sugieren limitarlo en este subgrupo, tanto en SDRA como no, a niveles menores de 15 cm H2O.59,60
El paciente oncológico crítico
La falla respiratoria aguda es actualmente la principal causa de ingreso en la UCI en el paciente con cáncer, incluso por encima que cualquier otra complicación respiratoria que requiera ingreso en pacientes no oncológicos. Su incidencia va de un 5 a un 55 % en pacientes con malignidad hematológica y tumores sólidos y de un 42 a 88 % entre aquellos sometidos a trasplante medular.61
Datos reportados por Martos-Benítez y otros62,63 desde la UCI oncológica del Instituto Nacional de Oncología y Radiobiología de la Habana, Cuba, detallan una tasa de incidencia del 15,8 % en pacientes que recibieron VMA. Algunos factores como el tumor cerebral (OR: 14,54; IC 95 %: 3,86-54,77; p < 0,0001), la etapa IV del cáncer (OR: 3,47; IC 95 %: 1,26-9,54; p = 0,016), la sepsis (OR: 2,28; IC 95 %: 1,14-4,56; p = 0,020) y la escala APACHE II ≥ 20 puntos (OR: 5,38; IC 95 %: 1,92-15,05; p = 0,001) fueron factores de riesgo independientes para desarrollar el evento. Se asoció con una mayor estancia en la UCI (p < 0,0001), así como con una menor tasa de supervivencia en UCI (p < 0,0001) y hospitalaria (p < 0,0001). Estudios recientes han asociado la VMA en oncológico crítico con la mortalidad (OR: 18,70; CI 95 %: 9,93-35,21; p < 0,0001).
Al igual que en el no oncológico, la práctica de la VMA protectora y las terapias de rescate pulmonar ante la hipoxemia refractaria representan recomendaciones que deben aplicarse en este subgrupo de pacientes.64
El uso de la DP en el contexto predictivo durante la VMA en esta subpoblación no ha sido ampliamente estudiado. El estudio de cohorte más grande en pacientes con cáncer bajo ECMO fue publicado como parte del gran ensayo clínico IDEA.65 Un análisis retrospectivo y multicéntrico de 225 pacientes inmunocomprometidos bajo VMA y ECMO, el 30 % presentó hemopatías malignas y el 19 % tumores sólidos. Variables como un nivel elevado de DP, entre otras, fue asociado como un factor independiente de mal pronóstico.
Estos resultados, aunados a la elevada mortalidad del SDRA en el paciente con neoplasia infieren en la necesidad de continuar investigando sobre el tema a fin de obtener mejores resultados en la supervivencia del enfermo oncológico.
La DP es un parámetro disponible a la cabecera del enfermo que ayuda a identificar el desarrollo potencial de LPIV. Está fuertemente asociada con cambios en la supervivencia y ha demostrado ser mediador clave de los efectos de la VMA en el resultado del SDRA. Los datos publicados sugieren un mayor riesgo de muerte en pacientes con DP superior a 14 cmH2O, aunque aún no se ha identificado un umbral bien tolerado para este parámetro. La posición en decúbito prono junto con simples ajustes ventilatorios para facilitar la eliminación de CO2 pueden ayudar a reducir la DP.
Su monitoreo es de gran utilidad en el paciente con SDRA asociado a COVID-19 teniendo en cuenta la alta respuesta inflamatoria que tiene el pulmón durante la infección.
Se requieren futuras investigaciones que ayuden a minimizar los sesgos y estandarizar su uso como estrategia de monitoreo ventilatorio.