Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
MediSur
versión On-line ISSN 1727-897X
Medisur vol.16 no.4 Cienfuegos jul.-ago. 2018
ARTÍCULO ESPECIAL
Malaria y hemoglobina S: ¿resistencia o protección?
Malaria and hemoglobin S: resistance or protection?
Maritza Margarita Cabrera Zamora
Hospital General Universitario Dr. Gustavo Aldereguía Lima, Cienfuegos, Cuba
RESUMEN
La malaria (o paludismo) es una enfermedad infecciosa causada por parásitos de la familia Plasmodium y transmitída por los mosquitos Anopheles hembra. En el año 2015, se calcula que hubo 212 millones de nuevos casos de paludismo y 429 000 muertes. La región africana sigue soportando la mayor carga de paludismo, con un estimado del 90 % de los casos y el 92 % de las muertes por esta enfermedad. Muchos años han transcurridos desde los primeros reportes que relacionaban el desorden genético caracterizado por la presencia de hemoglobina S y la infestación por malaria, presumiendo que existía una resistencia al desarrollo de esta infestación y al daño que esta causaba; lo controvertido en aquellos momentos de estos planteamientos justificó las múltiples investigaciones realizadas a posteriori; los resultados obtenidos por los descubrimientos más actuales han propiciado una visión más clara de esta relación y nuevas motivaciones encaminadas a profundizar en el estudio de esta temática. El objetivo de este trabajo es precisamente analizar la relación antes mencionada a la luz de los estudios contemporáneos
Palabras clave: malaria, hemoglobina falciforme.
ABSTRACT
Malaria is an infectious disease caused by parasites of the Plasmodium family and transmitted by the female Anopheles mosquitoes. In the year 2015, it ias calculated that there were 212 million new cases and 420 000 deaths. The African region continues bearing the greatest number of cases with an estimate of 90% and the 92% of deaths due to this disease. Many years have passed since the first reports which related the genetic disorder characterized by the presence of hemoglobin S and malaria infection, presuming that there was a resistance to the development of this of infection and it resulting damage. What was controversial about this statement at those times supported the multiple posterior research. The most recent discoveries have allowed a clearer vision of this relationship and new motivations aimed at deepening in the study of this topic. The objective of this work is precisely to analyze the mentioned relationship according to the most recent studies.
Key words: malaria, hemoglobin, sickle.
INTRODUCCIÓN
La malaria (o paludismo) es una enfermedad infecciosa causada por parásitos de la familia Plasmodium y transmitida por los mosquitos Anopheles hembra. Hay cuatro especies diferentes de plasmodios que infectan a los seres humanos (P. Falciparum, P. Vivax, P. Malariae y P. Ovale) aunque la mayor prevalencia y gravedad en la infección es la producida por el Falcifarum, a pesar de ser una enfermedad prevenible y tratable, sigue ejerciendo efectos devastadores en la salud y el modo de vida de las personas en todo el mundo.1 Según datos obtenidos de reportes de la OMS, en 2013, aproximadamente 3200 millones de personas estaban en riesgo de contraer la enfermedad en 97 países, territorios y zonas, y se estima que ocurrieron 198 millones de casos (intervalo: entre 124 millones y 283 millones). Ese mismo año, murieron de esta enfermedad unas 584 000 personas (intervalo: entre 367 000 y 755 000), en su mayoría niños menores de cinco años en el África subsahariana. En el año 2015, se calcula que hubo 212 millones de nuevos casos de paludismo y 429 000 muertes. La región africana sigue soportando la mayor carga de paludismo, con un estimado del 90 % de los casos y el 92 % de las muertes por esta enfermedad.1 En momentos actuales continua siendo un problema prioritario de salud mundial y entre otros factores este ha contribuido a la creación y aplicación de una estrategia técnica mundial contra la malaria 2016-2030, liderada por la OMS, con el propósito de ayudar a los países a reducir el sufrimiento humano causado por la más mortal de las enfermedades transmitidas por mosquitos en el mundo, basada en lograr el acceso universal a la prevención, el diagnóstico y el tratamiento de la malaria, insistiendo en la necesidad de fortalecerla vigilancia de esta enfermedad como pilar fundamental en el camino hacia la erradicación. En el año 2016, el paludismo se consideró endémico en 91 países y territorios, frente a 108 países en el 2000.A pesar de la reducción en el número países con reportes de esta dolencia la carga más onerosa recae en la región de África, donde se calcula que ocurren el 90% de las defunciones por malaria.2 Muchos años han transcurridos desde los primeros reportes que relacionaban el desorden genético caracterizado por la presencia de hemoglobina S y la infestación por malaria, presumiendo que existía una resistencia al desarrollo de esta infestación y al daño que esta causaba; lo controvertido en aquellos momentos de estos planteamientos justificó las múltiples investigaciones realizadas a posteriori ; los resultados obtenidos por los descubrimientos más actuales han propiciado una visión más clara de esta relación y nuevas motivaciones encaminadas a profundizar en el estudio de esta temática. El objetivo de este trabajo es precisamente analizar la relación antes mencionada a la luz de los estudios contemporáneos.
DESARROLLO
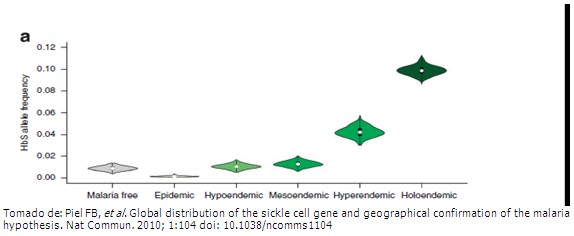
Antecedentes históricos de la relación entre el gen de la hemoglobina S e infestación por malaria En el continente africano coincide la elevada frecuencia de individuos con hemoglobina S e infestados por plasmodium y esta situación geográfica epidemiológica, sirvió de base a la teoría “malaria hipótesis” donde se justificaban las elevadas frecuencias del gen responsable para este desorden genético por la resistencia conferida contra la malaria por el estado de portador heterocigoto de hemoglobina S.3 Teoría que tiene sus inicios en el año 1949 (Haldane) y continuada por Anthony Clifford Allison (1954) genetista y científico británico surafricano que inicia investigaciones en Kenia donde encontró predominio del rasgo AS en personas que habitaban en lugares de gran endemia de malaria. Este hallazgo resultó ser una situación enigmática para él, ya que efectivamente existía prevalencia de HbS en esas zonas pero elevada mortalidad en los enfermos con esta hemoglobina antes de completar la pubertad, alno encontrar total justificación en sus inicios para estos hallazgos decide extender sus investigaciones hacia África Central y Oriental lugares donde observa fenómeno similar.4 Encuentra varios factores posibles asociados que podían explicar este fenómeno en los infantes heterocigotos AS: el número de parásitos infectantes era menor que en los que tenían HBAA además, de la posibilidad de inmunidad adquirida por repetidas infecciones. Escéptico aún continúa sus estudios buscando esclarecer dudas sobre esta compleja situación. Teorías Hace más de 60 años, los investigadores observaron que el gen de células falciformes tiende a ser más común en las poblaciones que viven en, o procedentes de, áreas de alta prevalencia de la malaria. Esto llevó a la "hipótesis de la malaria", lo que sugiere que, aunque mortal cuando heredado de ambos padres, el gen para la hemoglobinopatía S proporciona un grado de protección contra la malaria en los niños cuando heredan de un solo progenitor. Esta ventaja protectora era lo suficientemente fuerte en las zonas de alta transmisión de malaria y a su vez lograban sobrevivir y perpetuar el gen. Ya desde 1949, la paradoja Darwiniana de frecuencias altas de las afecciones hematológicas con base genética pudieran ser el resultado de una ventaja selectiva conferida entre los que portaban el gen (heterocigotos para HbS) se expande la mutación genética en estas áreas por cierto efecto proteccionista, sin embargo el comportamiento en el homocigoto sigue siendo bien diferente con altos índices de letalidad por acentuación de la hemolisis y/o la vaso oclusión.5,2 Es por esto que la mutación que en otras circunstancias debería haberse perdido porque no contribuiría a la vida de los individuos que la portaban, en una región donde la malaria es endémica otorga una ventaja evolutiva frente a los que no la tienen. En África Ecuatorial entre el 10 y el 40% de la población es portadora (heterocigoto) de la mutación, mientras que regiones donde el paludismo no es endémico, en el norte de África, la tasa disminuye hasta el 1%.5,6 Respecto a este efecto proteccionista resulta importante añadirla variabilidad de presentación de la malaria sobre todo en niños con hemoglobina S (homocigotos SS) donde los índices de complicaciones y la letalidad son altas aun con una baja parasitemia, en ellos, en la infestación por Plasmodium fundamentalmente por Falcifarum, se evidencia incremento de la hemolisis y de la vaso oclusión, sin desestimar la presencia de factores inherentes al huésped tales como enfermedades asociadas frecuentes en este contexto, el estado nutricional y/o inmunitario deficiente previo a la infección, que contribuyen además a tórpidas evoluciones (malaria cerebral, SRIS). Transcurrieron décadas y se realizaron múltiples investigaciones para eliminar el escepticismo de la teoría hipótesis de la malaria, estudios poblacionales, de laboratorio, pero las observaciones originales de una superposición geográfica entre la frecuencia del gen y la prevalencia de la malaria no había sido probada más allá de las comparaciones visuales simples de escala mundo. Para hacer frente a esto, el Dr. Fred Piel y colegas recopilaron toda la información disponible en la actualidad en la presencia del gen de células falciformes entre los pueblos indígenas de todo el mundo y, con técnicas de mapeo modernas, crearon un mapa de la frecuencia global de este gen. El mapa se compara con la distribución e intensidad de la malaria, antes del control de la malaria generalizada.7 El estudio mostró que el gen de células falciformes es más común en el África subsahariana, Oriente Medio y la India, y que las áreas de alta frecuencia de este gen son coincidentes con los niveles históricamente altos de la malaria, lo que confirma la malaria hipótesis en una escala global. "Este estudio pone de manifiesto los primeros pasos en nuestros esfuerzos para crear un acceso abierto, la base de datos en línea de la frecuencia de varias enfermedades hereditarias de la sangre", dice el autor principal, el Dr. Piel, de la Universidad de Oxford. "Estas bases de datos, ayudarán a mejorar las estimaciones de la carga de salud pública y guiar en la que sería mejor aplicar los recursos."7 El Dr. Simón, coautor de Piel, añade: "La hipótesis de la malaria es el ejemplo clásico de la selección natural, ejercicio de equilibrio ", donde la selección contra una mutación desfavorable se pesa en contra de la selección a favor de un gen protector. Lo que apoya la existencia de un eslabón geográfico fuerte entre las frecuencias más altas de alelos para hemoglobina S en zonas de mayor endemia de malaria. (Fig. a). En el año 1977 aparecen reportes de estudios sobre la relación malaria y hemoglobina S realizados al analizar la resistencia de los eritrocitos que contenían hemoglobina S en contacto con parásitos responsables de la malaria donde se observó que la multiplicación del Plasmodium aumentaba la proporción del proceso de falciformación (sickling) en los eritrocitos que contiene HbS a su vez los parásitos inicialmente modificaban su evolución se restringía el crecimiento y más fácilmente morían bajo las condiciones de presiones parciales bajas de O2 fenómeno más observado al paso por el interior de los vasos y capilares donde se incrementa la polimerización de la HBS.8 En el 2011Ferreira y colaboradores publican los resultados de una investigación que inicialmente fue realizada con modelo animal en ratones que expresan hemoglobina AS y dos mutaciones adicionales para lograr mayor claridad en el mecanismo proteccionista contra la malaria ya descrito en individuos con hemoglobina AS, ellos observaron cómo los ratones heterocigotos para HbS presentaban menos manifestaciones de malaria cerebral.6,8 Esta protección podía estar explicada por la inducción de la expresión de la enzimaoxigenasa -1 del hemoHO-1(principal enzima implicada en el catabolismo del grupo hemo) en las células hematopoyéticas a través del mecanismo de transcripción, del factor NrF2; el Nrf2 favorece la expresión génica al unirse a una secuencia de ADN conocida como ARE (siglas en inglés de Elementos de Respuesta Antioxidante), codifica para enzimas antioxidantes, cuya principal función es atrapar radicales libres y destoxificar al sistema celular los cuales participan en la reparación del ADN, la inhibición de la apoptosis, el control del ciclo celular, la activación de enzimas de detoxificación de fase II y el mantenimiento del balance redox.6,9 Si se toma en consideración que los niveles del hemo libre son más altos en los individuos con hemoglobina S, consiguientemente una expresión más alta de la concentración de esta enzima HO-1 favorecería el catabolismo de este apoyando su conversión en biliverdina y monóxido de carbono, este último con efectos proteccionistas sobre los síntomas neurológicos (vaso relajante, antiinflamatorio y neurotransmisor a bajas concentraciones) que aparecen agravando esta enfermedad.6,10 Independiente de la actividad de la HO1 en estos individuos con HbSe infestados por Plasmodium se ha observado disminución de la expresión de células T CD8+que reconocen los antígenos expresados por Plasmodium, a nivel del tejido cerebral que explicarían además la disminución de respuesta endotelial inflamatoria a este nivel con la consiguiente menor expresión de manifestaciones clínicas de malaria cerebral.6,9,2 Sin embargo, este efecto proteccionista no puede ser considerado aisladamente ante la existencia de otros mecanismos implicados en la variabilidad y clínica de la malaria, sobre todo de la cerebral. Entre ellos se describen la adherencia celular y el secuestro, formación de rosetas y aglutinación de glóbulos rojos parasitados, producción de citoquinas y activación de segundos mensajeros, todos ellos implicados en la respuesta endotelial inflamatoria; en este proceso intervienen además ligandos para la adhesión a los receptores endoteliales y entre ellos aparece la proteína de la membrana eritrocítica derivada del Plasmodium falciparum (PFEMP1) la que ha sido descrita como el ligando mejor caracterizado de los glóbulos rojos parasitados.8,9,3 Esta proteína PFEMP-1 tiene un comportamiento diferente en individuos con HbS lo que pudiera ser denominado despliegue alterado o lo que es lo mismo, diferente nivel de expresión y distribución en la superficie celular, lo que conlleva a disminuir la adherencia celular; al ser capaz, además, de facilitar el paso de estos hematíes parasitados por el bazo favorece el alcance de mayor madurez de estas células y la inmunoregulación al aumentar los niveles de anticuerpos a múltiples antígenos del parásito.9-11 Finalmente puede afirmarse que este despliegue alterado de la PFEMP favorece la reducción de la adherencia al endotelio, la aglutinación de eritrocitos y formación de rosetas, mecanismos implicados en la severidad de la malaria ampliamente estudiados, fundamentalmente en individuos con HbS. Resultados similares se han observado en estudios epidemiológicos realizados en Burkina Faso en individuos con hemoglobina C en los que se reporta algún efecto proteccionista en el heterocigoto para esta hemoglobina contra el Plasmodium falcifarum aunque la evidencia es menos fuerte que en los portadores de HbS.10,4 En investigaciones realizadas en América con el objetivo de evaluar este fenómeno anteriormente descrito (protección, contraen la infestación por Plasmodium) los resultados son diferentes, la malaria existe pero la endemia no es tan alta y aunque se han demostrado variantes de hemoglobinas no así el efecto proteccionista encontrado en África.12 Se señala además que en estudios realizados con criomicroscopia electrónica de gran alcance en individuos con hemoglobina AA infestados por Plasmodium se encontró que la proteína actina la cual está presente en la superficie celular se encuentra dispuesta en largos filamentos, la cual le facilita al parásito la construcción de un citoesqueleto o puente intracelular que le permite el transporte de la adhesina, proteína derivada del Plasmodium y que favorece la citoadherencia a los vasos sanguíneos y a la superficie de los eritrocitos, el efecto de la adhesina, como su nombre indica, es hacer que las células adyacentes se unan y se adhieran a las paredes de los vasos sanguíneos, causando la respuesta inflamatoria implicada en la malaria generalmente grave. Al observarla disposición de la actina en los que portaban la hemoglobina S o C la disposición de los filamentos de actina resultaban más cortos y la distribución diferente relacionado con las características de estas hemoglobinas lo que retrasa el fenómeno de citoadherencia, confiriendo de esta manera efecto proteccionista contra la malaria.4,13,14
Consideraciones finales
Hemos hecho referencia a mecanismos implicados en la relativa protección que confiere la hemoglobina S a la infestación por Plasmodium pero sobre todo a la presentación menos grave de la malaria en aquellos que tienen el rasgo AS por lo que la profundización en el conocimiento de estos debe ser una pauta a seguir, sin desestimar el conocimiento amplio que debe tenerse sobre la anemia drepanocítica (HbSS) como hemoglobinopatía más frecuente en este continente con variable expresividad clínica y con severas complicaciones y elevada mortalidad sobre todo cuando se le asocia infestación por Plasmodium fundamentalmente falcifarum y el diagnóstico no es oportuno. Continua siendo prioridad en estos países, donde las tasas de transmisión de la malaria son elevadas, aunar esfuerzos encaminados a lograr la reducción máxima de la morbilidad y la mortalidad mediante la implantación sostenida del acceso universal a medidas de control vectorial, medios de diagnóstico y medicamentos antimaláricos de buena calidad y apropiados, junto con la aplicación de los tratamientos preventivos, sin desestimar lo importante y valioso del conocimiento de mecanismos implicados en la protección y la necesidad de continuar ampliando investigaciones al respecto, ejemplo de ellos son los trabajos sobre la inducción del sistema factor de transcripción NrF2 enzima oxigenasa hemo1, de forma exógena o farmacológica como mecanismo de cito protección, propiciando un mejor microambiente celular frente a efectos deletéreos de la inflamación y el estrés oxidativo, implicados en la severidad de esta enfermedad, así como las investigaciones relacionadas con el descubrimiento de fármacos cuyo mecanismo de acción esté relacionado con la inhibición de la síntesis proteicas derivadas del plasmodium e implicados en la multiplicación y severidad de la infestación.15-18 La lucha por la eliminación de la malaria no es un problema solo de los países endémicos, es un problema de todos la colaboración, el apoyo con recursos sanitarios la vigilancia transformada en intervención, constituye la piedra angular del camino hacia la erradicación por lo que resulta necesario compromisos sociales, políticos gubernamentales de los servicios de salud o lo que es lo mismo una vigorosa respuesta mundial ante este flagelo que tanto daño produce a la humanidad.
REFERENCIAS BIBLIOGRÁFICAS
1. Organización Mundial de la Salud. Informe Mundial sobre Paludismo. Estrategia técnica mundial contra la malaria 2016–2030 [Internet]. Ginebra: OMS; 2016 [citado 23 Ene 2018]. Disponible en: http://www.who.int/malaria/publications/world-malaria-report-2016
2. Organización Mundial de la Salud. Informe mundial sobre el paludismo 2014 [Internet]. Ginebra: OMS; 2014. Disponible en: http://www.who.int/malaria/publications/world_malaria_report_2014/en/
3. Organización Mundial de la Salud. Programa Mundial de la OMS sobre malaria. Informes de las reuniones sobre la Estrategia técnica mundial [Internet]. Ginebra: OMS; 2014 [citado 23 Ene 2018]. Disponible en: http://www.who.int/malaria/areas/global_technical_strategy/meetings/en/
4. Allison A. BMJ. 2014;348:g2243
5. Taylor S, Steve M, Parobek Ch, Fairhurst, Rick M. Haemoglobinopathies and the clinical epidemiology of malaria: a systematic review and meta-analysis. Lancet Infectious Diseases. 2012;12(6):457-68
6. Ferreira A, Marguti I, Bechmann I, Jeney V, Chora A, Palha NR. Sickle hemoglobin confers tolerance to plasmodium. Infection Cell. 2011;145:398-409
7. Piel FB, Patil A, Howes R, Nyangiri O, Gething P, Willliams T, et al. Global distribution of the sickle cell gene and geographical confirmation of the malaria hypothesis. Nat Commu. 2010;1:104
8. Moxon CA, Grau GE, Craig AG. Malaria: modification of the red blood cell and consequences in the human host. Br J Haematol. 2011;154(6):670-9
9. Rosenthal PP. Lessons from Sickle Cell Disease in the Treatment and Control of Malaria. N EnglJ Med. 2011;364(26):2549-51
10. Haque A, Engwerda C. An antioxidant link between sickle cell disease and severe malaria. Cell. 2011;145(3):335-6
11. Schuldt K, Kretz C, Timmanns Ch, Sievertsen J, Ehmen Ch, Esser C, et al. 436C> A Polymorphism in the Human FAS Gene Promoter Associated with Severe Childhood Malaria. Journal List PLoS Genetv. 2011;7(5):e1002066
12. Roestenberg M, McCall M, Hopman J, Wiersma J, Luty A, Jan van Gemert G, et al. Protection against a malaria challenge by sporozoite inoculation. N Engl J Med. 2009;361:468-77
13. Cyrklaff M, Sánchez C, Kilian N, Bisseye C, Simpore J, Frischknecht F, et al. Hemoglobins S and C Interfere with Actin Remodeling in Plasmodium falciparum–Infected Erythrocytes. Science. 2011;334(6060):1283-6
14. Elguero E, Délicat-Loembet LM, Rougeron V, Arnathau C, Roche B, Becquart P, et al. Malaria continues to select for sickle cell trait in Central Africa. Proc Nat l Acad Sci U S A. 2015;112(22):7051-4
15. Tobón JC. Ensayan estrategia antioxidante para frenar enfermedades neurodegenerativas. Boletín UNAM. 2013;544:1
16. Baragaña B, Hallyburton I, Gilbert I. A novel multiple-stage antimalarial agent that inhibits protein synthesis. Nature. 2015;522:315-20
17. Williams T, Weatherall DJ. World distribution, population genetics, and health burden of the hemoglobinopathies. Cold Spring Harb Perspect Med. 2012 Sep;2(9):a011692
18. Gouagna LC, Bancone G, Yao F, Yameogo B, Roch K, Costantini C, et al. Genetic variation in human HBB is associated with Plasmodium falciparum transmission. Nat Genet. 2010;42:328-31
Recibido: 11 de junio de 2018.
Aprobado: 20 de junio de 2018.
Maritza Margarita Cabrera Zamora. Especialista de II Grado en Hematología. MSc.en Educación. Profesora Auxiliar. Profesora Consultante. Investigador Agregado. Hospital General Universitario Dr. Gustavo Aldereguía Lima. Cienfuegos. Correo electrónico: denisse@jagua.cfg.sld.cu