Introducción
El dolor ha acompañado a la humanidad desde épocas remotas hasta la actualidad, síntoma muy socorrido en los niveles de salud, donde la medicina presenta éxitos y fracasos, por lo que preocupa y ocupa en forma permanente a los investigadores. Su atención desde el punto de vista asistencial se hace complejo por influir distintos factores como características físicas del paciente (edad, género, peso, cultura…), factores psicosociales como la expectación y el catastrofismo o factores sociales que incluyen el contexto o la percepción individual del dolor.1
El enfoque terapéutico de ese síntoma debe apoyarse en el conocimiento de la fisiopatología y empleo de medios que permitan hacer una valoración de su origen y evolución para adecuar las estrategias analgésicas que correspondan.
En este trabajo se hace una revisión que contempla estos aspectos para lo cual se recopiló información a través de Infomed, Medline, Lilacs, Cochrane Library, depósitos bibliotecarios, aplicando palabras claves: dolor, analgésicos con el objetivo es reiterar la importancia de una atención individualizada ante el síntoma dolor.
Desarrollo
Dolor
Definición
La Asociación Internacional para el estudio del Dolor (IASP) lo define como una experiencia sensorial y emocional desagradable asociada a daño tisular real o potencial.2,3
En función de su duración debe distinguirse el dolor agudo y dolor crónico, por presentar diferentes evoluciones y abordajes terapéuticos.4
Agudo: es transitorio, de corta duración provocado por un estímulo adverso, asociado a cirugía, traumatismos o enfermedad aguda. Habitualmente desaparece con la lesión que lo originó. Se acompaña de reacción vegetativa que se manifiesta con taquicardia, polipnea, sudoración.
Crónico: es permanente con una respuesta no muy satisfactoria a los tratamientos previos, casi siempre comienza gradualmente poco definido y tiende a agravarse, repercute en el estado de ánimo del enfermo
Es compleja, incluye diversas fases en las que inicialmente involucra la liberación de medidores inflamatorios por el daño tisular los cuales actúan sobre los nociceptores y como respuesta normal a la lesión aparece una manifestación vascular con vasodilatación y aumento de la permeabilidad capilar que consecuentemente desarrolla edema celular caracterizada por migración de polimorfonucleares, neutrófilos y eosinófilos, posteriormente macrófagos y monocitos.
Fases: a nivel de los nociceptores, los estímulos nocivos (físico, térmicos, químicos) liberan mediadores inflamatorios que se convierten en una señal eléctrica produciéndose la fase de transducción , llegan a la médula espinal continuando el impulso nervioso (llamada la fase de conducción), por las vías espinotalámicas hasta llegar a tálamo y otros núcleos del sistema límbico, para finalmente llegar a la corteza somatosensorial desarrollándose la percepción, y luego al sistema inhibidor descendente.
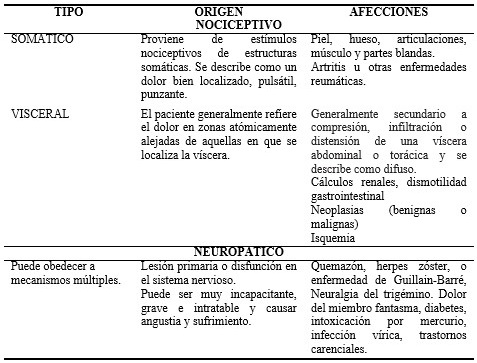
De acuerdo a las causas más frecuentes pueden agruparse en dos grandes grupos: de origen nociceptivo y neuropático.
Nociceptivo: por activación de los nociceptores (fibras A Delta y C) debido a estímulos nocivos que pueden ser mecánicos, químicos o térmicos de origen somático o visceral.
Neuropático: provocado por lesión o irritación neuronal, persiste después de desaparecer el hecho que lo originó. (Cuadro 1).
Analgesicos8
Definición
Medicamento usado para disminuir o eliminar el dolor. La palabra analgesia viene del griego procede del prefijo griego ?- (‘carencia, negación’) y ?λγος (/álgos/, ‘dolor’
La respuesta terapéutica está muy vinculada a su fisiopatología, y valoración de otras condicionales como la anamnesis. Existen varias opciones: uso de fármacos (la más empleada), intervencionismo y no farmacológica.
Con fines analgésicos existe una amplia disponibilidad de fármacos entre los que se agrupan los analgésicos no esteroideos (AINEs), los opioides, los denominados coadyuvantes y otros fármacos.
Fármacos de mayor uso (Cuadro 2)
Aines
Forman un grupo numeroso de fármacos heterogéneos que comparten acciones terapéuticas y efectos adversos. Eficaces frente a dolores leves a moderados. Deben de utilizarse a la menor dosis posible, el menor tiempo posible y utilizar el menos tóxico posible acorde con las necesidades de inhibición de COX-1/COX-2.4
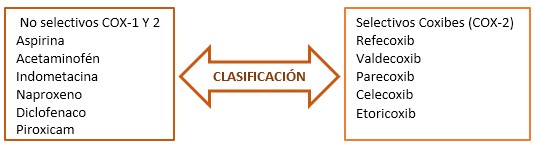
Mecanismo de acción: su efecto analgésico está basado en el bloqueo de la producción de prostaglandinas que son unas sustancias responsables de la respuesta inflamatoria y del dolor, con acción nerviosa a nivel periférico y central que impide la sensibilización de las neuronas medulares y supramedulares, permitiendo la modulación (inhibición) central del dolor agudo y crónico. Bloquean el enzima ciclooxigenasa (COX) de forma no selectiva y reversible que tiene las isoenzimas: COX-1, COX-2 y por tanto la síntesis de prostaglandinas (PG).
COX-1 tiene características de enzima constitutiva y su actividad tiene que ver con la participación de las PG y tromboxanos en el control de funciones fisiológicas.
COX-2 tiene características de enzima inducible, en determinadas células, bajo circunstancias patológicas (en macrófagos, monocitos, células endoteliales y sinoviales en el curso de un proceso inflamatorio).9
Efectos farmacológicos 10
Analgésico central y periférico antes mencionado. Su eficacia analgésica es limitada (efecto techo)
Antipirético: inhibición de la formación de PG, principalmente E2.
Antiinflamatorio: es variable (en general son más eficaces frente a inflamaciones agudas que crónicas), dependiendo del tipo de proceso inflamatorio, participación relativa de algunos eicosanoides en él y también de la posibilidad de que actúen, además, por mecanismos de acción independientes de la inhibición de las ciclooxigenasas. Los analgésicos antitérmicos como paracetamol y metamizol tienen escasa o nula acción antiinflamatoria.
Antiagregante plaquetario: consecuencia de su efecto inhibidor de la COX-1. Reviste especial interés terapéutico en el caso del ácido acetil salicílico (AAS) debido, probablemente, al hecho de que su efecto inhibidor de la ciclooxigenasa es irreversible. El tromboxano interviene en la agregación plaquetaria, no todos los fármacos. El paracetamol no afecta la función plaquetaria y puede ser de elección en pacientes trombocitopénicos.
Indicaciones
Eficaces frente a dolores leves a moderados. Ningún AINE es mejor o más seguro que otro, en bajas dosis actúan como analgésicos, para reducir la inflamación se recomiendan dosis más altas.
Gastrointestinales
Los más frecuentes: pirosis, dispepsia, gastritis, dolor gástrico, diarrea o estreñimiento. Capacidad para lesionar la mucosa gástrica o duodenal, causando erosiones y úlceras objetivables sobre todo por su uso prolongado. Profilaxis: misoprostol
Cardiovasculares
A mayor selectividad para la COX2 → mayor riesgo (Coxibs y diclofenac)
Aumento en incidencia de infarto agudo del miocardio (IAM), accidente cerebrovascular y trombosis.
El riesgo aumenta en pacientes con antecedentes cardiovasculares y factores de riesgo cardiovacular (CV).
Renales
Ejercen poco efecto sobre la función real en individuos normales. Varía según el fármaco: es relativamente alto con fenoprofeno, indometacina o fenilbutazona y más bajo para sulindaco, diclofenaco, etodolaco, piroxicam y meloxicam.
Pueden provocar edemas, poner de manifiesto o agravar una insuficiencia cardíaca o una hipertensión, o desencadenar una insuficiencia renal aguda en pacientes con insuficiencia renal moderada.
Hematológicas
Poco frecuentes, pero graves. Agranulocitosis y anemia aplasia (sobre todo con dipirona)
Hepáticos
Hepatotoxicidad descrita para dosis altas de paracetamol, como patrón más común es daño hepatocelular, aunque algunos reportes han señalado más hepatológicos al diclofenaco y nimesulide.
Otros
Fenómenos de hipersensibilidad: puede ir desde rinitis hasta shock anafiláctico.
Estos fármacos tienen un espectro diferente de toxicidad. Usados como agentes únicos tienen techo en su potencial analgésico, y por lo tanto no se recomienda el uso de dosis más altas que las especificadas. Los efectos gastrointestinales, cardiovasculares y renales pueden presentarse en tratamientos de menos de quince días según reportes. Estos fármacos en general presentan reacciones adversas. Los AINE utilizados para analgesia multimodal disminuyen el consumo de opioides con beneficios reportados en la analgesia posoperatoria.12-14
Los opioides son la clase más importante de analgésicos en el manejo del dolor moderado a severo debido a su efectividad, dosificación fácil y relación riesgo/beneficio favorable. Son derivados alcaloides del opio con múltiples efectos farmacológicos, se absorben en el tracto gastrointestinal, mucosas nasal y oral, en el pulmón y por vía subcutánea e intramuscular. La concentración en los tejidos va a depender de su grado de perfusión, siendo máxima en el riñón, hígado, pulmón y cerebro. Pueden atravesar la barrera hematoencefálica, siendo esto directamente proporcional a su liposolubilidad. Su metabolismo es, fundamentalmente, hepático y la reacción más frecuente es la glucuronización.
Resultan de utilidad en el dolor agudo posoperatorio, dolor crónico y el dolor por cáncer.
Existe una gran variedad de analgésicos opioides; entre los más usados se encuentran la morfina, oxicodona, metadona, fentanilo, entre otros. Cada uno tiene diferentes vías de administración, incluyen vía intravenosa (IV), intramuscular, oral, transdérmica, subcutánea y la mucosa.
Actúan, fundamentalmente, a nivel del SNC y en el sistema gastrointestinal, encontrándose mediada su acción por una serie de receptores específicos localizados a nivel de la membrana celular:mu(μ), kappa(κ), y delta(δ), son todos ellos receptores ligados a proteína G/o los cuales inhiben la adenilatociclasa y disminuyen la producción de AMPc, promueven la apertura de canales de potasio, el cierre de canales de calcio presinápticos, acciones que disminuyen la excitabilidad neuronal. Se ha establecido que su efecto analgésico deriva de su capacidad de inhibir directamente la transmisión ascendente de la información nociceptiva desde el asta dorsal de la médula espinal y de activar los circuitos de control del dolor que descienden desde el mesencéfalo a través de la médula ventromedial rostral (MVR) hasta el asta dorsal de la médula espinal.
Efectos farmacológicos17,21-23
Poseen gran actividad analgésica, pueden ser naturales o bien derivados semisintéticos o análogos sintéticos con muchas características en común. Entre otros efectos se destacan disminución de la respuesta al estrés, en algunos enfermos crean tolerancia, hiperalgesia, disminución de la motilidad gástrica, aumento del tono del esfínter anal. Aunque resultan eficaces ante el dolor neuropático, se ha considerado poco beneficioso indicarlos en primer momento. Los opioides permiten ser aplicados por vía neuroaxial con el inconveniente de la alta incidencia de prurito.
Morfina
Es el opioide más comúnmente usado en el tratamiento del dolor moderado a severo por su disponibilidad en una gama amplia de presentaciones. Puede ser considerada un derivado del fenantreno o un derivado de la 4-fenilpiperidina. Su buena hidrosolubilidad le permite ser utilizada en solución por todas las vías de administración, así como una suficiente biodisponibilidad (20-60 %) como para poder ser administrada por vía oral, y es la más utilizada, ya que las otras vías -intravenosa, subcutánea, espinal- se utilizan sobre todo en situaciones especiales: la intravenosa en bolo o en infusión para situaciones de emergencia, la subcutánea generalmente en situación terminal.
Si aparecen náuseas y vómitos, puede ir acompañada de algún antiemético como metoclopramida, haloperidol, ondansetrón, agonista puro del receptor μ opioide.
Generalmente es usada como referente para relacionar la potencialidad analgésica con otros del grupo. Dosis oral 30 mg, subcutánea 10 mg., epidural 2 mg. Una dosis estándar de morfina de 0,1 mg / kg, no suele ser suficiente para controlar el dolor agudo en el servicio de urgencias.
Oxicodona
Es un derivado semisintético de la tebaína, es un alcaloide del opioide de base débil. En su metabolismo sufre una dealquilación durante el primer paso. Se ha señalado que no libera histamina. Indicado para el dolor moderadamente intenso. Se ha considerado que presenta menos efectos adversos que otros opioides, excepto la constipación, que es mayor. Puede administrarse por vía subcutánea, intraperitoneal, intramuscular, oral; no sublingual ni intratecal. Dosis inicial de 10 mg/12 h. Aumentar el 25-50 % de la dosis según la intensidad del dolor. Dosis máxima 160 mg/24 h.
Metadona
Opioide de origen sintético, se caracteriza por poseer elevada lipofilia y una potencia analgésica similar o ligeramente superior a la de la morfina. Dosis 20 mg 6-8 h., en el dolor agudo 5-10 mg de metadona equivalen a 10 mg de morfina (vía parenteral). Puede seguir administrándose si es necesario al ritmo de 5-10 mg cada 6-8 h, comprobando la adecuación de la dosis al tipo de dolor del paciente. En el dolor crónico del paciente con enfermedad oncológica, se va aumentando la dosis inicial hasta que se consigue el alivio del dolor o aparecen efectos adversos no tolerables. Comúnmente puede presentar otros efectos como mareos, somnolencia, vómitos y sudoración. Los riesgos graves incluyen el convertirse en una droga de abuso o provocar una disminución de la capacidad de respirar.
Fentanilo
Opioide de síntesis 50 a 100 veces más potente que la morfina; 0,05 mg/mL; 0,7-1,4 mcg/Kg IM. Es una sustancia muy lipofílica que atraviesa con gran rapidez la barrera hematoencefálica. Presenta alta potencia y buena liposolubilidad, entra y sale del SNC con gran rapidez, lo que determina inicialmente el rápido comienzo y la corta duración de su acción analgésica por vía parenteral.
La vía transmucosa oral para situaciones de rescate es otra nueva aportación de utilidad práctica en el tratamiento del dolor. Está disponible en parches: 12, 25, 50, 75 y 100 mcg/hora, es liberado a velocidad constante; empieza a subir el nivel plasmático varias horas después de su aplicación, y permanece estable entre 48 y 60 horas para ir descendiendo lentamente.
Codeína
Derivado de la morfina con potencia analgésica menor.
Pertenece junto con la tebaína al grupo de alcaloides del opio del grupo fenantreno.
Es eficaz por vía oral ya que apenas sufre fenómeno de paso hepático. Tiene poca afinidad por los receptores opioides. Su uso está restringido a dolores de tipo intermedio (30-60 mg / 4-6 horas). Derivado metílico de la morfina, se emplea tanto por su actividad analgésica como por su actividad antitusígena y su capacidad para producir estreñimiento.
Tramadol
Es un opioide sintético con una afinidad débil por el receptor µ; potencia analgésica menos que la morfina, opioide atípico. Su efecto analgésico es inducido por la unión a los receptores del sistema opioide endógeno que controla el dolor y por la inhibición de la recaptación de noradrenalina y serotonina y ligeras propiedades como anestésico local periférico. Se puede administrar por vía oral, rectal, intravenosa e intramuscular, siendo su biodisponibilidad oral cercana al 70 % y su vida media de eliminación de 6 h, es metabolizado por el hígado a un metabolito activo. Dosis 100 mg im /iv/ vo
Se ha descrito la combinación paracetamol/tramadol como una alternativa eficaz con un perfil de seguridad aceptable en pacientes con dolor moderado-intenso de distinto origen: musculo esquelético (inflamatorio y no inflamatorio), posquirúrgico, neuropático, oncológico, cólicos, entre otros.
Coayuvantes
Fármacos usados para aumentar la eficacia analgesia de los opioides, para prevenir o tratar los síntomas concomitantes que exacerban el dolor y proporcionar analgesia independiente para tipos específicos de dolor. Su principal indicación es en el dolor neuropático.
Su acción analgésica es tema controvertido, se considera que es el resultado del incremento de la actividad conjunta de los sistemas endógenos descendentes noradrenérgicos y serotonérgicos que proyectan el asta posterior de la médula espinal y controlan las vías aferentes del dolor, como consecuencia de su acción bioquímica que consiste en la inhibición de la recaptación de noradrenalina y serotonina en las respectivas terminaciones nerviosas.
Se recomienda comenzar con dosis bajas y luego incrementarlas, una vez logrado control de la sintomatología mantenerlo de 3 a 6 meses y la disminución progresiva.
Amitriptilina: dosis, 25-50 mg/ día, usualmente administrada en una sola dosis en la noche.
Ciclobenzaprina: se inicia a 10 mg en la noche y se aumenta según tolerancia hasta 30 mg.
Se piensa que las mismas acciones neurofisiológica y neuroquímica que explican la eficacia antiepiléptica de estos fármacos, son las que operan para amortiguar el dolor lancinante y paroxístico. El bloqueo de canales de Na + voltaje-dependientes, o el incremento de la actividad inhibidora GABA, o ambas acciones conjuntamente, son los mecanismos que más frecuentemente suelen ser considerados para explicar la acción depresora sobre este estado de hiperactividad crítica. Pueden utilizarse como fármacos únicos o con un analgésico.
Dado lo heterogéneo de la estructura y de sus mecanismos de acción, puede ocurrir que uno de ellos fracase y que otro sea eficaz, por lo que se impone la norma de la sustitución cuando uno de ellos ha fracasado. La dosificación debe ser plenamente individualizada.
Carbamazepina: indicada en dolor neuropático lancinante. Un mecanismo de acción primario es el bloqueo de los canales del sodio, lo cual se considera que disminuye la descarga espontánea de las fibras Ad y C.
Es muy efectiva en el tratamiento de la neuralgia postherpética; sin embargo, sus efectos secundarios como son síndrome de Steven Johnson, agranulocitosis, anemia aplásica y toxicidad hepática, hacen que se necesite monitorización hematológica. Dosis 8-10 mg/kg/d 100 mg/d.
Gabapentina: e s un fármaco utilizado principalmente para tratar la epilepsia y también el dolor causado por el daño a los nervios (dolor neuropático). Bloquea los canales del calcio sensible al voltaje uniéndose a la subunidad a 2 -d 2 y produciendo una disminución de la entrada de calcio. El bloqueo de la entrada de calcio disminuye la liberación de glutamato y sustancia P desde los aferentes primarios nociceptivos, modulando de este modo la transmisión nociceptiva. Puede utilizarse en el dolor de la neuropatía diabética, la neuralgia postherpética, la neuralgia del trigémino, el síndrome de dolor regional complejo y en el dolor de las neuropatías periféricas causadas por el virus de la inmunodeficiencia humana (VIH), así como en el cáncer, la esclerosis múltiple y la lesión medular. Dosis inicial, 100-300 mg/día; ajustar hasta1.800-3.600 mg/día.
Pregabalina: su accion anticonvulsivante por la elevada afinidad por la subunidad a 2 -d de los canales del calcio. El mecanismo de acción es similar al de la gabapentina disminuyendo así la liberación de neurotransmisores excitadores, incluyendo el glutamato, la sustancia P y el péptido relacionado con el gen de la calcitonina. Dosis: de inicio 300 mg/dosis única nocturna, ir aumentando 300 mg. cada dos o tres días, en tres tomas.
Neurolépticos30
Los neurolépticos no son analgésicos. Son útiles para prevenir o suprimir las náuseas y vómitos provocados por opioides. En estados de intensa agitación coadyuvan a la sedación del paciente.
Haloperidol en tabletas de 1.5 mg, ámpulas de 25 mg
Cloropromacina en tabletas 25- 100 mg; frasco 10 mg/mL; ámpula 25-50 mg.
Ansiolíticos
Pueden aumentar el efecto analgésico de los opiáceos al mejorar la ansiedad que acompaña al dolor crónico. Sería útil en los casos de delirio o agitación.
Se utilizan generalmente si el dolor se acompaña de un fuerte componente ansioso, no tanto ocasionado por el dolor en sí mismo como por tratarse de un paciente con personalidad ansiosa, así como en situaciones en que sea difícil conciliar el sueño. Ej:
Medacepam: tabletas de 10 mg (20 mg/d)
Nitracepam: tabletas de 5 mg(0,5 mg/kg/d)
Corticosteroides
En infiltraciones intraarticulares mejora el dolor y la tumefacción de la articulación y reduce el número de células del exudado, o en el espacio epidural. Dolor nociceptivo de cualquier etiología. Dolores óseos, hepatomegalia, linfedema. Producen gran variedad de efectos que incluyen mejoramiento del estado de ánimo, actividad antiinflamatoria, actividad antiemética y estimulación del apetito. Los esteroides son recomendados para el tratamiento de la compresión de la médula espinal por tumor y también son efectivos para reducir el dolor secundario a edema perineural y compresión de las raíces nerviosas.
Dexametasona: tabletas de 0,75 y 4 mg. Bb 4 y 8 mg
Prednisona: 5mg (vo)
Metilprednisolona: ámpulas de 40 mg, Bb 500 mg 125-250 (im o Infusión)
Efectos secundarios
Los efectos indeseables que pueden ocurrir durante la terapia prolongada con esteroides son miopatía, hiperglucemia, aumento de peso y disforia. Aumentan el apetito. Aumentan la sensación de bienestar.
Clorhidrato de dexmedetomidina
De uso hospitalario. Adyuvante analgésico sistémico, sobre todo en el perioperatorio temprano. Cuando el fármaco es envasado en ampollas de cristal (concentración de 200 μg/mL en suero salino 0.9 %) y conservado a temperatura ambiente. La respuesta analgésica a su administración parece producirse a nivel de la neurona de la raíz dorsal, donde los agonistas alfa 2 bloquean la liberación de la sustancia P en la vía nociceptiva.
Capsaicina
Se obtiene de los pimientos chile picantes. Su mecanismo de acción radica en su capacidad para inhibir la liberación, en las terminaciones centrales y periféricas de las fibras tipo C, del neuropéptido sustancia P, principal neurotransmisor de los estímulos dolorosos. Como consecuencia, disminuye la actividad de las neuronas sensitivas y bloquea la transmisión del dolor. Se presenta en crema, se recomienda aplicar la mínima cantidad para cubrir zona afectada y extender con un suave masaje hasta total absorción. No emplear calor ni vendajes oclusivos, ni sobre piel lesionada o con heridas, ojos y mucosas, ni utilizar de forma prolongada ni en áreas extensas. No recomendado en niños. Indicada en la neuropatía diabética, lumbalgias, dolor posmastectomía.
Técnicas intervencionistas33
Se aplican en centros especializados que cumplan con determinados requerimientos. En los últimos años se han impulsado técnicas mínimamente invasivas que se realizan de manera percutánea para la colocación de medicación en una estructura diana causante de dolor. Los bloqueos de los estímulos nociceptivos contribuyen a disminuir la respuesta al estrés quirúrgico, bloquean las vías de conducción del dolor.
Entre las técnicas intervencionistas se citan:
Valoración del dolor34
La duración del síntoma, localización, extensión, tipo de dolor, situaciones que lo modifican deben ser tenidos en cuenta para lograr buenos resultados en el tratamiento analgésico, síntoma que solo el paciente lo experimenta y define.
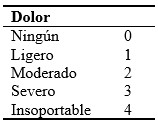
La aplicación de escalas para cuantificar la intensidad del dolor sirve como estrategia para objetivar el dolor, y constituyen un elemento esencial para la valoración de la terapia aplicada.
A continuación, se presentan algunas escalas de mayor uso por su fácil aplicación e interpretación.
Escala visual análoga: consiste en una raya horizontal de 10 cms. en cuyos extremos se contrapone No dolor y dolor máximo, el paciente marcará con un punto el sitio en que presenta el dolor.
Otra versión de la escala graduada de 10 cms. y está representada por números en los que el cero representa no dolor y los números mayores un incremento en su intensidad hasta el número 10
Estas escalas resultan útiles en el paciente cooperador sobre el cual debe existir una sesión de aprendizaje que le permita a él y su evaluador apreciar la evolución del dolor.
Consideraciones y recomendaciones
No existe una fórmula “mágica” ante las diferentes situaciones de salud en la que se presenta el dolor, su atención exige la individualización en el enfoque terapéutico.
La intensidad del dolor constituye un elemento importante en la selección de los fármacos. Entre las tendencias analgésicas más recomendados se encuentra la multimodal compuesta por fármacos que presentan diferentes mecanismos de acción, y la integran combinaciones de técnicas entre las que se citan los bloqueos locoregional, AINEs y coadyuvantes.
Existen recomendaciones recopiladas por experiencias y diversos reportes que indistintamente pueden favorecer una adecuada analgesia entre las que se destacan:
Informe al enfermo sobre la naturaleza del dolor, atienda su causa.
Trate de objetivar el dolor del paciente mostrándole las escalas evolutivas que relaciona su intensidad.
Aplique más de un fármaco para la atención del dolor con mecanismos de acción diferentes que no pertenezcan a una misma familia.
Administre los analgésicos en forma regular, con intervalos apropiados teniendo en cuenta su vida media, anticípese a la aparición del dolor, evite que el enfermo lo solicite.
Comience con las dosis bajas de los fármacos que brinden la analgesia deseada.
No subestime el empleo de ansiolíticos y antidepresivos.
Use siempre que sea posible la vía oral, existen otras alternativas como la transdérmica, subcutánea, rectal, sublingual, parenteral, neuroaxial. Resulta favorable combinar las vías de administración.
Valore periódicamente los resultados del tratamiento impuesto.
Debe prever y atender los efectos secundarios de los fármacos empleados.
Tener en cuenta la presencia de comorbilidades y su atención.