Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Habanera de Ciencias Médicas
versión On-line ISSN 1729-519X
Rev haban cienc méd v.6 n.1 Ciudad de La Habana ene.-mar. 2007
Centro Nacional de Cirugía Endoscópica
ECOENDOSCOPIA EN LA PATOLOGÍA BILIAR Y PANCREÁTICA
*Dr. Osvaldo Díaz–Canel Fernández. Calle 13 Núm. 416 e/ G y F. El Vedado. Ciudad de La Habana. Teléfono: 832-2958.
* Dr. Rolando Martínez López . Calle Martí Núm. 630 e/ Rubiera y Perdomo. Regla. Ciudad de La Habana. Teléfono: 94-2228 . rolando@cce.sld.cu
** Dr. Julián Ruiz Torres. Calle 28 Núm. 116 e/ 1ª y 3ª Miramar. Ciudad de La Habana. Teléfono: 203-1672. julian@cce.sld.cu
*** Dra. Vivianne Anido Escobar. Calle F Núm. 158 e/ Calzada y 9. El Vedado. Ciudad de La Habana.Teléfono: 832-1418 . vivianne@cce.sld.cu
****Dra. Liliana Pernía González. Calle Aguacate Núm.405. Apto. 402 e/ Teniente Rey y Amargura. Habana Vieja. Ciudad de La Habana. Teléfono: 867-5080. liliana@cce.sld.cu
* Especialista Primer Grado en Medicina General Integral y Especialista Segundo Grado en Gastroenterología del
CCE, Asistente e Investigador Auxiliar, Aspirante a Dr. en Ciencias.
** Especialista Segundo Grado en Gastroenterología, Asistente, Investigador Auxiliar y Director del CCE.
*** Especialista Segundo Grado en Gastroenterología del
CCE, Investigadora Agregada.
**** Especialista Primer Grado en Radiología del CCE.
RESUMEN
La ecoendoscopía o ultrasonografía endoscópica (USE) permite una buena visualización de la vesícula, vía biliar, del parénquima pancreático y de las estructuras vasculares vecinas a estos órganos. 1,2 Tiene una alta resolución debido a la cercanía del transductor y a las elevadas frecuencias. Junto con otras técnicas de imagen que se están desarrollando, como la tomografía computarizada (TC) helicoidal y la colangiopancreatografía por resonancia magnética (CPRM) son técnicas seguras y que ofrecen resultados prometedores en el estudio de los tumores, permitiendo la estadificación locoregional de éstos, llegar al diagnóstico de cálculos pequeños de la vía biliar principal que no son visualizados por US abdominal y lograr una visualización más fiel de la glándula pancreática y de las estructuras vasculares vecinas. 3,4, 5
Palabras clave: Ecoendoscopía, Afecciones pancreatobiliares.
INTRODUCCION
La ecoendoscopía (EE) o endoultrasonografía (EUS) gastrointestinal es una técnica de diagnóstico por imagen de introducción relativamente reciente. La primera publicación se realizó a principios de los años ochenta. 1,2,3 Consiste en introducir, a través del tubo digestivo, un endoscopio que lleva conectada una sonda ecográfica de alta frecuencia (5 MHz a 20 MHz) en su extremo distal. Su colocación, en la proximidad de la vía biliar y el páncreas, permite obtener imágenes de alta calidad, con gran precisión diagnóstica, evitando los artefactos relacionados con la interposición de órganos y estructuras como el propio tubo digestivo. 4,5 En función del tipo de transductor ecográfico cambia el eje de estudio y, por lo tanto, se modifica la imagen obtenida de un mismo objeto. 6,7
Se trata de una técnica mínima invasiva, de baja morbilidad, con una tasa de complicaciones inferior a 1 /2 OOO.
Los primeros ecoendoscopios eran de tipo radial y permitían realizar una descripción morfológica, sin posibilidad de intervencionismo; no obstante, en sus comienzos, resultó un claro avance diagnóstico, obteniendo más resolución que las técnicas de imagen existentes entonces, especialmente en lo referente a la estadificación locorregional del cáncer de esófago, estómago, páncreas y recto. En el caso de la vía biliar, especialmente en la detección de coledocolitiasis, demostró que tenía la misma sensibilidad que la CPRE, sin la morbilidad asociada de ésta (Figura 1).
La comercialización, en 1991, de los ecoendoscopios sectoriales supuso un avance cualitativo; además de introducir el Doppler en la EE, permite la realización de biopsias (punción aspiración con aguja fina- PAAF) con control ecográfico permanente del recorrido de la punta de la aguja, y abrió el camino a la terapéutica en el campo de la patología bíliopancreática. 8
La fase diagnóstica de la patología biliopancreática se describe en la mayoría de las publicaciones con equipos radiales; sin embargo, los equipos sectoriales son igualmente válidos, con la ventaja de aportar la posibilidad de la exploración vascular mediante Doppler y recurrir a la PAAF en caso de lesiones dudosas. 9,10
DESARROLLO
La ecoendoscopía en la patología biliar
La exploración de la vía biliar principal (VBP) se realiza desde el bulbo duodenal hasta la papila. La exploración del hepático común y colédoco se consigue aspirando e instilando agua en la rodilla duodenal, y manteniendo el balón del ecoendoscopio con mínimo relleno, con la finalidad de permitir los movimientos de introducción y retirada, que deben ser muy suaves, asociados a rotación y tensión del mando anteroposterior del endoscopio y sólo ocasionalmente del mando lateral. La región ampular y el colédoco distal precisan la introducción del ecoendoscopio en la segunda porción duodenal hasta la región ampular mediante control endoscópico, y desde aquí y mediante una maniobra similar a la retirada de la CPRE podemos explorar la papila, el colédoco distal, y al continuar la retirada se puede apreciar la totalidad del colédoco. 11, 12
La vesícula biliar se explora desde la proximidad del bulbo duodenal (distal o proximal) en función de las variantes anatómicas que presente el individuo explorado. 13, 14
La vía biliar puede explorarse prácticamente en 100 % de los pacientes sin intervenciones quirúrgicas previas. 15, 16
Existen algunas limitaciones de la EE en el estudio de la vía biliar
Resulta técnicamente imposible en caso de gastrectomía total y B-II, así como en presencia de estenosis gastroduodenales.
Pueden ser difícil de interpretar tras una CPRE, especialmente si se ha colocado una prótesis, debido a la presencia de aerobilia y al engrosamiento parietal de la vía biliar.
La presencia de aire dentro de un divertículo duodenal, yuxtaampular.
La distancia al hilio hepático puede hacer difícil la adecuada estadificación de los tumores hiliares.
Finalmente, existe una marcada dificultad en la diferenciación entre una Odditis y un Ampuloma T1.
En general, podemos afirmar que la EE tiene la misma sensibilidad en la detección de las neoplasias de páncreas que la TAC. 17
Sin embargo, la EE resulta superior en la detección de tumores pequeños (< 25 mm) entre los que encontramos aquellos con mayores posibilidades de resección. 18
En cuanto a la valoración global de la infiltración vascular, la EE resulta similar a la TC helicoidal (o algo superior, aunque sin alcanzar significado estadístico).
En estudios previos se mantiene la idea de que la EE es inferior a la TC en el estudio de la invasión vascular de los vasos mesentéricos y en general de la infiltración de vasos arteriales; sin embargo, el empleo de ecoendoscopios sectoriales con eco-Doppler mejora la calidad del estudio vascular por EE y esta superioridad de la TC deberá ser demostrada.
Estudios recientes apuntan a la TC helicoidal como la mejor técnica para determinar el estadio TNM con una sensibilidad de 67 % y una seguridad diagnóstica de 83 % (Tabla 1). La EE permite el estudio locorregional, y por lo tanto la determinación de su estadio M quedaría fuera de sus posibilidades. Sin embargo, salvo en el caso del estadio M, la EE resulta más sensible que la TC para detectar la irresecabilidad, en función de criterios locoregionales. 19
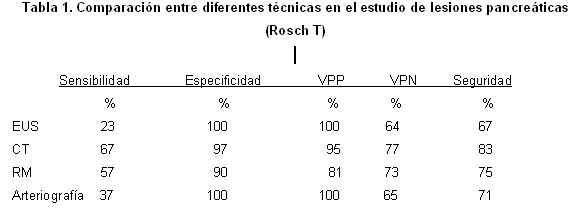
Donde la TC helicoidal se demuestra superior a la EUS, en lo referente a la estadificación; es en presencia de grandes tumoraciones (>4 cm), en las que las deformidades anatómicas y la mayor distancia desde la sonda ecográfica a las estructuras vasculares, no permitirán su adecuada visualización. En general, estos tumores son irresecables y la EUS se limitará a la obtención de una muestra citológica que confirme su naturaleza tumoral (Figura 2). 20
El empleo de algoritmos diagnósticos, a partir de la información obtenida de la TC y la EE, permite seleccionar los pacientes resecables, reduce el coste y evita laparotomías innecesarias. No obstante, cerca de 20 % de los pacientes considerados como resecables por TC helicoidal y EE, finalmente serán irresecables, debido a la presencia de micrometástasis hepáticas o carcinomatosis peritoneal (Figura 3, 4).
Los tumores ampulares merecen un análisis separado, ya que la práctica de la EE resulta técnicamente más difícil; pero, por otro lado, la TC también encuentra más dificultades en el estudio de esta zona; globalmente la EE resulta útil, y obtiene una seguridad de 80-90 % en la estadificación de los tumores grandes, y una seguridad de 70 % en los menores de 2 cm. En el caso de tumores pequeños, la evaluación de la infiltración de la pared debe realizarse sin comprimir el tumor con el balón relleno de agua, y probablemente con interposición de agua en el duodeno. 21
Ya se ha mencionado la limitación de la EE para determinar las metástasis a distancia, por lo que el estadio M no puede sistematizarse por EE debido a la imposibilidad de exploración de la propia sonda ecográfica, aunque existen casos anecdóticos de metástasis hepáticas y suprarrenales detectadas y biopsiadas por EE, así como pequeñas colecciones de ascitis periduodenales y retrogástricas, que también podrían ser aspiradas mediante PAAF y diagnosticar o excluir una carcinomatosis peritoneal. 22
Otros tumores de páncreas
Otros tipos de tumores, como los cistoadenomas del páncreas constituyen 10 -15 % de las lesiones quísticas. La EE permite diferenciarlos, tanto por sus diferentes patrones ecográficos, como por el análisis bioquímico de su contenido que resulta fácil de obtener gracias a la PAAF guiada por EUS. La seguridad diagnóstica varía alrededor de 92 % (Figura 4). 23
Se han descrito diferentes patrones de tumores quísticos
La presencia de quistes simples o de un fino septo son indicativos de benignidad, especialmente si son menores de 2 cm. 24
Por el contrario, la pared gruesa, la presencia de tumoración intraquística, septos de grueso calibre o patrón macroquístico son indicativos de malignidad.
En un estudio reciente, Brugge demuestra que los criterios morfológicos aislados son poco sensibles y específicos para diferenciar lesiones potencialmente malignas. La citología, aunque muy específica, continúa siendo poco sensible, mientras que la determinación del CEA aumenta la sensibilidad de 65 a 89 %; por el contrario, el estudio de Sedlack no encuentra una clara ventaja en el estudio citológico o la determinación de CEA. Probablemente, en la mayoría de los casos el aspecto ecoendoscópico es suficiente para aventurar un diagnóstico sobre benignidad o malignidad, aunque existen casos en los que el análisis del contenido quístico puede ser determinante para definir el tratamiento que debe seguirse. 25
En el caso de los tumores endocrinos, la EE ha demostrado su utilidad, incluyendo los gastrinomas, que pueden ser adecuadamente diagnosticados en 80 % de los casos. La serie de Anderson con 82 pacientes que presentaban tumores neuroendocrinos, probablemente la mayor serie de un único centro, obtienen una sensibilidad y seguridad diagnóstica de 93 % y una especificidad de 95 %, lo que demuestra que la EE es una técnica diagnóstica de primera línea en el manejo de los tumores neuroendocrinos. 26, 27
Pancreatitis aguda
La EUS fue equivalente a la TC en la diferenciación entre pancreatitis edematosa (difusamente hipoecoica y aumentada de tamaño) y necrohemorrágica (masas intrapancreáticas hipoecoicas y focales) y superior en la detección de coledocolitiasis, resulta similar a la CPRE en este último punto. En ocasiones, los cambios inflamatorios del antro y duodeno pueden impedir la adecuada exploración de la cabeza pancreática. 28, 29
Pancreatitis crónica
El parénquima pancreático normal presenta un patrón ecográfico homogéneo con una distribución uniforme de un fino punteado de diferentes gamas de grises. 30, 31
En las pancreatitis crónicas graves se transforma en un patrón heterogéneo, con focos hiperecogénicos repartidos por toda la glándula, y tabiques de aspecto fibrótico que separan pequeños focos hipoecogénicos de aspecto nodular. Pueden verse calcificaciones y lesiones quísticas de diferentes tamaños (Figura 5).
Se ha descrito que la presencia de estos cambios parenquimatosos en los pacientes sin riesgo de pancreatitis crónica es infrecuente; por el contrario, en los pacientes con ingestión excesiva de alcohol, independientemente de que presenten síntomas o permanezcan sintomáticos, se encuentra una alta prevalencía de estos cambios parenquimatosos, y se postula sobre la utilidad de la EE en el diagnóstico precoz de la pancreatitis crónica. La sensibilidad y la especificidad de los cambios parenquimatosos son difíciles de evaluar, debido a la poca frecuencia con la que se dispone de confirmación histológica (Tabla 2). 32

La EE puede detectar los cambios ductales asociados a la pancreatitis crónica, siendo el más precoz la dilatación con aumento en la ecogenicidad de sus paredes y, posteriormente, la irregularidad con estenosis y presencia de cálculos en su interior. 33, 34, 35
En este sentido, se ha podido comprobar su utilidad en el diagnóstico diferencial de la presencia de calcificaciones focales en la cabeza de páncreas y su diferenciación con coledocolitiasis. 36
La pancreatitis crónica es uno de los principales problemas al diagnosticar una neoplasia pancreática. Resulta frecuente que se solicite una EE para descartar un tumor maligno en presencia de un crecimiento de la cabeza del páncreas. Los artefactos asociados a la presencia de calcificaciones pancreáticas, y la dificultad para moverse en un duodeno deformado por los cambios inflamatorios pancreáticos, así como la incapacidad de los ultrasonidos para diferenciar cambios neoplásicos de cambios inflamatorios, explican muchos de los diagnósticos incorrectos; sólo la PAAF dirigida por EUS permite paliar en parte estas carencias. 37
Otras anomalías pancreáticas
Algunas anomalías congénitas que pueden ser sospechadas mediante EE, como el páncreas ectópico, páncreas anular o la presencia de un conducto común pancreático-biliar de longitud superior a 15 mm, tienden a asociarse con patología pancreática. 38, 39, 40
Haciendo referencia a este último supuesto, la presencia por ecoendoscopia de un canal común de al menos 12 mm obtiene una sensibilidad de 88 % y una especificidad de 100 % comparada con la CPRE. 41, 42, 43
La exploración pancreática y biliar mediante sondas-cateter o minisondas
También denominada ultrasonografía intraductal (UID). Básicamente consiste en introducir en los conductos biliar y pancreático, con una técnica similar a la CPRE o por vía transhepática, unos catéteres que llevan un transductor ultrasónico que gira por un mecanismo mecánico y genera una imagen radial, perpendicular al eje de la sonda, aunque en determinadas circunstancias puede simular una imagen lineal. 44, 45, 46, 47
La UID ofrece dificultades técnicas y riesgos asociados a la canulación biliopancreática, además existe un alto riesgo de rotura de este material y disminuye el número de exploraciones por sonda. Teniendo en cuenta estos inconvenientes, debemos preguntarnos:
¿Qué ventajas ofrece la UID sobre la EE?
Hay autores que defienden la superioridad de la UID sobre cualquier otra técnica para detectar la presencia de coledocolitiasis incluso en presencia de colangiografía normal por CPRE.
En el caso de los ampulomas, la UID es la única técnica que permite descartar la invasión submucosa y definir el grupo de pacientes susceptibles de resección endoscópica.
CONCLUSIONES
--La ecoendoscopia es una técnica de diagnóstico muy útil en la patología biliopancreática.
--La combinación de la TC helicoidal y la EE resulta óptima en el manejo de la patología biliopancreática.
ABSTRACT: Endosonography in Pancreatobiliary Disorders.
Endoscopic ultrasound is a minimally invasive imaging modality that provides high – resolution images of the extrahepatic biliary tree and the surrounding structures. It has been shown to be accurate for the detection and staging of bile duct and gallbladder cancer, and is especially useful for small tumors. Intraductal techniques, which are still in evolution, may provide even more information about the etiology and extent of biliary structures and mural tumors. EUS has also been shown to be useful for the detection of biliary stones and sludge when transabdominal ultrasound is not diagnostic. In many cases, diagnostic EUS is needed. 1, 2, 3 Endosonography produces detailed images of the pancreas and surrounding blood vessels and provides both accurate detection and staging of malignant lesions and the means for making a tissue diagnosis.The instruments and techniques for endosonography continue improving, and at present EUS can be considered a promising minimally invasive tool for evaluating the pancreatobiliary disorders. 4, 5
Key words: Endosonography, Pancreatobiliary Disorders.
REFERENCIAS BIBLIOGRAFICAS
1. Amouyal P, Pa lazzo L, Amouyal G. Endosonography: promising method for diagnosis of extrahepatic cholestasis. Lancet. 1989;2:1195-8.
2. Jellouli F, Keriven-Souquet O, Henry L. Endoscopic ultrasound and spiral CT scan for biliopancreatic cancer: preliminary prospective study of 40 patients [abstract]. Endoscopy. 1996;28:55.
3. De Ledinghen V, Lecesne R, Raymond JM. Endoscopic ultrasonography versus magnetic resonance cholangiography for the diagnosis of common bile duct stones: preliminary results of a prospective controlled study. Hepatology. 1996;24:172.
4. Giovannini M, Roche J, Lapuelle J, Rabbia I, Pauwells A. Cholestasis of unknown origin. Results of a prospective study in 121 patients. Gastroenterology. 1995;S:A-153.
5. Prat F, Amouyal P, Amouyal G, Pelletier G, Früsch J, Choury AD, et al. Prospective controlled study of endoscopic ultrasonography and endoscopic retrograde cholangiography in patients with suspected common bile duct lithiasis. Lancet. 1996;347:75-9.
6. Lindsell DRM. Ultrasound imaging of the pancreas and biliary tract. Lancet. 1990;335:330-3.
7. Dufour B, Zins M, Vilgrain V, Levy P, Bernades P, Menu Y. Comparison between spiral X-ray computed tomography and endosonography in the diagnosis and staging of adenocarcinoma oí the pancreas. Clinical preliminary study. Gastroenterol Clin Biol. 1997;21:124-30.
8. Legmann P, Vignaux O, Dousset B, Baraza AJ, Palazzo L, Dumontier I, et al. Pancreatic tumors: comparison oí dual-phase helical CT and endoscopic sonography. Am J Roentgenol. 1998;170:1315-22.
9. Midwinter MJ, Beveridge CJ, Wilsdon JB, Bennett MK, Baudouin CJ, Charnley RM. Correlation between spiral computed tomography, endoscopic ultrasonography and findings at operation in pancreatic and ampullary tumours. Br J Surg. 1999.
10. Soriano A, Ayuso MC, Ayuso JR. Preoperative staging and tumor resectability assessment in pancreatic cancer: prospective study comparing endoscopic ultrasonography (EUS) computed tomography (CT), magnetic resonance imaging (MRI) and angiography [abstract]. Gastroenterology. 2001;120:A760.
11. Brown A, Ahmad NA, Lewis JD. The predictive value of a negative endoscopic ultrasound in the assessment of suspected pancreatic carcinoma (abstarct). Gastrointest Endosc. 2001;53: AB164.
12. Yasuda K, Makuda H, Nakjima M. Endoscopic ultrasonography diagnosis of pancreatic cancer. Gastrointest Endosc Clin North Am. 1995;5:699-712.
13. Gress FG, Hawes RH, Savides TJ, Ikenberry SO, Lehman GA. Endoscopic ultrasound guided fine needle aspiration biopsy using linear array and radial scanning endosonography. Gastrointest Endosc. 1997;45:243-50.
14. Lee SS, Kim MH, Lee SK, Kim TK, Seo DW, Park JS, et al. MR cholangiography versus cholangioscopy for evaluation of longitudinal extension of hilar cholangiocarcinoma. Gastrointest Endose.2002;56:25-32.
15. Rosch T. Staging oí pancreatic cancer: analysis of literature results. Gastrointest Endosc Clin North Am. 1995;5:735-9.
16. Brugge WR. Pancreatic cancer staging: Endoscopic ultrasonography criterio for vascular invasion. Gastrointest Endosc Clin North Am. 1995;5:741-54.
17. Brugge WR, lee NU, Kelsey PB. The use of EUS to diagnose malignant portal venous system invasion by pancreatic cancer. Gastrointest Endosc.1996;43:561-7.
18. Tio TL, Sie LH, Kallimanis G. Staging oí ampullary and pancreatic carcinoma: comparison between endosonography and surgery. Gastrointest Endosc. 1996;44:706-13.
19. Chang KJ, Nguyen P, Erickson PA, Durbin TE, Katz K. The clinical utility of endoscopic-guided fine needle aspiration in the diagnosis and staging of pancreatic cancer. Gastrointest Endosc. 1997;45:387-93.
20. Brugge WR, Saltzman JR, Scheiman JM. Diagnosis of cystic neoplasms of the pancreas by EUS: the report of the Cooperative Pancreatic Cyst Study [abstract]. Gastrointest Endosc. 2001;53:AB 71.
21. Sedlack RE, Vázquez Sequeiros E. Affi Ausefulness of endosonography and fine needle aspiration in preoperative evaluation of pancreatic cystic lesions [abstract]. Gastrointest Endosc. 2001;53:AB 175.
22. Rosch T, Lightdale CJ, Botet JF, Boyce GA, Sivak MV, Yasuda K, et al. Localization of pancreatic endocrine tumors by endoscopic ultrasonography. N Engl J Med. 1992;26:1721-b.
23. Sugiyama M, Wada N, Atomi Y, Kuroda A, Muto T. Diagnosis of acute pancreatitis. Value of endoscopic sonography. A1R 1995;165:867-72.
24. Zuccaro G, Sivak MV. Endosonographic ultrasonography in the diagnosis of chronic pancreatitis: Value of chronic pancreatitis. Endoscopy. 1992;24(Suppl):347-9.
25. Buscail L, Escorrou J, Moreau J, Delvaux M, Louvel D, Lapeyre F, et al . Endoscopic ultrasonography in chronic pancreatitis: a comparative prospective study with conventional ultrasonography, computed tomography, and ERCP. Pancreas. 1995;10:251-7.
26. Fritscher-Ravens A, Broering DC, Knoefel WT, Rogiers X, Swain P, Thonke F, Bobrowski C, Topalidis T, Soehendra N . EUS-guided fine-needle aspiration of suspected hilar cholangiocarcinoma in potentially operable patients with negative brush cytology. Am J Gastroenterol. Jan 2004;99(1):45-51.
27. Jacobson BC, Pitman MB, Brugge WR. EUS-guided FNA for the diagnosis of gallbladder masses. Gastrointest Endosc. Feb 2003;57(2):251-4.
28. Palazzo L. Which test for common bile ducts stones? Endoscopic and intraductal ultrasonography. Endoscopy. 1997;29:655-65.
29. Tseng U, Jao YT, Mo LR. Over the wire US catheter probe as adjunct to ERCP in the detection oí choledocolithiasis. Gastrointest . 2001;54:720-5.
30. Tio TL, Cheng J, Wijers OB, Sars PRA, Tygat GNJ. Endosonographic TNM staging oí extrahepatic bile duct cancer: comparison with pathological staging. Gastroenterology. 1991;100:1351-b1.
31. Mirallie E, Pattou F, Malvaux P, Filoche B, Godchaux JM, Maunoury V, Palazzo L, Lefebvre J, Huglo D, Paris JC, Carnaille B, Proye C. Value of endoscopic ultrasonography and somatostatin receptor scintigraphy in the preoperative localization of insulinomas and gastrinomas. Experience of 54 cases]. Gastroenterol Clin Biol. Apr 2002;26(4):360-6.
32. Dahan P, Andant C, Levy P, Amouyal P, Amouyal G, Dumont M. Prospective evaluation of endoscopic ultrasonography and microscopic examinations of duodenal bile in the diagnosis oí cholecystolithiasis in 45 patients with normal conventional ultrasonography. Gut 1996;38:277-81.
33. Sugiyama M, Atomi Y, Yamato T. Endoscopic ultrasonography for differential diagnosis of polypoid gallbladder lesions: analysis in surgical and follow up series. Gut 2000;46:250-4.
34. Napoleon B, Albis R, Saurin JC, Scoazec JY, Fumex J, Ponchon T. Clinical impact of endoscopic ultrasound and intraductal ultrasonography in the management oí ampuIlary tumors [abstract]. Endoscopy. 2000;32:A27.
35. Menzel J, Poremba C, Dietl KH. Preoperative diagnosis of bile Duch strictures-comparison oí intraductal ultrasonography with convencional endosonography. Scand J Gastroenterol. 2000;35:77-82.
36. Tomado K, Tomiyama T, Wada S, Ohasi A, Satoh Y, Ido K, Sugano K. Endoscopic transpapilary bile Duch biopsy Ruth the combination of intraductal ultrasonography in the diagnosis of biliary strictures. Gut 2002;50:326-31.
37. Tamada K, Kanai N, Wada S, Tomiyama T, Ohashi A, Satoh Y, Ido K, Sugano K. Utility and limitations of intraductal ultrasonography in distinguishing longitudinal cancer extension along the bile duct from inflammatory wall thickening. Abdom Imaging. Nov-Dec 2001;26(6):623-31.
38. Kohut M, Nowakowska-Dulawa E, Marek T, Kaczor R, Nowak A. Accuracy oí linear endoscopic ultrasonography in the evaluation of patients with suspected common bile ducts stones. Endoscopy. 2002;34(4):299-303.
39. Tandon M, Topazian M. Endoscopic Ultrasound in Idiophatic Acute Pancreatitis. Am J Gastroenterol. 2001;96(3):705-9.
40. Norton SA, Alderson D. Endoscopic ultrasonography in the evaluation of idiophatic acute pancreatitis. BrJ Surg. 2000;87:1650-5.
41. Frossard JL, Sosa-Valencia L, Amouyal G, Marty O, Hadengue A. Usefulness of endoscopic ultrasonography in patients with "idiopathic" acute pancreatitis. Am J Gastroenterol. 2001;96(3):705-9.
42. Scheiman JM, Carlos RC, Barnett JL, Elta GH, Nostrant TT, Chey WD, et al. Can Endoscopic Ultrasound or Magnetic Resonance Cholangiopancreatography replace ERCP in patients with suspected biliary disease? A prospective trial and cost analysis. Am J Gastroenterol. 2001;96(10):2900-4.
43. Gress FG, Hawes RH, Savides TJ, Ikenberry SO, Cummings O, Kopecky K, et al. Role of EUS in the preoperative staging of pancreatic cancer: a large single-center experience. Gastrointest Endosc. 1999;50:786-91.
44. Sheridan MB, Ward J, Guthrie JA, Spencer JA, Craven CM, Wilson D, et al. Dynamic contrast-en haced MR imaging and dual-phase helical CT in the preoperative assessment of suspected pancreatic cancer: a comparative study with receiver operating characteristic analysis. AJR Am J Roentgenol. 1999;173:585-90.
45. Materne R, Van Beers BE, Gigot JF, Jamart J, Geubel A, Pringot J, Deprez P. Extrahepatic biliary obstruction: magnetic resonance imaging comparecí with endoscopic ultrasonography. Endoscopy. 2000;32(1):3-9.
46. Calvo MM, Bujanda L, Calderón A, Heras I, Cabriada ) L, Bernal A, et al . Role of magnetic resonance chola ng¡opa ncreatography in patients with suspected choledocholithiasis. Mayo Clin Proc. 2002;77(5):407-12.
47. Anderson MA, Carpenter S, Thompson NW, Nostrant TT, Elta GH, Scheiman JM. Endoscopic ultrasound is highly accurate and directs management in patients with neuroendocrine tumors of the pancreas. Am l Gastroenterol. 2000;95(9):2271-7.
ANEXO
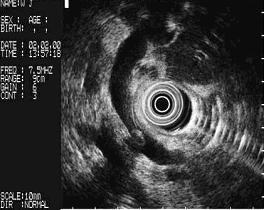
Fig. 1 . Cálculo del colédoco.
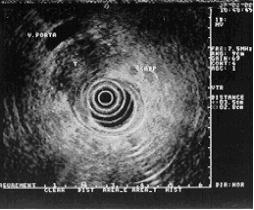
Fig. 2 . T. de cuerpo de páncreas y ADP

Fig. 3. T. de cabeza del páncreas

Fig. 4 . Tumor quístico del páncreas.

Fig. 5 . Pancreatitis crónica calcificada.














