Introducción
El alarmante incremento de la resistencia bacteriana frente a los antibióticos constituye uno de los mayores problemas en Salud Pública, motivo por el cual es necesario determinar las causas relacionadas con la emergencia y la diseminación de bacterias multiresistentes.1
Los efectos de la resistencia a los antimicrobianos no se limitan solo a los riesgos para la salud, sino que además condiciona pérdidas de producción y consecuencias negativas para los medios de subsistencia y la seguridad alimentaria, lo que causa efectos en la economía, tanto en el ámbito nacional como mundial. Por su parte, la Comisión del Codex Alimentarius de la Organización de las Naciones Unidas para la Alimentación y la Agricultura (FAO, por sus siglas en inglés) en el 39 período de sesiones estimó que los costos económicos de la resistencia a los antimicrobianos. Si las verdaderas consecuencias de este problema no se tienen en cuenta, dichos estimados suponen 10 millones de pérdidas humanas al año y una disminución entre 2% y 3,5% del producto interno bruto mundial, con un valor total de 100 billones de dólares para 2050.2
Por lo que es necesario el control de todas las vías a través de las cuales pueden llegar al hombre microorganismos resistentes, entre ellos los alimentos, el ambiente y el agua. De gran interés en la actualidad la selección y diseminación de microorganismos y determinantes de resistencia antimicrobiana en la producción acuícola.3
En ambientes acuáticos, las bacterias pueden intercambiar genes de resistencia, incluso a bacterias patógenas para el hombre, lo cual constituye un riesgo para la salud de las personas. Se ha demostrado en V. cholerae la tranferencia de plásmidos que portan genes que condicionan multiresistencia antimicrobiana.4,5
Expertos de la Organización Mundial de la Salud OMS, FAO y Organización Internacional de Epizootias (OIE), catalogan a los microorganismos resistentes transmitidos por los alimentos como un peligro biológico y un problema para la inocuidad de estos productos. Por ello enfatizan en la necesidad de desarrollar una estrategia estructurada y coordinada con vistas tanto a analizar el riesgo como a prevenir los posibles daños que ocasiona la ingestión de dichos productos.6
En Cuba se han realizado investigaciones sobre resistencia antimicrobiana en bacterias de origen acuático aisladas en pacientes y del medio ambiente.7,8,9 Sin embargo es poca la información en aislamientos de alimentos, que pueden contribuir a la diseminación de tales características entre las bacterias comensales y patógenas que ocasionan infecciones intra y extraintestinales en humanos.
El siguiente estudio tiene como objetivo determinar la resistencia a los antimicrobianos en aislamientos de pescados y mariscos.
Materiales y Métodos
Se realizó un estudio descriptivo observacional en el laboratorio de Microbiología del Instituto Nacional de Higiene Epidemiología y Microbiología (INHEM) en el período de 2012 a 2016, sobre la resistencia a los antimicrobianos en 154 aislamientos bacterianos en pescados y mariscos, los microorganismos estudiados fueron Salmonella, 16 aislamientos; Escherichia coli, 12; Stahylococcus coagulasa positiva, 28 y Vibrio cholerae, 98. Aislamientos identificados en el INHEM y recibidos como parte de la vigilancia en los Centros Provinciales de Higiene, Epidemiología y Microbiología de las diferentes provincias (La Habana, Santiago de Cuba, Granma, Ciego de Ávila, Camagüey y Guantánamo).
La determinación de la susceptibilidad antimicrobiana, se realizó mediante el método de difusión con discos (Bauer-Kirby) y se siguió la metodología descrita en la normativa del Clinical and Laboratory Standards Institute (CLSI). Los discos de antimicrobianos evaluados procedían de las casas comerciales CPM-SCIENTIFICA, Roma-Italia.
Se utilizaron como controles las cepas: Staphylococcus aureus ATCC 25923 y Escherichia coli ATCC 25922, se siguieron rigurosamente los procedimientos establecidos para este fin, tanto para el control de los cultivos como la determinación de la susceptibilidad.
En Salmonella y Escherichia coli, los fármacos probados fueron: ácido nalidíxico 30 µg, amikacina 30 µg, ampicilina 10µg, carbenicilina100µg, cefotaxime 30µg, ceftriaxona30µg, ceftazidima 30µg, ciprofloxacina 5µg, cloranfenicol 30µg, estreptomicina 10µg, gentamicina 10µg, kanamicina 30µg, sulfametoxazol/trimetoprima1.25/23. 75µg y tetraciclina 30µg.
En Staphylococcus coagulasa positiva, se evaluaron los fármacos amikacina 30µg, cefazolina 30µg, cefotaxima 30µg, ceftriaxona 30µg, cloranfenicol 30µg, ciprofloxacina 5µg, eritromicina 15µg, gentamicina 10µg, kanamicina 30µg, penicilina G, sulfametoxazol/ trimetoprima1.25/23. 75µg y tetraciclina 30µg.
En Vibrio cholerae, ampicilina 10µg, ciprofloxacina 5µg, sulfametoxazol/trimetoprima 25µg, tetraciclina 30µg, doxiciclina 30µg y azitronicina 30µg.
Para el análisis de los resultados se conformó una base de datos y se analizaron los resultados mediante el programa WHONET 5.6, Software para la vigilancia de la resistencia antimicrobiana y control de infecciones OMS.10) Los criterios de interpretación del antibiograma según los puntos de corte se realizaron para Enterobacteriaceae y Staphylococcus, según CLSI, 2015,11 para V. cholerae se utilizaron los criterios de interpretación del antibiograma según los puntos de corte específico para V. cholerae, CLSI, 2010.12 En los casos de ciprofloxacina, doxiciclina y azitronicina, se utilizaron los referidos para Enterobacteriaceae: CLSI, 2015.11
Los resultados de susceptibilidad se expresaron como valores de frecuencias absoluta y relativa, los patrones de resistencia se obtuvieron considerando los fármacos con resistencia y susceptibilidad intermedia.
En el documento no se recogen los nombres de empresas o instituciones ni las marcas comerciales de los alimentos a partir de los cuales se obtuvieron los aislamientos, por lo cual no se generan conflictos de interese al respecto.
Resultados
En pescados y mariscos se determinaron 79 (51,3%) aislamientos no susceptibles a los antimicrobianos. (Tabla 1).
Tabla 1 Patrones de resistencia antimicrobiana por microorganismo y tipo de alimento.
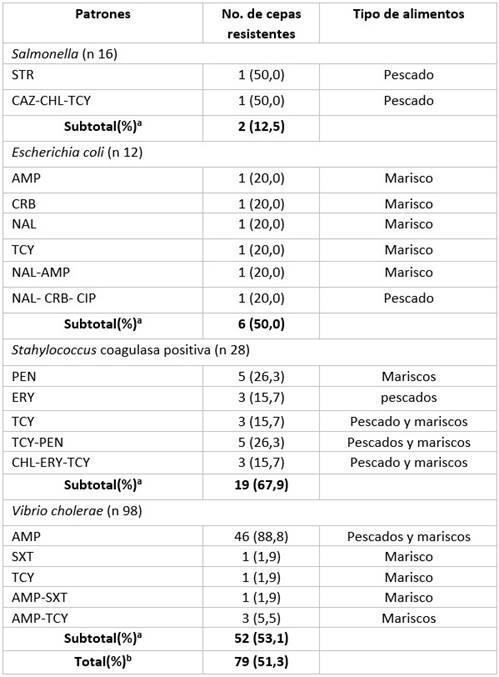
Leyenda: AMP: ampicilina, CAB: carbenicilina, CAZ :ceftazidima, CIP: ciprofloxacina, CHL: cloranfenicol, STR: estreptomicina,
SXT: sulfametoxazol/trimetoprima, TCY: tetraciclina, PEN: penicilina, ERY: eritromocina, NAL: ácido nalidixico
a Porcentaje calculado en base al número de cepas aisladas por microorganismo, b Porcentaje calculado en base al total de aislamiento 154.
Se identificaron varios patrones de resistencia, los mayores porcentajes de resistencia se observaron en Stahylococcus coagulasa positiva y V. cholerae con 67, 9% y 51, 3% aislamientos respectivamente.
En Salmonella solo se determinaron dos aislamientos resistentes, procedentes de pescados, uno de las cuales presentó un patrón de multirresistencia para los antibióticos ceftazidima, cloranfenicol y tetraciclina. E. coli expresó resistencia a cinco tipos de antibióticos, predominaron los aislados no susceptibles a un antimicrobiano.
En Staphylococcus, la resistencia fue mayor para la penicilina, se determinó un patrón de multirresistencia para cloranfenicol, eritromicina y tetraciclina, la mayoría de los aislamientos fueron identificados por igual en mariscos y pescados.
V. cholerae fue el género en el que se determinó un mayor número de aislamientos, se identificaron 52 aislados resistentes, el mayor porcentaje fue para la ampicilina, no se determinaron patrones de multiresistencia.
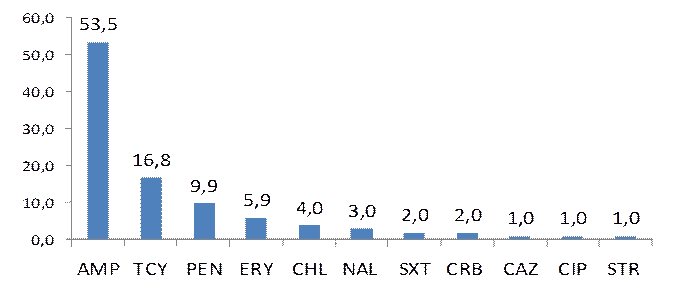
En el análisis de la resistencia general por antibióticos en los microorganismos estudiados (Figura). La ampicilina y la tetraciclina fueron los antimicrobianos con mayores porcentajes de resistencia. Para la ciprofloxacina y la ceftazidima se determinó 1,0 % de resistencia respectivamente.
En el análisis de V. cholerae como bacteria autóctona de los ecosistemas marinos y acuícolas (Tabla 2), se muestra la resistencia a los distintos antimicrobianos por tipo de alimentos, la resistencia se observó con mayor frecuencia en asilamientos de ostión que además, fue el producto con bacterias resistentes a una mayor variedad de antibióticos.
Tabla 2 Frecuencia de cepas de Vibrio cholerae resistentes a los antimicrobianos por alimento.

Leyenda: AMP-ampicilina, TCY-tetraciclina, SXT-trimetropin sulfametoxazol.
a Porcentaje calculado en base al total de aislamiento resistentes por antibiótico,
b Porcentaje calculado en base al total de aislamiento resistentes 52
La frecuencia de aislamientos de Vibrio en pescado se observa en la Tabla 3, se obtuvo en pescado de mar y de aguas dulces 16 y 19 aislamientos respectivamente sin embargo, la resistencia a los antimicrobianos en pescados de aguas dulces fue mayor, 36, 8% aislados, respecto a los de mar, 18%.
Discusión
En bacterias asiladas en pescados y mariscos se determinó resistencia a los antimicrobianos, en las cuales se identificaron varios patrones de resistencia. Entre los géneros estudiados se encontró Salmonella, con una frecuencia de aislamientos resistentes baja 2/16, a diferencia de lo que se informa en estudios internacionales en las que se dan a conocer un mayor porcentaje de resistencia a la encontrados en esta investigación.13,14
En E. coli, como microorganismo indicador de calidad, predominó la resistencia a un antimicrobiano, de interés clínico se obtuvo un aislamiento resistente a ciprofloxacina, antibióticos clasificado de uso con precaución según la OMS.15
En Staphylococcus coagulasa positiva, la multiresistencia fue poco frecuente, el mayor porcentaje de resistencia se expresó para la penicilina, resultado que coincide con los informados en la literatura revisada en la que se reporta una menor susceptibilidad para las penicilinas y los macrolidos como la eritromicina.16,17
Respecto a V. cholerae se informa con frecuencia en pescados y maricos en estudio nacional.18 En esta investigación el mayor número de aislamientos no susceptibles se determinó en este microorganismo. Predominó la resistencia a un antibiótico y no se encontraron patrones de multiresistencia, contario a lo reportado en investigaciones internacionales en aislados en pescados, mariscos y crustáceos, en los que se detectan patrones de multiresistencia que involucran cuatro y más antibióticos.19,20,21,22
Al comparar los resultados de esta investigación con la resistencia encontrada en aislamientos clínicos de V. cholerae en nuestro país, la resistencia a los antimicrobianos fue similar, con excepción de ciprofloxacina, azitromicina y doxiciclina medicamentos para los cuales se determina resistencia intermedia en asilados en pacientes,7 a diferencia de 100 % de susceptibilidad obtenida en el estudio de alimentos.
En un análisis general los porcentajes de resistencia a los antimicrobianos en esta investigación, fueron inferiores a la reportada en la bibliografía internacional,14,16,21 con excepción de la resistencia para la ampicilina que fue 53, 5%. En las bacterias objeto de estudio la resistencia se expresó con mayor frecuencia para la ampicilina y la tetraciclina, en investigaciones nacionales e internacionales sobre susceptibilidad a los antimicrobianos en alimentos también se reportan altos porcentajes de resistencia para estos antimicrobianos.9,23,24
Es de interés señalar que Salmonella, E. coli y Staphylococcus pueden encontrarse en los productos pesqueros por contaminación del medio acuático o se incorporan al alimento durante el procesamiento. En la bibliografía consultada se da a conocer que, el pescado es un vehículo poco común en lo que respecta a Salmonella. La contaminación por Staphylococcus es generalmente a través de manipuladores o a partir del medio ambiente y la presencia de E. coli está relacionada con la contaminación del agua o la manipulación de los alimentos en condiciones no higiénicas.3,13,14 Estos microorganismos tienen como reservorio a los animales terrestres o los humanos, por tal motivo es difícil inferir el origen de la resistencia antimicrobiana.
En nuestro país la vigilancia de contaminantes en los alimentos se realiza antes de la comercialización y luego en la cadena de distribución y venta, la presencia de los microorganismos antes mencionados, por encima de los límites establecidos en la norma de criterios microbiológicos NC 585, 201725 invalida el comercio de dichos productos, lo cual limita la diseminación de la resistencia a través de los mismos. Respecto a V. cholerae, la vigilancia se realiza para los serogrupos O1 y O139, los cuales son portadores de toxinas con potencial epidémico, que no es el caso de los aislamientos analizados en este estudio. Los aislamientos investigados se consideran bacterias autóctonas de los ecosistemas marinos y acuícolas y forma parte de la microbiota de animales que habitan en ellos,20,21) condición por la cual se realizó un análisis más detallado de la resistencia a los antimicrobianos en V. cholerae.
Los mayores porcentajes resistencia en V. cholerae fueron para la ampicilina; en Cuba el único antibiótico autorizado para uso en la acuicultura es la oxitetraciclina, la aplicación dosificada de este medicamento está indicada cuando se requiere en el ciclo inicial de vida de los animales.26 Por tal motivo, se consideró que, la resistencia encontrada para la ampicilina pudiera estar relacionado con la adquisición de genes de resistencia por Vibrio desde el ambiente, factor que se asocia a la resistencia en este microorganismo según estudios internacionales.27,28
La resistencia antimicrobiana expresada en bacterias identificadas en pescados se analizó en dependencia de los ecosistemas de origen. La frecuencia de aislamientos de Vibrio en pescado de mar y de aguas dulces fue similar, sin embargo la resistencia a los antimicrobianos se expresó diferente, mayor en aislamientos de pescados de aguas dulces. Tal hallazgo se explica por la diferencia de habitad, se plantea que los microorganismos que se encuentran en los peces depende del ambiente natural, en mar abierto los pescados y mariscos están exentos de enteropatógenos, mientras que los de agua dulce están expuestos a la contaminación procedente de la actividad humana.21
En este estudio los mayores porcentajes de resistencia en Vibrio se determinaron en bacterias aisladas en ostión. En publicaciones nacionales e internacionales se informa los moluscos bivalvos como reservorios frecuentes de especies de Vibrio.15,29) Alimentos que se consideran de riesgo, por la alta carga microbiana que pueden presentar debido a que acumulan numerosos microorganismos en el ciclo de vida, además generalmente se consumen crudos o mínimamente procesados, por lo que se consideró en este estudio el alimento de mayor exposición a bacterias resistentes para los consumidores, dado que el resto de los producto generalmente se someten a tratamiento térmico.
El tratamiento térmico es importante en la garantía de la inocuidad de los alimentos objeto de estudio.13,18,29 No obstante, cabe destacar que cualquier alimento puede ser contaminado con V. cholerae u otras bacterias resistentes a los antimicrobianos por prácticas inadecuadas de higiene, por tanto la higiene es la principal barrera para minimizar el riesgo de transmisión de bacterias resistentes a los antibióticos a través de los alimentos.
Entre las limitaciones de esta investigación se encontró que no se recibieron aislamientos de todas las provincias; no obstante, el número de aislados fue representativo para determinar la resistencia en los alimentos objeto de análisis y los antimicrobianos analizados abarcaron una amplia gama que involucró la mayoría las clases que se emplean en el tratamiento humano. A pesar de las limitaciones anteriormente expuestas, estas no afectan la validez de las conclusiones alcanzadas con el presente trabajo. El cual constituye un punto de partida para estudios futuros, que permitan la vigilancia de la resistencia a los antimicrobianos que puede ser trasmitida por alimentos de origen acuícolas y marino.
Conclusiones
La resistencia antimicrobiana en aislamientos de pescados y mariscos fue baja y la multiresietencia se expresó con poca frecuencia. Entre las bacterias resistentes se encontraron Salmonella, E. coli y Staphylococcus como contaminante de los productos y V. cholerae como microorganismo autóctono de los ecosistemas marinos y acuícolas. Los ostiones fueron los alimentos que se consideraron de mayor riesgo en la diseminación de bacterias resistentes.
Recomendación
Teniendo en cuenta las normativas existentes en el país respecto al uso regulado y limitado de antibióticos en la producción acuícola, se recomienda el cumplimiento de estas y enfatizar en las buenas prácticas higiénicas en el procesamiento, elaboración y manipulación de los alimentos.