Introducción
La COVID-19 es una enfermedad infecciosa causada por el nuevo coronavirus SARS-CoV-2.1,2,3 El carácter altamente contagioso del SARS-CoV-2, y su potencial para provocar cuadros clínicos graves y provocar el fallecimiento de pacientes a causa de la COVID-19,2,4 explican la urgente necesidad de desarrollar opciones terapéuticas específicas y efectivas. SARS-CoV-2 es el tercer coronavirus que enfrenta la humanidad en el presente siglo, cada uno con graves consecuencias para la salud pública debido a su transmisibilidad, morbilidad y mortalidad. Entre 2002 y 2003 se produjo la emergencia en Guangdong, China, del Síndrome Respiratorio Agudo Severo causado por el coronavirus SARS-CoV, que resultó en la infección de 8 000 personas de las cuales fallecieron 774. Nueve años más tarde, en 2012, la emergencia del coronavirus causante del Síndrome Respiratorio del Medio Oriente (MERS-CoV) en Arabia Saudita y Jordania, y su posterior propagación a otras naciones, resultó hasta 2018 en más de 2 000 contagios y alrededor de 700 víctimas fatales.1,5 De modo significativo, desde su emergencia en diciembre de 2019 en la ciudad de Wuhan, China, el nuevo coronavirus SARS-CoV-2, causante de la COVID-19, ha afectado a más de dos millones de personas a escala global, y cientos de miles de muertes han sido reportadas en 183 países.3,6,7
Aparentemente, la COVID-19 tiene un carácter multisistémico aunque afecta preferentemente los pulmones.2,8 Sus manifestaciones clínicas incluyen fiebre, tos seca, dolor muscular, fatiga, disnea, entre otras.6,9 Se ha reportado que los casos afectados por la COVID-19 pueden evolucionar desde estadios asintomáticos hasta formas graves caracterizadas por un síndrome de distrés respiratorio agudo (ARDS, por sus siglas en inglés).10 Se ha comprobado que el ARDS asociado a SARS-CoV-2, resulta de eventos inmunopatológicos comunes a SARS-CoV y MERS-CoV.2,10 El mecanismo consiste en una respuesta inflamatoria sistémica no controlada, mediada por la liberación de una gran cantidad de citoquinas proinflamatorias, que resultan en un ataque del sistema inmunológico causando el ARDS, fallo de múltiples órganos y finalmente la muerte en las formas más graves de la enfermedad.2 Los pacientes de edad avanzada, y aquellos con comorbilidades, son particularmente vulnerables a formas graves de la COVID-19.11
Diversos equipos de trabajo a nivel mundial, trabajan intensamente para la identificación y validación clínica de agentes antivirales específicos para el tratamiento de la COVID-19. La tecnología del ARN de interferencia (ARNi) se ha aplicado con éxito al desarrollo de tratamientos antivirales en varios contextos patológicos,12,13,14 y ha mostrado potencialidades en el contexto de enfermedades humanas causadas por coranovirus.15,16,17 El ARNi es una molécula de ARN que forma parte de un mecanismo biológico que actúa en el silenciamiento de genes específicos a nivel post-transcripcional.15,18 Su potencial terapéutico contra coronavirus recae en la posibilidad de diseñarlo de modo específico contra la expresión de genes necesarios para la replicación viral.
El uso de ARNi ha sido efectivo para la inhibición de la replicación viral en modelos celulares de hepatitis B, C y SIDA.12,13,14 En igual sentido, estudios realizados en diversos sistemas experimentales para SARS-CoV, demostraron que el uso de ARNi contra genes específicos, estructurales y no estructurales, resultó en la inhibición de la replicación viral.15 Teniendo en cuenta el mecanismo de acción general de los virus y considerando que SARS-CoV y SARS-CoV-2 muestran importantes similitudes en su estructura genómica y proceso patogénico,2 la aplicación de la tecnología del ARNi podría ser una opción terapéutica contra la COVID-19. Sin embargo, la aplicación potencial de la tecnología del ARNi a la terapéutica contra la COVID-19 no aparece reflejada en la literatura especializada. En consecuencia, el objetivo del presente trabajo es reflejar la relevancia potencial de la tecnología de ARNi, como alternativa terapéutica contra la COVID-19.
Material y Métodos
Se realizó una revisión bibliográfica entre febrero y abril de 2020, para la cual fueron consultadas las bases de datos PubMed, EBSCO, Clinical key, Scopus, Embase y HighWire. Fueron utilizados los siguientes criterios de búsqueda, diseñados a partir de términos incluidos en el tesauro DeCs o de sus equivalentes en inglés incluidos en el tesauro MeSH: [coronavirus AND terapia] OR, [SARS-CoV AND terapia] OR, [coronavirus AND ARN de interferencia] OR, [SARS-CoV AND ARN de interferencia]. Se empleó la estrategia de búsqueda avanzada para la selección de los artículos. Fueron realizadas búsquedas adicionales de información en las listas de referencias bibliográficas de los artículos incluidos en el estudio para evitar la pérdida de información relevante. Una vez escogida la bibliografía, fue realizado un análisis de contenido de los diferentes artículos y se seleccionaron aquellos con la información más relevante de acuerdo con el objetivo del trabajo. Se tuvo en cuenta la calidad metodológica o validez de los estudios. De un total de 135 estudios consultados, 74 cumplieron con los criterios para esta revisión.
Las limitaciones de este artículo de revisión derivan esencialmente de la imposibilidad de acceder a publicaciones que no permiten la consulta gratuita de sus contenidos.
Desarrollo
Clasificación y características generales de los coronavirus
Los coronavirus (CoVs) se encuentran representados por cuatro géneros (α, β, γ y δ) de la familia Coronaviridae .2 Son virus envueltos con un genoma de ARN de simple cadena y polaridad positiva.15 Dos representantes del género α-CoVs (HCoV-229E y NL63) y cuatro del β-CoVs (MERS-CoV, SARS-CoV, HCoV-OC43 y HCoV-HKU1), habían sido inicialmente identificados como patógenos que afectan a los humanos. El SARS-CoV-2, causante de la COVID-19, también pertenece al género β-CoVs.2
El análisis de secuencia del ARN genómico de SARS-CoV-2 obtenido de cinco pacientes mostró un 99 % de homología entre sí, y sugiere que su introducción en humanos es reciente. Adicionalmente, mostró un 88 % de homología con β-CoVs aislados en murciélagos (bat-SL-CoVZC45 y bat-SL-CoVZXC21).2,7 Sin embargo, la homología con SARS-CoV y MERS-CoV solo fue del 79 % y 50 %, respectivamente, lo que permitió definir al SARS-CoV-2 como un nuevo β-CoVs.2,19 Adicionalmente, la secuencia de 104 genomas de SARS-CoV-2 mostró una homología del 99,9 % entre sí, e indica una significativa estabilidad genómica.20
Organización del genoma de coronavirus con énfasis en SARS-CoV y SARS-CoV-2
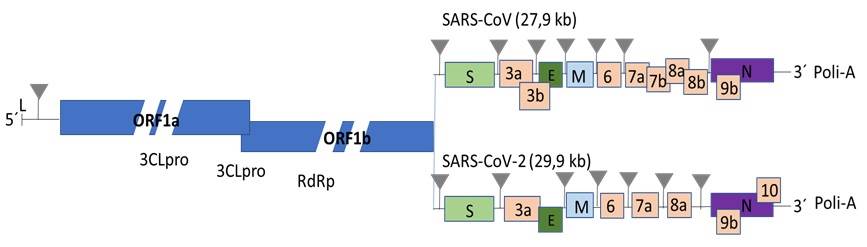
En general, los coronavirus son virus esféricos de 100 a 160 nm de diámetros y su ARN genómico comprende entre 26 y 32 kb de longitud, por lo que constituyen los más grandes genomas de virus ARN conocidos.15,21 El ARN mensajero (ARNm) se caracteriza por poseer una secuencia líder consistente en ∼70nt, que deriva del extremo 5′ del genoma, y que es seguida por una región no traducida (UTR, por sus siglas en inglés) que oscila entre 200 y 400 nt. Otra región UTR en el extremo 3′ del genoma es seguida por una cola de poli-A de longitud variable.15,21 Ambas regiones UTR son importantes para la replicación y transcripción del ARN, al igual que la secuencia reguladora de la transcripción (TRS, por sus siglas en inglés). Este breve motivo suele ubicarse próximo al comienzo de cada marco de lectura abierto (ORF, por sus siglas en inglés) y al final del extremo 3′ de la secuencia líder. Además, la secuencia consenso se encuentra inmediatamente delante de los genes que codifican las proteínas de la espiga (proteína S), de la membrana (proteína M) y del ORF 10.15
Particularmente, SARS-CoV y SARS-CoV-2 se caracterizan por incluir en su genoma al menos 10 ORFs. Dos tercios del extremo 5´ (ORF1a/b) codifican las poliproteínas (PLpro y 3CLpro) que conforman el complejo viral de replicación-transcripción. El otro ORF comprende un tercio del genoma y codifica para cuatro proteínas estructurales: S (espiga), E (envoltura), N (nucleocápsida) y M (membrana). Adicionalmente, esta región codifica otras proteínas accesorias con funciones desconocidas.2,15) (Figura 1).
ARN de interferencia
El ARN de interferencia (ARNi) es un mecanismo natural mediante el cual las células responden a la presencia de ARN de doble cadena (dsRNA, por sus siglas en inglés) para producir el silenciamiento post-transcripcional de genes específicos.18,22 Está conservado en una gran cantidad de organismos, incluyendo los humanos.18 Originalmente fue observado en plantas,18 pero su descripción inicial se realizó en la década del 90 en el nemátodo C. elegans al evidenciarse que la introducción de dsRNA largos inducía el silenciamiento de los genes correspondiente al ARNm homólogo.18
El mecanismo de silenciamiento de genes específicos comprende un primer paso o de “iniciación”, en el cual la proteína celular Dicer, una ribonucleasa dependiente de ATP y miembro de la familia de ARNasa-III , se une a un dsRNA largo y lo escinde en un fragmento dúplex de 21 a 23 nucleótidos, el cual es referido como ARN de interferencia pequeño (siRNA, por sus siglas en inglés). En un segundo paso o “efector”, el siRNA interactúa con multinucleasas para formar el complejo de silenciamiento inducido por ARN (RISC, por sus siglas en inglés).15,18,23 En una acción dependiente de ATP, RISC produce la separación de la hebra pasajera o sentido del siRNA, y deja el complejo activo con la hebra antisentido o guía. La hibridación del siRNA con el ARNm diana, provoca la escisión de este último en un sitio específico, y la supresión de su traducción en proteína. Este proceso es catalizado por la ARNasa Argonauta (Argo), componente del complejo RISC.15,18,23) (Figura 2).
Los activadores del mecanismo de ARNi, los dsRNA, aparecen naturalmente en las células como intermediarios de infecciones virales15) o como parte de un mecanismo de regulación post-transcripcional de la expresión génica en forma de microARN (miARN).24,25 El descubrimiento de que la introducción artificial de dsRNA en forma de ARN de interferencia pequeños (siRNA, por sus siglas en inglés) también activa el mecanismo de silenciamiento génico, condujo al desarrollo de la tecnología del ARNi.15,24 Inicialmente, el método solo podía aplicarse en algunos eucariontes como las plantas.15 La exclusividad radicaba en que el ARNi en estos organismos constituye un mecanismo natural contra la infección viral.15,25 Por el contrario, en mamíferos el sistema inmune responde con el incremento de los niveles séricos de interferón (IFN, por sus siglas en inglés) y destruye los dsRNA largos (˃30nt).15,26 Específicamente, el dsRNA largo es reconocido como un patógeno en este grupo de organismos, entonces induciendo la activación de la proteína kinasa R, la 2´-5´ oligoadenilato sintetasa y, finalmente, la expresión de interferón.26 Aparentemente, el mecanismo antiviral del ARNi fue sustituido por una respuesta más evolucionada en los vertebrados. Sin embargo, la maquinaria necesaria para activar el ARNi aún se encuentra presente en los mamíferos,23,27 con un papel relevante en el funcionamiento celular. En este caso, el proceso inicia en el núcleo celular con la transcripción de un ARN no codificante -miARN primario-, el cual a través de un complejo catalítico formado por Drosha, enzima de la familia de las ARNasa tipo-III , y la proteína DGCR8 de unión a dsRNA, es procesado para generar un fragmento precursor de aproximadamente 70nt (pre-miARN).18,23 Este fragmento es exportado al citoplasma por la proteína exportina-5, donde es transformado por Dicer en el miARN maduro, y continúa así la misma ruta de los siRNA, descrita anteriormente23 (Figura 2). La utilidad del mecanismo en mamíferos se hizo posible ante la posibilidad de diseñar y obtener siRNA sintéticos (21-23nt), imitando la estructura de los producidos en los invertebrados, y capaces de evadir la respuesta inmune.27 En general, el siRNA sintético puede ser introducido directamente en las células de vertebrados por transfección, así como mediante el diseño de ARNs pequeños con estructura en lazo (shRNA, por sus siglas en inglés), que imitan a los miARN celulares.23 Los shRNA pueden ser clonados y expresados en vectores plasmídicos o virales e introducidos en las células por transfección o mediante la infección con pseudo-partículas virales, respetivamente.28,29 Los shRNAs se caracterizan por formar una estructura del tipo tallo-asa. Se diseñan a partir de una simple hebra que codifica la secuencia “sentido” con 19 nt, seguido de 5-10 nt que forman una estructura de “lazo”, y una secuencia complementaria “antisentido”, con 19-29 nt (Figura 2).30 La hebra es insertada en el vector de expresión, el cual se introduce en la célula y posteriormente el shRNA se transcribe mediante un promotor eucariótico de polimerasa, como los ampliamente usados promotores de polimerasa III (U6 o H1). Los shRNA son incorporados a la ruta del miARN,18,23 y al ser procesados por Dicer dan lugar al miARN maduro, el cual es estructuralmente igual a los siRNAs (Figura 2).31) La principal ventaja del shRNA es que, contrario al efecto transitorio de los siRNA, permiten mantener el efecto de silenciamiento por largo tiempo.
Debido a su potencia y especificidad, el mecanismo de ARNi se ha convertido en el método de elección para inducir el silenciamiento de genes específicos en células de mamíferos. Adicionalmente, el ARNi resulta fácil de utilizar, el diseño de sus efectores (siRNA o microARN) está muy avanzado, existen programas gratuitos para ello, y la producción comercial de siRNA se ha extendido. De modo que actualmente, la tecnología del ARNi constituye una herramienta valiosa y estandarizada para la experimentación biológica.15 En consecuencia, esta tecnología tiene numerosas aplicaciones a la Medicina, incluyendo su uso terapéutico en el contexto de enfermedades humanas de etiología genética o viral.18,23
Aplicación del ARNi a la terapia antiviral
Las enfermedades de origen viral constituyen una creciente preocupación para las autoridades sanitarias en el contexto mundial, lo que se agudiza a partir de la emergencia de nuevos virus para los cuales las poblaciones humanas no tienen inmunidad natural.18,32) Históricamente, el tratamiento de las enfermedades virales se ha sustentado en la vacunación preventiva o en un limitado grupo de fármacos antivirales. No obstante, en la mayoría de los casos no se dispone de opciones terapéuticas específicas. En este ámbito, el ARNi representa una oportunidad para el desarrollo de terapias antivirales específicas, orientadas al silenciamiento de la expresión de genes esenciales para la supervivencia, la replicación y la infección viral.33)
Varias características de los virus, incluyendo su dependencia de un reducido número de genes, de elevados índices de replicación, y el que sus genes sean estructuralmente muy diferentes a los genes humanos, hacen del ARNi una alternativa ideal para el desarrollo de terapias antivirales. Además, el tiempo necesario para el desarrollo de nuevos siRNA es corto en comparación con otros tratamientos de carácter específico, lo que facilita una rápida respuesta ante la aparición de mutaciones refractarias al siRNA o la emergencia de nuevos virus.33
Una de las primeras aplicaciones del ARNi fue a enfrentar la infección por VIH-1, la variante de VIH más frecuente a escala mundial.34 Varios ARNi se han diseñado para inducir el silenciamiento de un amplio número de genes esenciales para el VIH-1.35,36,37) Así, Novina, et al (2002)35 demostraron en líneas celulares derivadas de células Hela, el silenciamiento efectivo del gen CD4 por medio de siRNA. Adicionalmente, el siRNA mostró su potencial para inhibir la entrada del virus a las células en este sistema experimental. La inhibición experimental de la replicación viral también se ha observado al dirigir siRNA contra genes propios del virus, como el codificante de la poliproteína Gap precursora de los polipéptidos p24, p17 y p15, constitutivos del núcleo estructural principal del VIH.35 En general, existen numerosas evidencias experimentales que muestran el silenciamiento por siRNA de la expresión de genes codificantes de proteínas del VIH, con la subsiguiente inhibición de la replicación viral, entre ellos los genes tat, rev, vif y nef.32,36,37,38,39 La proteína Tat promueve la expresión de genes virales, mientras que Rev facilita la exportación del ARN genómico y los ARNm correctamente procesados del núcleo al citoplasma, y Vif ha sido relacionada con la potenciación de la infectividad de las partículas de la progenie viral. Finalmente, entre sus múltiples funciones, Nef ha sido vinculada a la transducción de señales.34
La tecnología de ARNi también se ha aplicado al desarrollo de terapias contra las hepatitis B y C.12,13) Los estudios para evaluar el potencial terapéutico del ARNi en estas enfermedades han experimentado avances significativos, incluyendo aplicaciones discretas en humanos.40,41 No obstante, la primera evaluación del uso potencial de la tecnología de ARNi para el tratamiento de una enfermedad viral, se enmarca en el contexto del virus sincitial respiratorio en 2001.42 La subsiguiente emergencia y persistencia del SARS, causado por el SARS-CoV, condujo a un importante número de estudios para evaluar la potencial utilidad del ARNi en el desarrollo de estrategias terapéuticas contra este coronavirus.15,16,17) El análisis de tales estudios supone la identificación de referentes para una potencial aplicación del ARNi al tratamiento de la COVID-19, causada por el nuevo coronavirus SARS-CoV-2.
Aplicación del ARNi en coronavirus SARS-CoV y potencial para la inhibición terapéutica de la replicación del virus SARS-CoV-2
El SARS, causado por el coronavirus SARS-CoV, constituyó la primera enfermedad grave surgida en el siglo XXI. Hasta su aparición entre 2002 y 2003, las infecciones por coronavirus no representaron una prioridad para impulsar el desarrollo de vacunas o terapias antivirales específicas.15 El surgimiento acelerado del brote y el potencial de conducir a etapas clínicas letales cambiaron tal percepción,15 la que se acentuó aún más con la emergencia y persistencia del MERS-CoV en 2012,1) y con la actual emergencia y persistencia del SARS-CoV-2.7
Diversas opciones terapéuticas fueron utilizadas inicialmente para tratar a los individuos afectados por el SARS-CoV,15,43 las que fueron posteriormente extrapoladas al MERS-CoV y la COVID-19.44) Algunos de estos tratamientos han mostrado eficacia en la disminución del ARDS y la mortalidad asociada a la COVID-19.45) Sin embargo, dado su carácter inespecífico, el efecto terapéutico logrado ha sido determinado por individualidades de la respuesta inmune.2 En consecuencia, el desarrollo de tratamientos antivirales específicos contra estos patógenos continúa siendo una prioridad para los sistemas de salud pública a nivel mundial.
Estrategias terapéuticas específicas basadas en el desarrollo de vacunas se han evaluado para SARS-CoV, y han inspirado el desarrollo de investigaciones en el ámbito del SARS-CoV-2.44) Sin embargo, los protocolos para la obtención de estas vacunas son prolongados, existen riesgos derivados de la propia respuesta inmune, incluyendo la resistencia a la vacuna a causa de la alta mutabilidad que caracteriza al genoma de coronavirus. Por el contrario, desde inicios de la epidemia en 2003, diversos estudios han demostrado que el uso de siRNA conduce al silenciamiento de genes específicos necesarios para la replicación del virus SARS-CoV, y sugieren su potencial utilidad terapéutica.15,16,17) Dadas las similitudes entre SARS-CoV y SARS-CoV-2, estas estrategias basadas en ARNi también pudieran ser de utilidad para el tratamiento de la COVID-19.
En efecto, tanto SARS-CoV como SARS-CoV-2 utilizan la enzima convertidora de angiotensina 2 (ACE2, por sus siglas en inglés) como receptor para su entrada en las células diana.2,46 Este proceso también implica a la proteína S de la envoltura viral,2,15 que tiene una identidad de ∼76% entre ambos virus.47
En SARS-CoV, la proteína S tiene una masa molecular de 150 a 180 kD, y consta de un largo dominio N-terminal externo (subdividido en los subdominios S1 y S2), un dominio de transmembrana y un corto dominio C-terminal citoplasmático.15,48 Zhang, et al (2004)16 transfectaron líneas celulares 293T que expresaban la proteína S de SARS-CoV, con siRNA dirigidos a secuencias específicas en los subdominios S1 (siRNA1) y S2 (siRNA2) de la proteína S. Comprobaron una marcada reducción en los niveles de proteína S y el correspondiente ARNm, e indicaron que los siRNA diseñados fueron capaces de silenciar de modo específico la expresión del gen; también demostraron que estos siRNA inhiben la replicación viral.16 En otro ensayo conducido por Wu, et al (2005)17) en células Vero, se demostró que la transfección con siRNA produjo una profunda reducción en los niveles de ARNm y de antígenos virales para la proteína S.
Se conoce que una vez liberado en el citoplasma celular, el genoma viral de SARS-CoV y SARS-CoV-2 se traduce en poliproteínas precursoras del complejo de replicación y transcripción, y proteínas estructurales.2,15 Se cree que las poliproteínas 1a y -b son las únicas que son sintetizadas desde el ARN viral original, mientras que las restantes son sintetizadas a partir de ARNm subgenómico2,15 (Figura 1). Primariamente, el producto génico ORF1a/b sufre un procesamiento post-traduccional que da lugar a varias proteínas, como resultado de su propia actividad como proteasa. La proteasa cisteína semejante a papaina (PLpro, por sus siglas en inglés) y la proteasa cisteína semejante a 3C (3CLpro, por sus siglas en inglés), escinden el polipéptido en pequeños péptidos que son requeridos para el proceso de replicación-transcripción.2,15 Entre ambos virus, estas poliproteínas comparten entre 80 % y 86 % de identidad a nivel aminoacídico, respectivamente.47) Ming, et al (2003)49 diseñaron siRNA dirigidos a diferentes zonas de la región 1a de replicación del coronavirus SARS-CoV. Para evaluar el potencial de los siRNA de causar el silenciamiento génico se emplearon células de riñón de mono (FRhk-4), infectadas con SARS-CoV. Se demostró que los siRNA fueron capaces de inhibir las manifestaciones citopáticas causadas por la infección y replicación viral.49
Otro componente esencial del complejo de replicación en SARS-CoV y SARS-CoV-2 es la polimerasa de ARN dependiente de ARN (RdRp, por sus siglas en inglés), para la cual estos virus tienen una homología a nivel aminoacídico de ∼96% entre ambos virus.47 El complejo de replicación es responsable de transcribir los ARNs positivos y negativos, así como el conjunto de ARN subgenómicos anidados del extremo 3´coterminal y las cadenas de ARN subgenómicos negativas.2,15,50,51) Zhi, et al (2004)52 diseñaron siRNA en vectores plasmídicos dirigidos hacia el ARNm RdRp. La expresión de los siRNA anuló eficazmente los efectos citopáticos del SARS-CoV en células Vero, y se comprobó la inhibición de la replicación viral.52
Por otra parte, se conoce que las proteínas M y E son requeridas para el ensamblaje de SARS-CoV y SARS-CoV-2, mientras que la proteína N ha sido implicada en la formación de la nucleocápsida y en la síntesis de ARN viral.2,15) Estas proteínas tienen una identidad en la secuencia aminoacídica de ∼90%, ∼94% y ∼90%, respectivamente, entre ambos virus.47 Xue, et al(2007)53) diseñaron shRNAs contra los genes codificantes de las proteínas N y E de la nucleocápsida y la membrana, respectivamente. Se comprobó que los shRNA indujeron la degradación de los ARNm de estos genes.53 Adicionalmente, Ying, et al(2010)54 generaron dos siRNA (si-M1 y si-M2) contra el ARNm del gen M y comprobaron que ambos siRNA produjeron una significativa reducción en la expresión de este gen. En este estudio también se observó que ambos siRNA indujeron la producción de IFN-β normalmente inhibida por la expresión del gen M,54,55,56 indicando la efectividad de estos siRNAs para inhibir la expresión del gen M de SARS-CoV.
Por otra parte, Akerströn, et al. (2007)57 diseñaron siRNA contra las proteínas S, 3a/3b y 7a/7b del SARS-CoV y lograron una significativa reducción en la replicación viral. En SARS-CoV-2 se han identificado homólogos de estas proteínas, que han sugerido la utilidad potencial de estos siRNA para el tratamiento de la COVID-19.
Si bien los referidos estudios se limitaron a sistemas in vitro, se ha comprobado que la administración intranasal de siRNA en un modelo de SARS-CoV en macaco rhezus, produce una reducción de la fiebre inducida por el proceso infeccioso, de los niveles de SARS-CoV y el daño alveolar característico.58)
De conjunto, estos resultados reflejan el potencial de la tecnología de ARNi para el desarrollo de terapias contra enfermedades causadas por coronavirus y, en particular, contra la COVID-19, dadas las similitudes en la estructura genómica y en los procesos patogénicos asociados al SARS-CoV y SARS-CoV-2.2,47 En este sentido, los genes utilizados como dianas de siRNA en SARS-CoV, podrían considerarse como candidatos para iniciar la evaluación del ARNi en SARS-CoV-2. Inclusive, contrario a SARS-CoV donde ocurren frecuentes cambios nucleotídicos a nivel genómico, una mayor efectividad de la tecnología podría lograrse para SARS-CoV-2, debido a que la gran estabilidad mostrada por su genoma,20 reduciría los fallos potenciales en el proceso de interferencia, que podrían resultar de mutaciones que afecten la complementariedad entre el siRNA y el ARNm diana.15
Otro aspecto a considerar sobre el diseño de terapias para la COVID-19, es la elevada transmisibilidad que caracteriza al SARS-CoV-2, que es incluso mayor que la del SARS-CoV.59 Se ha planteado que una mayor eficiencia en la unión entre la proteína S del SARS-CoV-2 y el receptor de ACE2, pudiera determinar tal diferencia.59 Desde esta perspectiva, la elección del gen S como diana podría ser una de las estrategias más prometedoras para el desarrollo de terapias basadas en el uso de RNAi contra la COVID-19.
Finalmente, la vía de administración del ARNi constituye otro asunto a tratar en la elaboración de una estrategia terapéutica basada en ARNi contra la COVID-19. En teoría, el ARNi podría ser administrado local o sistémicamente por inyección intravenosa. Sin embargo, se conoce que los siRNAs desprotegidos son propensos a una rápida degradación, y existen riesgos de efectos inespecíficos.41 El uso de vectores virales o la administración intranasal, podrían ser alternativas para la aplicación en humanos de siRNAs.
Conclusiones
La tecnología del ARN de interferencia ha mostrado potencialidades como estrategia terapéutica antiviral, particularmente contra el coronavirus SARS-CoV, tanto en modelos celulares como animales. Dadas las similitudes existentes entre el SARS-CoV y SARS-CoV-2, en cuanto a la estructura y función de sus correspondientes genomas, esta tecnología es potencialmente aplicable al tratamiento de la COVID-19.