Introducción
En general existen dos formas para que el organismo pueda generar anticuerpos frente a las enfermedades infecciosas; la primera, es desencadenada por el ingreso de microorganismos patógenos, generando la activación de la inmunidad adaptativa humoral y celular culminando con la producción de anticuerpos específicos dirigidos contra glicoproteína spike en caso del SARS-CoV-2, la duración de estos anticuerpos es en promedio 6 meses;1 la segunda, es ocasionada por la administración de vacunas que llevan consigo virus muertos o atenuados, proteínas antigénicas o porciones de ADN/ARN generando la activación de la respuesta inmune y producción de anticuerpos neutralizantes.
La cuantificación de estos anticuerpos ha sido el mejor indicador para evaluar la actividad protectora de las vacunas contra la COVID-19.2 Por lo tanto, las infecciones y la vacunas inducen la respuesta inmune culminando en la producción de anticuerpos listos a bloquear o mitigar el nuevo ingreso del agente infeccioso, tal como un estudio que encontró menor carga viral de SARS-CoV-2 en personas vacunadas con dos dosis y que padecieron de la COVID-19, en comparación con los vacunados sin antecedente de infección COVID-19.3 En base a esto se conoce que la vacunación a personas con infección previa por SARS-CoV-2 proporciona una protección superior en comparación con la vacunación en ausencia de infección previa.
A pesar de esto un porcentaje significativo de personas inmunizadas continuaron presentando infección sintomática, por lo que se aprobaron el uso de dosis de refuerzo o booster después de dos dosis con el objetivo de incrementar los títulos de anticuerpos neutralizantes y disminuir los casos graves.4
La inmunidad híbrida es la respuesta inmunitaria de las personas infectadas por la COVID-19 que recibieron la vacuna contra el SARS-CoV-2. Esto se debe a la generación de memoria inmunitaria influenciada por los linfocitos B y T activados durante la infección primaria y potenciados por la exposición al antígeno viral de la vacuna. Esta combinación es más potente que la inmunidad que se genera después de la vacunación o la infección solo.5,6 En un estudio realizado en trabajadores de salud que recibieron una sola dosis de vacuna y se infectaron con la COVID-19, los niveles de anticuerpos IgG fue tres veces más alta que los no infectados con una sola dosis y las personas que recibieron dos dosis y se infectaron con la COVID-19, tuvieron dos veces más anticuerpos que el grupo que recibió dos dosis sin infección.7
Se desconoce si los procesos infecciosos por COVID-19 después de recibir los refuerzos de vacunas luego de la segunda dosis continuarán elevando la inmunidad híbrida, o este incremento no será tan notable después de la tercera dosis alcanzando o llegue a un pico máximo de sinergia positiva; (8,9 por lo que el objetivo de la presente investigación es comparar la inmunidad híbrida de la vacuna SARS-CoV-2 después de la segunda y tercera dosis en trabajadores de la salud de un hospital público de Perú.
Material y métodos
Diseño del estudio
Se realizó un estudio de cohorte prospectivo del personal de salud mayor de 18 años en Huancayo, Perú. Este estudio contó con la aprobación del Comité de Ética del Hospital “Daniel Alcides Carrión” y los resultados fueron informados a la Oficina de Epidemiología del hospital. Los participantes fueron evaluados en el momento de la aplicación de la vacuna, a los seis meses después de la segunda dosis y seis meses después de la tercera dosis de la vacuna para cuantificar la producción de anticuerpos neutralizantes (NAb) y anticuerpos IgG específicos. Se completó en cada evaluación un cuestionario que incluía antecedentes de infección por la COVID-19.
Población de estudio y criterios de selección
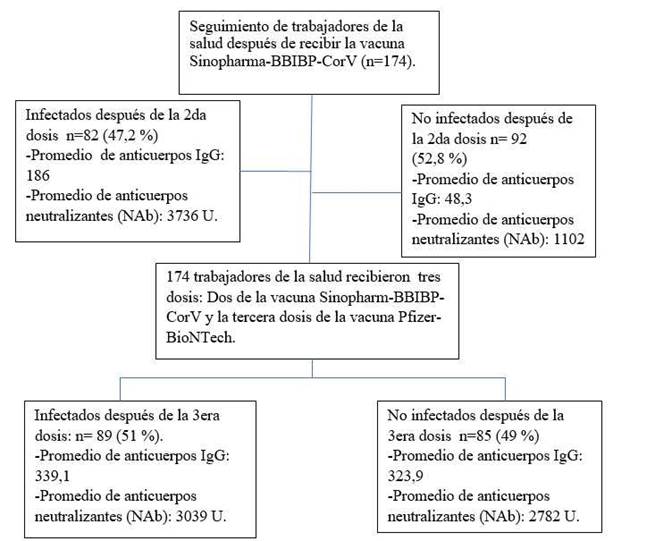
De un total de 1 200 trabajadores de salud, inicialmente ingresaron al estudio 190 personas previa firma de consentimiento informado y mediante el enrolamiento consecutivo no aleatorizado. Se incluyó a las personas que completaron las tres dosis de la vacuna, autorización para la toma de muestra, resultado no indeterminado, la muestra de sangre obtenida en el momento indicado y datos completos. Finalmente 174 personas completaron el estudio (Figura 1). Para determinar el tamaño muestral se utilizó el método de proporciones mediante el programa estadístico STATA V.14, las proporciones utilizadas fueron obtenidas del estudio piloto previo de esta misma base; donde 96 % de los personas que recibieron la tercera dosis e infección previa desarrollaron títulos elevados de anticuerpos y 85 % de los inmunizados sin infección previa, por lo que se consideró 80 % como poder de la muestra; el valor p fue 0,05; el tamaño muestral obtenido fue 190 incluyendo 20 % por probables pérdidas. Sin embargo, 174 completaron el estudio, el cálculo del poder de esta muestra (n=174) fue 76 %.
Procedimiento
El seguimiento de los participantes comenzó el 5 de febrero de 2021 (día en que comenzó la vacunación contra la COVID-19 en Perú), y continuó hasta el 26 de junio de 2022, período que abarcó 6 meses después de la tercera dosis. Los participantes que se inscribieron después del 5 de febrero de 2021 (aquellos con ingreso retrasado) fueron seguidos desde la fecha de su inscripción. Los participantes no vacunados no ingresaron al estudio. Todos los participantes recibieron dos dosis de la vacuna Sinopharma- BBIBP-CorV y la tercera dosis de la vacuna Pfizer-BioNTech BNT162b2.
Los participantes contestaron el cuestionario de recopilación de datos y la primera extracción de sangre coincidió con la primera vacuna. Posteriormente, se coordinó con todos los inscritos para continuar con el seguimiento. Las siguientes evaluaciones fueron a los seis meses después de la segunda dosis y seis meses después de la tercera dosis de la vacuna para cuantificar la producción de anticuerpos neutralizantes (NAb) y anticuerpos IgG específicos. En cada evaluación se volvió a completar un cuestionario que incluía datos de información clínica de infección por la Covid-19, severidad de la enfermedad, hospitalización, requerimiento de oxígeno, comorbilidades médicas y método de confirmación de la infección por SARS-CoV-2.
La muestra de sangre se recogió en tubos con heparina sódica y se centrifugó a 200 durante 10 minutos con el fin de separar el plasma. Este plasma fue nuevamente centrifugado a 1 200 para eliminar los residuos, se recogió el plasma y se inició el procesamiento de la muestra con el uso del equipo de inmunofluorescencia para cuantificar los anticuerpos neutralizantes (NAb) contra la nucleocápside del SARS-CoV-2 y los anticuerpos contra la proteína espiga (S) de tipo IgG.
Análisis estadístico
Se utilizó Microsoft Excel para Windows para el procesamiento de doble entrada de datos y para el análisis estadístico se utilizó el programa STATA versión 14.0 para Windows (STATA Corp, College Station, TX, EE. UU.). Inicialmente se evaluó una descripción de las características generales según los antecedentes de la COVID-19. Las variables categóricas se compararon mediante Chi-cuadrado o la prueba exacta de Fisher, según correspondiera, mientras que las variables numéricas se compararon mediante la prueba Test de Student. Además, se calculó la media y la desviación estándar (DE) de los títulos de anticuerpos según se tratara de la segunda o tercera dosis de la vacuna. Se comparó el promedio de las concentraciones de anticuerpos según el evento de infección por SARS-CoV-2.
Resultados
La tabla 1 muestra las características generales de los trabajadores de salud que completaron el estudio, el promedio de la edad fue 39 años, el sexo femenino representó 76,4 % de los participantes. La profesión más frecuente fue enfermería con 44,8 % seguido por los médicos con 24,7 %.
Tabla 1 Características generales de los participantes infectados por la COVID-19 después de la tercera dosis de vacuna
| Característica | Total (n=174) |
|
|
p* |
|---|---|---|---|---|
| Edad, años: x(SD) | 39 (13,1) | 39,4 (11,2) | 39,5 (11,8) | 0,98 |
| Edad <60 años | 123 (70,7 %) | 59 (66,3 %) | 64 (75,3 %) | 0,589 |
| Sexo: n(%) | ||||
| Masculino | 41 (23,6 %) | 21 (23,6 %) | 65 (76,4 %) | 0,567 |
| Femenino | 133 (76,4 %) | 68 (76,4 %) | 20 (23,5 %) | |
| Profesión | ||||
| Médico | 43 (24,7 %) | 21 (23,5 %) | 22 (26,2 %) | 0,674 |
| Enfermera | 78 (44,8 %) | 40 (44,9 %) | 38 (45,2 %) | 0,892 |
| Técnologo médico | 28 (16,1 %) | 15 (16,8 %) | 13 (15,4 %) | 0,781 |
| Administrativo | 25 (14,4 %) | 10 (11,2 %) | 15 (17,8 %) | 0,497 |
| Producción de anticuerpos | ||||
| NAb : x(rango) | 2990,1 (13,7-19865,0) | 3039 (3490,5) | 2782,4 (1453,9) | 0,685 |
| IgG: x(rango) | 331,6 (3,1-465) | 339,1 (59,4) | 323,9 (101,7) | 0,446 |
| Comorbilidad | 22 (18,4 %) | 10(11,2 %) | 12 (14,1 %) | 0,198 |
| Obesidad | 9 (7,6 %) | 7(7,8 %) | 2 (2,4 %) | 0,079 |
SD: Desviación estándar. X: media; NAb: Anticuerpos neutralizantes; IgG: Anticuerpo Inmunoglobulina G contra la proteína espiga (S) del SARS-CoV-2; *El test exacto de Fisher fue usado para calcular el valor de p en el caso de variables categóricas y el Test de Student fue usado para variables numéricas.
La producción de anticuerpos IgG 6 meses después de la segunda dosis de la vacunación fue de 186 U como promedio en el grupo con infección y de 48,3 en el grupo que no padeció por la COVID-19 (p=0,001). La producción de anticuerpos IgG con la tercera dosis no mostró diferencia significativa entre ambos grupos (p=0,446). La producción media de NAb fue 3039 U en el grupo previamente infectado y 2782 U en el grupo sin infección previa (p=0,685). (Tabla 2).
La falta de respuesta a la vacuna se evidenció en el 20 % del grupo que se infectó por la COVID-19 después de la segunda dosis y en el 37 % del grupo que no llegó a infectarse (p=0,023). Ningún participante mostró IgG inferior a 50 U en el grupo de personas que se infectó con la COVID-19 después de la tercera vacuna, mientras 1,2 % de los participantes no se infectaron con la COVID-19 después de la tercera dosis (p=0,437).
Tabla 2 Producción de anticuerpos después de la segunda y tercera dosis de la vacuna, comparada con el momento de infección por la COVID-19
| Anticuerpo | ||||||
|---|---|---|---|---|---|---|
| IgG: X;SD | 186,7 (204,2) | 48,3 (113,6) | 0,001 | 339,1 (59,9) | 323,9 (101,7) | 0,446 |
| NAb: X ; SD | 3736,4 (8294,8) | 1102,9 (3907,7) | 0,009 | 3039,4 (3490,5) | 2782,3 (1453,9) | 0,685 |
| No respondedores | ||||||
| IgG<50 | 35 (20,1 %) | 65 (37,3 %) | 0,023 | 0 (0 %) | 2 (1,2 %) | 0,437 |
| NAb <10 | 5 (2,8 %) | 14 (8,1 %) | 0,031 | 0 (0 %) | 1 (0,6 %) | 0,593 |
| Neumonía COVID-19, después de la segunda dosis* | 3 (1,7 %) | 7 (4,1 %) | 0,891 | 0 | 0 | - |
*Requirió oxígeno; SD: Desviación estándar. X: media; NAb: Anticuerpos neutralizantes; IgG: Anticuerpo Inmunoglobulina G contra la proteína espiga (S) del SARS-CoV-2.
*Se utilizó la prueba exacta de Fisher para calcular el valor de p en el caso de variables categóricas, y la prueba Test de Student para variables numéricas.
Los valores de NAb menores de 10 U se encontraron en 2,8 % de los participantes que desarrollaron la COVID-19 después de la segunda vacuna, mientras que en el grupo no infectados fue 8,1 % (p=0,031). Todos los participantes que desarrollaron la COVID-19 después de la tercera vacuna presentaron NAb mayores de 10 U y en el grupo sin infección fue 0,6 %. (Tabla 2).
La producción de anticuerpos IgG fue mayor cuando la persona que recibió dos dosis de la vacuna también se infectó con la COVID-19 post vacuna. Cuando se analizó la producción de anticuerpos con la tercera dosis, se evidenció que los pacientes que se infectaron después de la tercera dosis no aumentaron significativamente el número de anticuerpos, manteniéndose similar en ambos grupos (Figura 2).
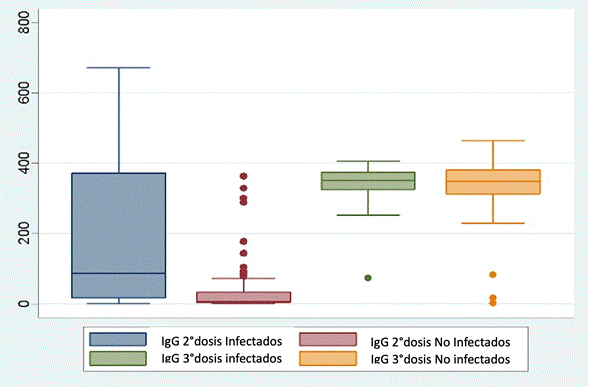
Figura 2 Comparación cuantitativa de anticuerpos IgG contra el SARS-CoV-2 después de la segunda y tercera dosis de la vacuna, según el momento de superposición de infección por COVID-19. IgG 2° dosis infectados: Cuantificación de anticuerpos en el grupo de personas que se infectaron después de la segunda vacuna recibida; IgG 3° dosis infectados: Cuantificación de anticuerpos en el grupo de personas que se infectaron después de la tercera vacuna; IgG 2° dosis no infectados: Cuantificación de anticuerpos en el grupo de personas que no se infectaron después de recibir la segunda vacuna.
Discusión
Si bien los estudios han demostrado las ventajas de la inmunidad híbrida en personas vacunadas y previamente infectadas por la COVID-19, se ha cuestionado la permanencia de la inmunidad híbrida a partir de la tercera dosis de refuerzo y la durabilidad de la protección.10,11 En este estudio, la inmunización con dos dosis de Sinopharma- BBIBP-CorV en personas que además padecieron la COVID-19 presentaron anticuerpos tres veces más alta que el personal inmunizado sin registro de la COVID-19, lo que resultó en una alta inmunidad híbrida al igual que otros estudios.12,13
Los datos sobre la inmunidad híbrida con la tercera dosis son escasos, pero los que existen son consistentes con los hallazgos de este estudio que muestran que la tercera dosis mejora la respuesta inmune neutralizante independientemente del historial de infección.14,15 En este trabajo el promedio de anticuerpos generado por la tercera dosis en personas infectadas con la COVID-19 fue superior en 10 % comparado con los inmunizados con las tres dosis sin infección por la COVID-19, esta diferencia ya no es significativa como en la segunda dosis, donde los anticuerpos son 300 % más alto en inmunizados e infectados. Un estudio que comparó las personas infectadas y sin infección previa después de las tres dosis de la vacuna ARNm, informó que la concentración de células T CD4 específicas de la proteína S no fueron significativos entre los dos grupos, pero si las células T CD4 productoras de IFN-g e IL-10 fueron superiores en las personas infectadas.16 Otro estudio encontró que con dosis de vacuna los títulos de anticuerpos específicos y células T CD8 fueron más altos en los infectados previamente, pero similar con tres dosis, estos datos sugieren que la combinación de la respuesta humoral como celular a la glicoproteína S puede ser la base de la inmunidad híbrida.17
En relación con las mutaciones, la infección anterior con las variantes Beta y Delta desarrollaron protección contra la reinfección durante los primeros tres meses, pero a los seis meses disminuyó en 87 % y posteriormente se demostró que tienen una mayor propensión a la reinfección, lo que indica que la infección por sí sola no producirá inmunidad pan variante.18,19 Asimismo, la infección por algunas cepas como Omicron puede inducir una menor producción de anticuerpos neutralizantes que la Delta;20,21 esto puede explicar los hallazgos encontrados donde la variante predominante fue Delta durante la administración de la segunda vacuna y Omicron con la tercera dosis.
Las vacunas aumentan la inmunidad natural al incrementar los títulos de anticuerpos después de la segunda vacuna en el contexto de una infección previa, con la tercera dosis, este sinergismo inmune deja de ser significativo, confirmándose que la inmunidad híbrida es efectiva en personas con al menos dos dosis de vacuna y anticuerpos cuantitativamente similar a personas con tres dosis de vacuna sin infección previa.22,23
Las diferencias de la inmunidad híbrida se normalizaron con la administración de la tercera dosis, donde las concentraciones de NAb e IgG fueron similares; esto también fue observado por algunos estudios que demostraron que la tercera dosis en pacientes infectados no indujo un mayor aumento en las células de memoria T o B, lo que indica que la respuesta inmune sinérgica puede alcanzar su respuesta máxima después de tres dosis de vacuna.24,25 Sin embargo, los refuerzos de vacunación deberían continuar debido a que la duración de los títulos altos de anticuerpos empiezan a descender a partir del sexto mes post vacuna independientemente del antecedente de infección.
Fortalezas y limitaciones
Esta cohorte observacional tiene varios puntos fuertes. En primer lugar, permite la evaluación de la respuesta inmune contra la COVID-19 mediante la determinación de anticuerpos específicos en tiempos definidos. En segundo lugar, los resultados son cuantitativos y estandarizados lo que permite comparar los resultados con otros estudios de inmunidad en la COVID-19.
Una limitación de este estudio es que no se cuenta con valores de anticuerpos previo a la infección por la COVID-19, para determinar la variación de los niveles de anticuerpos, esto puede ser posible si se cuantifica mensualmente los niveles de IgG y NAb. Sin embargo, esto no resta valor al objetivo principal de cuantificar y comparar los anticuerpos después de la 2da y 3era dosis y comprender la inmunidad híbrida en esta población durante al menos un período de 12 meses de seguimiento.
Conclusiones
Este estudio proporcionó información sobre la alta respuesta inmunitaria híbrida después de la segunda dosis, además los resultados informaron que es una prioridad completar la tercera dosis de refuerzo a todas las personas para lograr la producción de un nivel adecuado de anticuerpos contra el SARS-CoV-2 independientemente de la historia de infección por la COVID-19.