Introducción
La gamma glutamil transferasa (GGT) es un reconocido marcador de enfermedades hepatobiliares y del consumo crónico de alcohol.1 Sin embargo, su utilidad predictiva va más allá de las enfermedades del hígado.
La elevación de los niveles de GGT está asociada a un incremento en el riesgo de diversas enfermedades como las cardiovasculares y metabólicas, entre ellas obesidad, síndrome metabólico, diabetes mellitus, enfermedades coronarias e isquemia cerebral, del sistema immunitario como el cáncer, la artritis reumatoide y otras.2,3,4,5
El mecanismo de las asociaciones entre la GGT y los trastornos mencionados no se ha esclarecido totalmente.
Una de las funciones más conocidas de la GGT es su papel en la homeostasis del glutatión, un importante antioxidante endógeno que permite la eliminación de xenobióticos y especies reactivas de oxígeno del organismo, y protege contra las enfermedades y el estrés oxidativo crónico, asociado a la generalidad de los trastornos mencionados.
La GGT hidroliza al glutatión degradándolo, conjuntamente con una dipeptidasa, a sus aminoácidos constituyentes (glutámico, cisteína y glicina), que son retomados por las células para realizar la síntesis de novo del glutatión, el cual participa en funciones biológicas importantes (Fig. 1).
Cuando la GGT se encuentra sobreexpresada, la hidrólisis o degradación del glutatión ocurre de forma descontrolada, con lo cual pierde todas sus propiedades protectoras antioxidantes y se genera un estrés oxidativo crónico.6

Fig. 1- Estructura química del glutatión (GSH) y su degradación por la gamma glutamil transferasa (GGT).
La GGT se localiza en la superficie externa de la membrana del plasma y en varios tipos de células y fluidos corporales. Aunque aún no se ha determinado cómo la GGT es liberada extracelularmente, estudios previos han demostrado que su producción por células linfocitarias y otras puede ser elevada en respuesta a un estrés oxidativo.7 Se han encontrado altos niveles de GGT en el fluido sinovial de pacientes con artritis reumatoide, aparentemente debido a que la GGT, procedente de linfocitos o células inflamatorias, se acumula en las lesiones artríticas.7
Al estrés oxidativo crónico, asociado a la inflamación en la artritis reumatoide avanzada, se adiciona la destrucción del hueso, proceso en el que la GGT va a desempeñar un papel patológico relevante. La destrucción ósea está mediada por una excesiva formación de osteoclastos, los que degradan patológicamente el hueso, antes de que ocurra la formación de nuevas estructuras óseas.8
Algunos estudios in vitro e in vivo han demostrado que la GGT puede afectar el metabolismo óseo a través de mecanismos locales y sistémicos. Ratones transgénicos que sobreexpresaron GGT, sistémica o localmente, en el tejido esquelético manifestaron osteopenia y deterioro microestructural, el cual se atribuyó a un incremento en la reabsorción ósea y una disminución en la formación de hueso, como se evidenció por histomorfometría.9 Un estudio clínico sugirió que la GGT podía ser un marcador de la reabsorción del hueso en humanos. Los autores demostraron que la excreción urinaria de GGT tuvo una alta correlación con la deoxipiridinolina, un marcador bioquímico de reabsorción ósea establecido, en un estudio de mujeres posmenopaúsicas.10
Considerando los antecedentes expuestos, se evidencia que un marcador convencional, disponible en cualquier laboratorio clínico, permite evaluar dos importantes eventos muy relacionados durante el curso evolutivo de la artritis reumatoide: el estrés oxidativo crónico (erosivo e inductor de citocinas proinflamatorias) y la reabsorción ósea causada por una osteoclastogénesis descontrolada.
Además, se había demostrado que la terapia combinada de metotrexate + ozono médico potenció la respuesta clínica, en pacientes con artritis reumatoide, comparado con pacientes que solo recibieron el metotrexate. Los marcadores clínicos convencionales (DAS 28, HAQ-DI, dolor, proteína C reactiva y velocidad de sedimentación globular) correlacionaron significativamente con las concentraciones de glutatión reducido en los pacientes que recibieron la terapia combinada metotrexate + ozono,11 y como ya se mostró en la figura 1, la GGT está estrechamente relacionada con la homeostasis o destrucción del glutatión.
Asociando estos antecedentes, el objetivo de este trabajo es investigar si el ozono médico es capaz de regular la GGT, considerando que uno de los mecanismos de acción del ozono es el mantenimiento del estado antioxidante/prooxidante de la célula, y si estos efectos se correlacionaban con el glutatión (antioxidante) y la respuesta clínica de pacientes con artritis reumatoide tratados con metotrexate + ozono. Basados en la evidencia, se propone el empleo de la GGT, marcador disponible en la generalidad de los laboratorios clínicos, como un indicador que permite dar seguimiento a la respuesta clínica del ozono en esta disfunción artrítica.
Métodos
Se realizó un estudio clínico controlado, y al azar, que fue aprobado por los Consejos Científicos y Comités de Ética de las instituciones involucradas (Instituto de Farmacia y Alimentos de la Universidad de La Habana y el Centro de Reumatología de Cuba) y en correspondencia con los principios de la Declaración de Helsinki de 2005.12
Todos los pacientes ofrecieron su consentimiento informado para su incorporación a la investigación, después de recibir una información adecuada, concerniente al estudio (sus características, beneficios y posibles efectos indeseables). Todos los profesionales que participaron en el estudio asistieron a un programa de entrenamiento para familiarizarlos con los objetivos y los planes de tratamiento. Se les recalcó a los médicos participantes, que cada paciente se trataría al azar con los esquemas de tratamiento previstos, mediante el empleo de una tabla de aleatorización.13
Para calcular el tamaño de la muestra se empleó el Sistema Medstat, Inc. (versión 2.1, 1989; Fridley, MN). La diferencia estadística entre el comienzo y el fin de la terapia con ozono fue de 0,2, con un error tipo 1 de 0,05.14 Se incluyó en el estudio un total de 50 pacientes.
Criterios de inclusión: Fueron elegibles para participar en el estudio los pacientes adultos, mayores de 18 años, de uno y otro sexos y diferentes orígenes étnicos, con un diagnóstico de artritis reumatoide y que cumplieran con los criterios actualizados de la Asociación Americana de Reumatología.15 Fueron escogidos los pacientes atendidos en el Centro Nacional de Reumatología de Cuba, quienes cumplieron, además, con los criterios siguientes: sistema Disease Activity Score-28 (DAS 28) > 3,2 ≤ 5,1, cuyo examen fue llevado a cabo, a ciegas, por un reumatólogo diferente al que seleccionaba, inicialmente y al azar, a los pacientes de acuerdo con el esquema de tratamiento y una preliminar y breve anamnesis. También se consideraron los resultados de los anticuerpos contra péptidos cíclicos citrulinados séricos (anti-PCC > 10 U/mL), HAQ-DI, de acuerdo con la versión española validada,16 proteína C reactiva y velocidad de sedimentación globular.
Criterios de exclusión: no se incluyeron en el estudio a los pacientes con antecedentes de enfermedades crónicas como alteraciones del hígado, diabetes mellitus, trastornos respiratorios, enfermedades cardiovasculares, abuso del alcohol y hábito de fumar, pacientes con síndromes que se superponen a la artritis reumatoide como cáncer y enfermedades autoinmunes y a las mujeres embarazadas. También se excluyó a los pacientes que hubieran recibido tratamiento con otros fármacos modificadores de la enfermedad, diferentes al metrotexate, anti-TNF u otros agentes biológicos, por al menos 3 meses antes del estudio.
Los pacientes fueron distribuidos, al azar, en dos grupos de tratamiento diferentes: Grupo Metotrexate (12,5 mg, intramuscular, una vez por semana, cada lunes de 9:00 a 10:00 a.m.) + ibuprofeno (400 mg, oral, una tableta cada 8 horas)+ácido fólico (5 mg, oral, una tableta al día de miércoles a sábado).
Grupo Metotrexate + ozono médico: igual que el grupo anterior, pero incorporando el ozono, como se describe a continuación. El ozono fue generado por un equipo OZOMED, CNIC, Cuba. Se administraron 20 tratamientos (1 ciclo) por insuflación rectal (5 veces por semana, de lunes a viernes), en un rango de concentración de 20-35 mg/L de forma escalonada y creciente:
Determinaciones bioquímicas: Las muestras de sangre para los ensayos bioquímicos se obtuvieron durante la noche después de un ayuno de 12 h. Las determinaciones bioquímicas se realizaron al comienzo y 24 h después del último tratamiento con ozono (día 21 después de iniciado el estudio).
Los anticuerpos contra péptidos cíclicos citrulinados se determinaron mediante un kit ELISA (DRG Diagnostics, GmbH, Alemania) (sensibilidad del 90 %, especificidad 98,3 % y eficacia diagnóstica 95,3 %). La proteína C reactiva se analizó con un ensayo de aglutinación (ensayo Latex CRO) (BioSistems S.A. Reagent and Instruments Costa Brava 30, Barcelona, España) y la velocidad de sendimentación globular se obtuvo mediante el método cuantitativo de Westergreen.
La actividad de la GGT y el GSH se halló en suero. La GGT se estimó en un equipo HITACHI (Japón) con un kit compatible. El GSH se cuantificó en un lector de placas SUMA, Cuba, a 412 nm. Después de la precipitación de los tioles proteicos, con ácido tricloro acético al 10 %, se determinó el glutatión reducido (GSH) según el reactivo de Ellman (5´5 dithiobis [ácido 2-nitrobenzoico] 10-2 M [Sigma St Louis, MO,USA]),17
Análisis estadístico: Inicialmente se usó el ensayo de OUTLIERS para la eliminación de puntos aberrantes. Después se procesaron los datos con el análisis de varianza de una vía (ANOVA one way), seguido de un ensayo de homogeneidad de varianza (Bartlett-Box). Además, se utilizó un ensayo de comparación múltiple (Student-Newman-Keuls). Para los estudios de linealidad se empleó el coeficiente de correlación de Pearson. Los resultados se presentan como la Media ± DE de la media. Como nivel de significación estadística se utilizó, al menos, p < 0,05.
RESULTADOS
Características generales de los pacientes involucrados en el estudio: Ambos grupos fueron similares, en su distribución al azar, por tipo de tratamiento (p > 0,05) (Tabla 1). No se observaron diferencias entre los grupos (MTX y MTX + ozono) con respecto a la edad, terapia previa y tiempo de evolución de la AR. Con respecto al sexo, los resultados fueron similares a otros informes en los que predominó el sexo femenino. Las mujeres son afectadas por esta enfermedad autoinmune alrededor de 3 veces más frecuentemente que los hombres, pero la causa de esta diferencia se desconoce. Se observó un incremento en pacientes de raza blanca.
Tabla 1. - Cuadro clínico de los pacientes incluidos en el estudio
| Datos demográficos / Historia de los pacientes | Grupo MTX (n = 50) | Grupo MTX + ozono (n = 50) |
| Sexo | ||
| Femenino (n/%) | 47/94 | 48/96 |
| Masculino (n/%) | 3/6 | 2/4 |
| Edad | 53 ± 8a | 57 ± 7a |
| Terapia previa | ||
| Metotrexate (n/%) | 50/100 | 50/100 |
| Corticosteroides | 0 | 0 |
| Tiempo de evolución de la enfermedad (años) | 7 ± 2a | 11 ± 3a |
| Color de la piel | ||
| Blanca (n/%) | 37/74 | 41/82 |
| Mestiza (n/%) | 13/26 | 9/18 |
Fuente: Historia clínica.
Grupo MTX: MTX + ibuprofeno + ácido fólico.
Grupo MTX + ozono: igual que el MTX pero se incorporó el ozono médico.
Los datos que reflejan la edad y el tiempo de evolución de la enfermedad
se expresan como la media ± desviación estándar. Medias con letras
diferentes indican diferencias significativas p < 0,05.
Comportamiento de las variables clínicas principales al comienzo y al final del estudio:
Al comienzo del estudio el grupo tratado con la terapia combinada MTX + ozono mostró una intensidad del dolor más alta que los pacientes que solo recibieron MTX.
Al final del experimento (21 días) se apreció una disminución significativa para los pacientes con la terapia combinada, no así para los tratados solo con MTX. Las variables DAS 28, HAQ-DI, proteína C reactiva y la velocidad de sedimentación globular exhibieron un cuadro semejante al de la variable dolor.
Los resultados con los anticuerpos contra los péptidos cíclicos citrulinados fueron los siguientes: mientras que los pacientes que recibieron MTX+ozono disminuyeron los títulos de estos autoanticuerpos, los tratados con MTX no modificaron los niveles de anti-PCC. Al final del estudio, el análisis estadístico entre los dos grupos de tratamiento evidenció que todas las variables clínicas mejoraron significativamente para la terapia combinada MTX + ozono con respecto a los pacientes que recibieron la monoterapia (MTX) (Tabla 2).
Tabla 2. - Características clínicas de los pacientes con artritis reumatoide al comienzo y al final del estudio
| Variables clínicas | Grupo MTX (n = 50) | Grupo MTX+ozono (n = 50) | ||
| Inicio | Final | Inicio | Final | |
| Dolor | 8,2 ± 0,4a | 7 ± 0,6a | 9,2 ± 0,3a | 4,7 ± 0,3b,c |
| DAS28 | 5,6 ± 0,3a | 5,2 ± 0,3a | 6,4 ± 0,2a | 3,2 ± 0,3b,c |
| HAQ-DI | 1,3 ± 0,1a | 1,1 ± 0,1a | 1,8 ± 0,1a | 0,7 ± 0,0b,c |
| PCR | 21 ± 7a | 13 ± 4a | 16 ± 4a | 5 ± 1b,c |
| VSG | 40 ± 6a | 40 ± 6a | 36 ± 6a | 20 ± 4b,c |
| Anti-PCC | 102 ± 3a | 119 ± 3a | 107 ± 6a | 89 ± 3b,c |
Fuente: Historia clínica
Grupo MTX: MTX + ibuprofeno + ácido fólico.
Grupo MTX+ozono: igual que MTX, pero se incorporó el ozono médico.
DAS28: Actividad de la enfermedad (baja actividad ≤ 3,2;
moderada actividad > 3,2 y ≤ 5,1 y alta actividad > 5,1.
HAQ-DI: Índice de discapacidad (+ > 1,25); PCR: Proteína C reactiva (+ > 6 mg/L en suero);
VSG: Velocidad de sedimentación globular (hombres 7-8 mm, mujeres 11-16 mm);
anti-PCC: Antipéptidos cíclicos citrulinados (+ > 10 U/mL en suero).
Inicio: significa, antes del comienzo del estudio y Final después del último
tratamiento de ozono (21 días después de comenzado el estudio).
Los datos se presentan como la media ± desviación estándar. Valores de la media
con diferentes letras indican diferencias significativas (p < 0,05)
(c) p < 0,05 al final del estudio (21 días): grupo MTX + ozono vs. grupo MTX.
Al final del estudio clínico también se obtuvieron resultados diferentes en los niveles de GGT, glutatión reducido (GSH), y la relación GSH / variables clínicas, en pacientes con AR tratados con MTX y MTX + ozono.
Los efectos del ozono sobre la GGT se muestran en la figura 2 donde se observó una disminución significativa (p < 0,05) de la actividad de la GGT que retornó al intervalo de referencia (0-36 U/L); mientras que el grupo de pacientes que recibió la monoterapia (MTX) mantuvo niveles elevados de GGT.
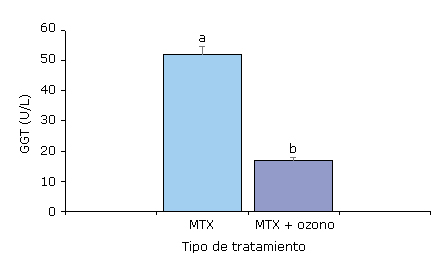
Fig. 2- Niveles de gamma glutamil transferasa (GGT) en pacientes con artristis reumatoide tratados con metrotexate (MTX) y la terapia combinada metrotexate y ozono (MTX+ozono) al final del estudio (20 tratamientos) de ozono por insuflación rectal. Los datos se presentan como la media ± desviación estándar. Los valores de la media con diferentes letras indican diferencias significativas (p < 0,05).
En otro estudio que se encuentra en fase de desarrollo sobre osteoartritis de rodilla (grados III-IV) en pacientes que requieren una artroscopía terapéutica se encontró que el grupo de pacientes (n = 20) que recibió un tratamiento prequirúrgico con ozono (20 tratamientos por insuflación rectal) redujo significativamente los niveles de GGT antes de la intervención quirúrgica, comparado con las concentraciones de GGT de pacientes (n = 20) que solo iban a recibir la artroscopía (Fig. 3).
Estos resultados sugieren que los pacientes que fueron precondicionados con el ozono médico recibían la artroscopía en condiciones más favorables, en cuanto a estrés oxidativo y otros riesgos, comparados con los pacientes que no recibieron el tratamiento prequirúrgico.
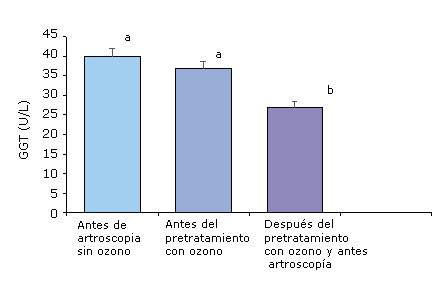 Antes de artroscopia sin ozono: pacientes solo con análisis preoperatorio antes de la artroscopíaAntes del pretratamiento con ozono: pacientes que aún no habían recibido el ozono prequirúrgico.Después del pretratamiento con ozono y antes de la artroscopía: pacientes que recibieron 20 tratamientos de ozono, previos a la artroscopía. Los datos se presentan como la media ± desviación estándar. Los valores de la media con diferentes letras indican diferencias significativas (p < 0,05).
Antes de artroscopia sin ozono: pacientes solo con análisis preoperatorio antes de la artroscopíaAntes del pretratamiento con ozono: pacientes que aún no habían recibido el ozono prequirúrgico.Después del pretratamiento con ozono y antes de la artroscopía: pacientes que recibieron 20 tratamientos de ozono, previos a la artroscopía. Los datos se presentan como la media ± desviación estándar. Los valores de la media con diferentes letras indican diferencias significativas (p < 0,05). Fig 3- Niveles de gamma glutamil transferasa (GGT) en pacientes con osteoartritis de rodilla que requieren una artroscopía terapéutica y reciben como único tratamiento fármacos antiinflamatorios no esteroideos.
Como ya habíamos mencionado, la GGT se encuentra estrechamente relacionada con los niveles de GSH, donde un incremento de la GGT va a conducir a una degradación del GSH, que acentúa el estrés oxidativo y el daño articular y al hueso en pacientes con AR (véase la figura 1).
Cuando se evaluaron los efectos del ozono sobre las concentraciones de GSH, se obtuvieron los resultados que se muestran en la figura 4, donde se apreció un incremento significativo de este antioxidante endógeno para la terapia combinada MTX + ozono con respecto a los pacientes que solo recibieron la monoterapia (MTX).
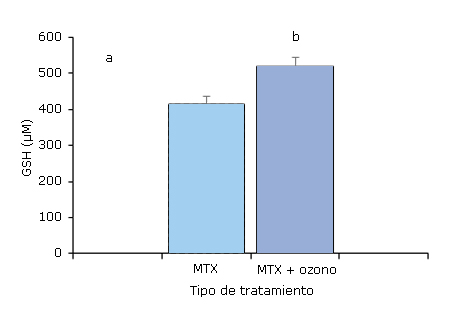
Fig. 4- Niveles de glutatión (GSH) en pacientes con artritis reumatoide tratados con metrotexate (MTX) y la terapia combinada metrotexate y ozono (MTX+ozono), al final del estudio (20 tratamientos de ozono por insuflación rectal). desviación estándar. Los valores de la media con diferentes letras indican diferencias significativas (p < 0,05).
Las correlaciones lineales entre los marcadores redox y las variables clínicas estudiadas evidenciaron que el único biomarcador que correlacionó con todas las variables clínicas fue el GSH en el grupo tratado con MTX + ozono (Tabla 3).
Tabla 3. - Correlación entre el GSH y las variables clínicas en pacientes con artritis reumatoide tratados con MTX + ozono al final del estudio
| Variables | Coeficiente de correlación | Significación estadística |
| GSH |
0,68 | p = 0,007 |
| GSH |
0,63 | p = 0,016 |
| GSH |
0,576 | p = 0,031 |
| GSH |
0,725 | p = 0,003 |
GSH: glutatión reducido; PCR: Proteína C reactiva; VSG: Volumen de sedimentación globular; DAS28: Registro de la actividad de la enfermedad; HAQ-DI: Índice de discapacidad.
Para comprobar si existía una relación entre los niveles de GGT y las concentraciones de GSH atendiendo a su relación funcional en la población de pacientes con AR tratada con la terapia combinada MTX + ozono, se evaluó el coeficiente de correlación de Pearson (GSH vs. GGT), con los resultados siguientes: en el 70 % de los pacientes se demostró una correlación lineal negativa, o sea, en la medida en que incrementaba la GGT disminuía el GSH (figura 1) con coeficiente de correlación de -0,61 y una significación estadística de 0,013 (p < 0,05).
DISCUSIÓN
Con el ozono médico se pudo regular las concentraciones de la GGT en dos enfermedades artríticas: AR y osteoartritis de rodilla.
La GGT se considera un indicador de estrés oxidativo.18 Cuando el estrés oxidativo se instaura en la AR, activa el factor de transcripción nuclear NF-kB y promueve la liberación de citoquinas proinflamatorias, metaloproteinasas y otras moléculas que dañan el cartílago y hueso. Además, el estrés oxidativo crónico, debido a una sobreproducción de especies reactivas de oxígeno, oxida a las proteínas que, una vez transformadas por oxidación, pueden conducir a una respuesta inmunitaria y activación de linfocitos artritogénicos.19
El hueso es un tejido metabólicamente activo y tanto su formación como la reabsorción ocurren durante toda la vida. Este proceso de remodelación es el origen de la masa ósea y está regulado por muchos factores: locales y sistémicos.20
Estudios in vitro e in vivo han demostrado que la GGT afecta el metabolismo óseo. Tanto la deficiencia como el exceso de GGT están involucrados en la remodelación anormal del hueso, lo que causa una disminución de la masa ósea.6 La deficiencia de GGT es una enfermedad recesiva autosómica muy poco frecuente, desde el punto de vista clínico, y solo se han notificado unos pocos casos en el mundo.21,22 En cambio, se pueden encontrar muchos pacientes con un exceso de GGT. Por lo tanto, el exceso de GGT, más que su deficiencia, es clínicamente relevante para la salud.6
Otro importante papel patológico de la GGT, asociado al metabolismo óseo, es su capacidad de activar la osteoclastogénesis. Un estudio realizado en 462 sujetos humanos (289 hombres y 173 mujeres) a quienes se les evaluó la densidad mineral ósea demostró que los niveles séricos de GGT (≥ 39 U/L en hombres y ≥ 21 U/L en mujeres) estuvieron asociados con un riesgo incrementado de una masa ósea baja, incluyendo osteopenia y osteoporosis.21 Esto sugiere que la GGT puede afectar el metabolismo óseo. Otros estudios que emplearon ratones transgénicos con una GGT mutada y desprovista de actividad como enzima mostraron que esta fue también tan potente como la GGT enzimática para inducir formación de osteoclastos, lo que indica que esta GGT no actúa como una enzima, sino como una citoquina. 23 La osteopenia en estos ratones se atribuyó a un incremento en la reabsorción ósea y una disminución en la formación del hueso.23 Es interesante que en estos ratones se restableció la deficiencia de cisteína mediante la suplementación con N-acetil cisteína, un precursor del GSH, y se atenuaron las anormalidades esqueléticas.21
Se concluye que la GGT parece afectar la formación del hueso, fundamentalmente, a través de su actividad enzimática sobre el metabolismo del GSH (figura 1) y también incide sobre la reabsorción ósea como una citoquina, independientemente de la actividad enzimática. En esta dirección, otros autores demostraron que la GGT está involucrada en las enfermedades caracterizadas por una osteoclastogénesis patológica y destrucción del hueso.7 Los receptores Toll tipo 4 reconocen a la GGT y activan la osteoclastogénesis asociada con inflamación.7
La GGT es el punto de unión entre el estrés oxidativo y la reabsorción ósea, los que mutuamente se presuponen. La regulación de la GGT por el ozono posee también un interés particular, dado que la GGT se considera un marcador de riesgo de varias enfermedades que constituyen comorbilidades de los pacientes con AR, luego la regulación de esta enzima por el ozono médico, como valor adicional, atenúa los riesgos de estas complicaciones. Algunas de estas comorbilidades se muestran en la tabla 4.
Tabla 4- Algunas enfermedades de riesgo para pacientes con artritis reumatoide, y su relación con los niveles de GGT
| Algunas enfermedad de riesgo | Niveles de GGT (U/L) | Referencias |
| Valor límite | 14 U/L (hombres) 9 U/L (mujeres) | |
| 100% de Riesgo para cáncer, insuficiencia vascular e isquemias (miocardio y cerebral) | > 56 U/L (hombres) > 36 U/L (mujeres) | (24) |
| Insuficiencia renal en estado terminal Incremento de GGT en paralelo con la gravedad de la enfermedad (seguimiento durante 7 años) | 10,5; 14,5; 18,6; 20,2; 21,4; 22,1; 26,6 y 29,2 U/L | (25) |
| Diabetes con microalbuminuria | 35 U/L | (26) |














