Introducción
La esclerosis sistémica (ES) es una enfermedad de causa desconocida, que se caracteriza por una producción exagerada de moléculas que componen la matriz extracelular, particularmente colágena, la cual, paralelamente al proceso inflamatorio, produce fibrosis de los órganos internos.1
Existen muchas evidencias que sugieren que la lesión patológica se inicia en la microvasculatura, y es seguida de trastornos de la regulación del control microvascular para la vasodilatación. La disminución en la producción de óxido nítrico por las células endoteliales de la microvasculatura parece desempeñar un papel central en la patogenia de la enfermedad.1 Los fibroblastos, además de producir matriz extracelular, aumentan la producción de endotelina 1. Las endotelinas corresponden a una familia de péptidos que se derivan del endotelio con amplia variedad de funciones, entre las que se destacan la inducción de vasoconstricción.2
El gen de la endotelina 1 es sobreexpresado durante el proceso de reparación, y su proteína promueve la contracción y migración del fibroblasto. Los pacientes con ES tienen aumento en la producción de endotelina 1, cuyo efecto incrementa la expresión de proteínas procontráctiles como la actina de músculo liso, erzina, paxilina y miosina.2
Desarrollo
Se realizó un estudio de serie de casos con 44 pacientes y una muestra seleccionada de forma no probabilística intencional, de la provincia de Holguín atendidos en la Consulta Provincial de pacientes con ES, del Hospital Clínico Quirúrgico Lucía Íñiguez. El objetivo fue estudiar variables de interés entre las que se evaluó las causas de muerte, así como las reacciones adversas del tratamiento utilizado con ciclofosfamida (CYC) durante 24 meses, estudio ya publicado.3
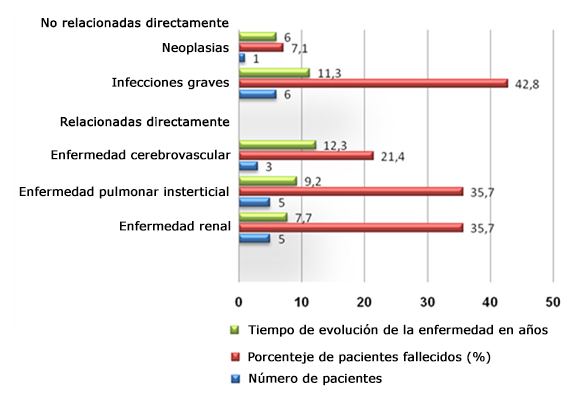
En dicho estudio se concluyó que las principales causas de muerte fueron las relacionadas directamente con la enfermedad renal (la insuficiencia renal aguda por nefropatía y crisis renal esclerodérmica) para un 35,7 % en un tiempo de 7,7 años y la enfermedad pulmonar intersticial (EIP) con igual porcentaje, pero en un periodo de 9,2 años (Fig. 1).3
Las causas no relacionadas directamente con la enfermedad incluyeron las infecciones graves, en este caso, la sepsis grave con fallo múltiple de órganos, que concomitaron con otras causas directas ya relacionadas, y que cobraron la vida de 6 pacientes (42,8 %), pero con diferencia de tiempo en 11,3 años.
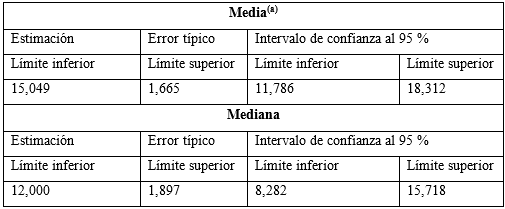
Entre las características de la serie se obtuvo que 30 pacientes permanecían vivos (68,1 %) y 14 estaban fallecidos (31,8 %); 12 pertenecían al sexo femenino (27,2 %) y 2 al masculino (4,5 %), con una media según el tiempo de evolución desde el diagnóstico a la muerte de 15 años, según el procesamiento estadístico realizado (Tabla).
Tabla Procesamiento estadístico de la supervivencia
( a)La estimación se limita al mayor tiempo de supervivencia si se ha censurado.
Entre las reacciones adversas predominaron las manifestaciones gastrointestinales como náuseas, vómitos y diarreas (67,7 %); seguidas de las infecciones (oportunistas a nivel de la piel, respiratorias altas y bajas) para un 48,3 %; asociadas a un bajo nadir de leucocitos, 25,8 %; neoplasias, que apareció en una paciente del sexo femenino con cáncer de pulmón a los 8 meses del uso del esquema terapéutico, descrita posiblemente como más anecdótico que real y dependiente del uso, según estudios realizados, y que representó el 3,2 % (Fig. 2).3
 Leyenda: GI: manifestaciones gastrointestinales.
Leyenda: GI: manifestaciones gastrointestinales.Fig. 2 Efectos indeseables del tratamiento con ciclofosfamida y bajas dosis de prednisona en pacientes con esclerosis sistémica.
Los pacientes con ES tienen un riesgo mayor de padecer de neoplasias; las más asociadas son de mama y pulmón con un riesgo relativo de 8,3 favorecida por la fibrosis pulmonar.4 El cáncer gástrico no se recogió en la literatura con la frecuencia que presupone el terreno de riesgo que condiciona en la enfermedad el llamado síndrome de Barret. La relación temporal entre la ES y el diagnóstico de cáncer sugiere la existencia de bases genéticas similares, una posible causa compartida o un síndrome paraneoplásico.4,5,6,7,8,9
Los cambios que tienen lugar en la patogenia de la enfermedad en los órganos y tejidos son favorecedores de angiogénesis exagerada, apoptosis patológica, necrosis y proliferación celular. Por consiguiente, puede tener lugar el desarrollo de células tumorales.1,2,3
A estos aspectos enunciados se añade el riesgo de neoplasia por el uso de CYC, por su acción citotóxica. Sin embargo, el índice de ocurrencia no es elevado.2,3 Se describe la aparición de neoplasias asociadas aproximadamente a los 7 u 11 años después de haber utilizado el medicamento, preferiblemente por vía oral, y una dosis acumulada de alrededor de 30 g.2,3
Por todo lo anterior, a pesar de no ser suficientes los argumentos científicos que avalen la relación causal entre tratamiento y la aparición del cáncer de pulmón a los 8 meses de iniciada la terapéutica, con solo haber recibido 6 g de CYC por vía intravenosa (según cálculo de dosis) y 6 años de evolución de la ES, no consideramos pertinente registrar este único caso como directamente relacionado con la terapéutica. Quedaría pendiente evaluar si la aparición de la neoplasia estuvo directamente relacionada con la enfermedad.3
El uso de los pulsos intermitentes reduce la toxicidad por CYC, así como adecuar las dosis a rangos terapéuticos y de mantenimiento entre 0,5 y 1 g/m2, las cuales pueden ser alternativas inteligentes para mantener su uso en un tiempo donde inactive la enfermedad o quizás logre regresión de síntomas y signos.1,3
Sobre la aparición de la enferma con cáncer de pulmón, a la que fue necesario interrumpir el esquema terapéutico a los 8 meses de aplicado, es difícil predecir la relación de causa-efecto con el tratamiento. La mayoría de los reportes de la literatura que abordan el tema consideran la presencia de tumores en un lapso de tiempo mayor de haber recibido tratamiento inmunosupresor con CYC, más frecuente para el sexo masculino y localizado en próstata y pulmón.2,3,4,5,6,7
La activación de mecanismos autoinmunes en pacientes con procesos proliferativos ocultos o diagnosticados con cáncer puede asociarse al desarrollo de enfermedades reumáticas autoinmunes, por mecanismos secundarios a la producción de autoanticuerpos, a la presencia de síndromes paraneoplásicos, a la invasión directa de las articulaciones y los músculos por células tumorales, o como consecuencia de quimioterapia combinada durante los tratamientos.1,6,7
Al mismo tiempo, paciente con enfermedades reumáticas autoinmunes tienen un riesgo aumentado de sufrir cáncer. En algunos pacientes, la enfermedad maligna se diagnostica unos meses o años antes que la enfermedad autoinmune se manifieste.8,9,10,11
Los anticuerpos anti nucleares (ANA) son detectados en el suero de los pacientes con cáncer. El suero de los pacientes con enfermedades malignas reacciona contra el ADN, las histonas y los antígenos nucleares extractables (ENAS) Ro, La, Sm y RNP. Los anticuerpos antifosfolipídicos (aPL) y el factor reumatoideo (FR) también pueden encontrarse en estos pacientes.1,6,10,11
En el caso específico de la ES se asocia más a tumores sólidos en alrededor de 7-10 %. Identificar en los pacientes factores de riesgo que predisponen a diferentes tipos de cáncer no sería complejo, más cuando la propia esclerosis sistémica patogénicamente provoca cambios en aparatos y sistemas favorecedores de metaplasia, proliferación anárquica y otros cambios, como es el caso del tumor gastrointestinal en toda su extensión, pulmón, piel, sistema hematopoyético, entre otros.9,10,11
No obstante, en relación con la definición de la causa de muerte, debemos señalar que en varios enfermos se torna difícil precisarla, aunque se disponga del estudio anatomopatológico. Esto se debe a que la esclerosis es una afección compleja en la que pueden enmascararse diversos procesos; además, en las etapas finales de la enfermedad coinciden complicaciones sistémicas e infecciones, lo que hace difícil definir una causa directa de muerte.
¿Por qué la incidencia de cáncer en la esclerosis sistémica es baja a nivel global?
En la revisión de diversos reportes de la literatura que abordan este tema se encontró la necesidad de algunas premisas como un individuo genéticamente predispuesto según el antígeno mayor de histocompatibilidad (HLA), DQ A1 0404, presencia de la proteína p-53 y otras sustancias oncosupresoras, que como su nombre lo indica suprimen la multiplicación de células cancerígenas.1,3,5,6,7,8,9,10,11
La ruta patogénica que da curso a la enfermedad es otra pieza del entramado, o sea, si es a través del predominio de factores ambientales entre ellos las causas virales, tóxicas, o si predomina la patogenicidad directa en la matriz extracelular con disminución del óxido nítrico e incremento de endotelina 1, citoquinas y moléculas de adhesión, o si las anomalías inmunitarias son preponderantes, a pesar de que existe la confluencia de factores sobre el daño vascular.3,4,5,6,7,8,9,10,11
También influye el tipo de apoptosis que puede ocurrir en la enfermedad y que puede ser de dos formas: la apoptosis excesiva por daños por isquemia-reperfusión o por enfermedad de injerto contra huésped, que está presente en determinados momentos de los eventos patogénicos de la enfermedad, o, por el contrario, la apoptosis disminuida que se manifiesta en las enfermedades autoinmunes como en la ES y las neoplasias.9,10,11,12
Otros factores son la respuesta del huésped susceptible a las diferentes terapéuticas, y la escasa supervivencia de los pacientes con ES, que no da tiempo a que se geste actividad oncogénica suficiente para la aparición de neoplasias.13,14
Conclusiones
La relación entre autoinmunidad y cáncer puede ser el resultado de un origen etiológico común (genético, hormonal, metabólico o factores ambientales) o un mecanismo de síndrome paraneoplásicos (apoptosis disminuida). La enfermedad es terreno de riesgo para la ocurrencia de neoplasias, así como las neoplasias pueden inducir ES. Deben realizarse estudios posteriores para evaluar el valor diagnóstico y pronóstico de los autoanticuerpos que reaccionan contra las oncoproteínas, genes supresores de tumores y antígenos asociados con proliferación.