Introducción
La artritis reumatoide (AR)a es la enfermedad inflamatoria autoinmune más frecuente en adultos.1 Esta entidad tiene impacto negativo y significativo en la capacidad de los individuos para la realización de las actividades diarias, así como en la calidad de vida y se acompaña de una mortalidad incrementada.2,3,4 La causa de la AR se desconoce, no obstante, están implicados factores genéticos y no genéticos en su patogenia. El proceso inflamatorio presente en esta enfermedad está sustentado en la proliferación de células sinoviales, formación de pannus y la infiltración de células inflamatorias. El pannus suele provocar la destrucción del hueso y el cartílago con consecuencias irreversibles como son, entre otras, las deformidades.5
El uso de drogas modificadoras de la AR (DMARD) constituye la primera línea de tratamiento una vez realizado el diagnóstico de AR.6 En los últimos años, se han producido importantes avances en el manejo y tratamiento de esta enfermedad, debido, principalmente a la estrategia “tratar el objetivo”, es decir, aspirar a la remisión clínica, y cuando esto no sea posible, minimizar la actividad de la enfermedad y sus consecuencias.5
Tratar al objetivo o treat to target (T2T, por sus siglas en inglés), es una estrategia terapéutica en virtud de la cual el médico aplica tratamientos enérgicos a sus pacientes en aras de alcanzar y mantener un estado de remisión o de baja actividad de la enfermedad. T2T es una estrategia proactiva, con una meta clara y puede materializarse en forma de un algoritmo terapéutico específico, simplificando así las variadas y complejas secuencias de medicamentos que pueden ser usados en el tratamiento de la AR. Dicha estrategia emerge y está sustentada en varios ensayos clínicos, aleatorizados y controlados, llevados a cabo en la pasada década que sugieren los beneficios de un enfoque terapéutico intenso.7,8,9)
En el transcurso de los últimos 15 a 20 años, varios estudios controlados y aleatorizados han demostrado que la estrategia T2T puede lograr resultados clínicos superiores cuando se compara con las opciones usuales. Los estudios que contienen evidencias que apoyan dicha estrategia pueden ser divididos en: estrategias aleatorizadas que evalúan la eficacia de la terapéutica que va dirigida a un blanco específico frente a tratamientos habituales, y en otro brazo se encuentran todos los tratamientos con un blanco u objetivo definido, pero con diferentes estrategias de tratamientos para lograrlo. Todos estos estudios han incluido, con relativa frecuencia, su valoración con recomendaciones, lo que ha permitido intensificar el tratamiento cuando no se ha logrado el objetivo propuesto en determinado paciente.10,11,12,13,14,15,16,17
La estrategia T2T se ha establecido como un principio que guia el tratamiento de la AR e incluye elementos como la selección del objetivo y el método para su medición, la evaluación de la meta en los periodos predeterminados, el compromiso de cambiar de terapia si el objetivo no es alcanzado y compartir las decisiones en equipo.18
Hoy se acepta ampliamente que la remisión clínica constituye la meta primordial en pacientes con AR, y que una baja actividad de la enfermedad es la mejor alternativa posible. De manera que la estrategia T2T debe ser aplicada a todo paciente atendido con AR.19,20,21,22 No obstante, existe la conciencia de que aún estamos lejos de la curación definitiva.23
En la actualidad, el tocilizumab es el único fármaco antirreumático de tipo biológico (DMARDb) disponible en Cuba para el tratamiento de la AR. En el caso del rituximab (RTX), este forma parte del Cuadro Básico de Medicamentos Cubano y su uso ha estado destinado a pacientes con diagnóstico de linfoma. Hay muy pocos enfermos cubanos con AR refractarios a fármacos antirreumáticos convencionales (DMARDc) tratados con RTX, pues hoy las posibilidades de adquirir este fármaco contra la AR son prácticamente nulas.
En Cuba, esta primera reunión de consenso sobre el uso de terapia convencional y el fármaco biológico tocilizumab (TCZ) en pacientes cubanos con AR se lleva a efecto a propuesta de la Sociedad Cubana de Reumatología (SCUR) y el Grupo Nacional de la especialidad. En el primer encuentro se contó con la presencia del presidente de la Sociedad Cubana y el jefe del Grupo Nacional de la especialidad, representantes del Departamento de Farmacología del Ministerio de Salud Pública de Cuba (MINSAP), y los reumatólogos con experiencia en la atención de pacientes con diagnóstico de AR.
En la primera etapa de este cónclave el 100 % de los participantes acordó que las recomendaciones fruto del análisis y discusión de cada acápite contemplado estarían dirigidas, fundamentalmente, a especialistas en reumatología e, igualmente, a las autoridades de la salud pública cubana.
Estas recomendaciones reflejan los principales aspectos inherentes, no solo a la enfermedad en sí, sino también a los criterios de aplicación de la terapia convencional y biológica, partiendo siempre de la evidencia y contemplando el estado de estos aspectos en el contexto de la realidad nacional.
Las recomendaciones aquí reflejadas, fruto de sucesivas rondas de preguntas, respuestas y análisis de las discrepancias, no son de estricto u obligatorio cumplimiento, más bien constituyen una guía para el enfoque y la atención de estos pacientes.
Las temáticas objetos de análisis fueron las siguientes:
Glucocorticoides en la artritis reumatoide: análisis de la evidencia
Uno de los aspectos más debatidos en reumatología en las últimas décadas ha sido definir la utilidad de los glucocorticoides (GC) en la artritis reumatoide. Desde los años 50 del siglo xx se conoce su gran poder antiinflamatorio, y son ampliamente utilizados como tratamiento sintomático en periodos de exacerbación clínica. No obstante, su empleo se ha visto condicionado y cuestionadopor sus potenciales efectos adversos.24
Los GC constituyen un componente fundamental en el tratamiento de la AR. Numerosos ensayos clínicos controlados de alta calidad metodológica han demostrado su acción como DMARD y un favorable perfil de seguridad en la AR de reciente comienzo. No obstante, más que auténticos agentes modificadores de enfermedad, lo más frecuente es que se usen como terapia puente hasta que el DMARD comience a actuar.25
Varios estudios han apoyado la capacidad de los GC como inhibidores del daño radiológico.26,27,28 Uno de ellos es el estudio COBRA(D), ensayo multicéntrico, aleatorio, a doble ciegas, donde se compara en la AR de 4 meses de duración (como media) una triple terapia compuesta por prednisolona, SSZ y MTX frente a SSZ en monoterapia. En la semana 28, se midió la respuesta ACR 20 (72 % triple terapia; 49 % monoterapia) y ACR 50 (49 % triple terapia; 27 % monoterapia), y se constató mejor respuesta en el grupo de la triple terapia. En cuanto a la destrucción articular, los resultados en ambos tratamientos medidos por el método de Sharp modificado fueron superiores en el grupo de la terapia combinada en las semanas 28, 56 y 80. Se concluyó que la triple terapia permitió un mejor control de la enfermedad, lo cual persistió un año después de la suspensión de la prednisona. El seguimiento a los 47 y 118 años tras finalizar dicho estudio, ha demostrado que continúa existiendo una disminución de la progresión radiológica del grupo de la triple terapia frente al grupo de monoterapia, independientemente del tratamiento recibido con posterioridad. Teniendo en cuenta que no se han encontrado diferencias en los estudios que comparaban la terapia combinada de MTX y SSZ, frente a SSZ en monoterapia, se puede concluir que la adición de los GC es la responsable del menor daño radiológico observado en el grupo de la triple terapia.28
Un ensayo clínico multicéntrico, aleatorizado, a doble ciegas, en pacientes con AR de menos de 1 año de evolución, comparó el uso de prednisona (10 mg) frente a placebo, y se permitió el uso de SSZ de rescate tras los primeros 6 meses en pacientes que no habían utilizado previamente DMARD. En el grupo de prednisona se demostraron beneficios clínicos en los primeros 6 meses, tras lo cual solo persistió superioridad estadísticamente significativa en el número de articulaciones dolorosas y la fuerza de prensión. El beneficio en cuanto al daño estructural sí perduró incluso 2 años después de finalizar el estudio.29,30
El estudio BEST31 se diseñó para evaluar la estrategia óptima de tratamiento para prevenir el daño radiológico y conseguir un mejor estado funcional en AR reciente. Se trata de un estudio multicéntrico y aleatorio, en el que se compararon cuatro estrategias de tratamiento: grupo 1 (monoterapia secuencial con DMARD); grupo 2 (terapia step-up); grupo 3 (esquema similar a la triple terapia del estudio COBRA: prednisona, MTX y SSZ); grupo 4 (infliximab y MTX). El seguimiento de los pacientes fue de un año, y durante las revisiones periódicas se modificaban los tratamientos según un esquema preestablecido para cada grupo. En cuanto al estado funcional, los grupos 3 y 4 (terapia combinada inicial) presentaron una mejoría más rápida medida por el Health Assesment Questionnaire (HAQ). El mantenimiento del Disease Activity Score (DAS) 44 menor o igual a 2.4, que define baja actividad de la enfermedad fue la siguiente: 53 %, 64 %, 71 % y 74 %, para los grupos 1, 2, 3 y 4, respectivamente. El estudio concluyó que el tratamiento combinado inicial proporcionó una mejoría funcional más temprana junto con una disminución de la progresión radiológica.31
Un estudio longitudinal observacional que incluyó a más de 12 000 pacientes, evaluó las características asociadas al uso de GC, prevalencia, factores pronósticos y variables de desenlace. Se estima que más del 65 % de los pacientes reciben GC a lo largo de la evolución, y que en el 33 % se emplean de forma habitual (el 35 % de estos durante más de 5 años).32
Hoy día la combinación de DMARDb con MTX no ha mostrado superioridad comparada con MTX y GC en pacientes con AR recién diagnosticada.33,34
Las recomendaciones del 2019 de la Liga Europea contra las Enfermedades Reumáticas (EULAR, por sus siglas en inglés) incluyen que los GC a corto plazo deben contemplarse cuando se inicia o se cambia a un DMARDc en diferentes dosis, regímenes y vías de administración, pero la dosis de estos debe ser reducida tan rápido exista respuesta favorable al DMARDc. Esto último debe efectuarse en un plazo de 3 meses. Una respuesta similar se reportó entre la combinación MTX más GC y el tratamiento con DMARDb o DMARD inhibidores selectivos de la molécula de janus quinasa intracelular (DMARDjk).35,36,37
Terapia modificadora convencional de la artritis reumatoide, análisis de la evidencia
Metotrexato
La eficacia del MTX como droga modificadora de la AR se puso de manifiesto a partir de la década de los 80.38,39,40,41,42 Posterior a los estudios controlados con placebos, tuvo lugar la publicación de ensayos clínicos abiertos, comparativos, a ciegas y a largo plazo. Estas investigaciones prospectivas mostraron el papel del MTX en enfermedades crónicas como la AR.42,43,44 En el transcurso del tiempo, el interés por esta droga fue aumentando, y además de su eficacia clínica, aparecen observaciones de aspectos interesantes tales como su capacidad para permitir reducir o retirar el tratamiento con GC con escasos efectos adversos graves45,46,47 y la posibilidad de mantener el tratamiento por 5 y 6 años.48,49
Estudios posteriores, en los que se comparó el MTX con otros DMARD azatioprina (AZA) y sales de oro intramuscular), mostraron que el MTX fue superior en lograr mejoría de la actividad clínica de la AR y en el retardo de la progresión radiológica. En el caso de las sales de oro intramusculares, el MTX mostró, además, mejor tolerancia.50,51,52
A partir de los estudios comparativos, controlados, con placebos, del MTX con otros DMARD y la experiencia adquirida en el seguimiento prospectivo a largo plazo, el primero se convierte en el estándar del tratamiento de la AR a inicios de la década del 90. El MTX fue clínicamente eficaz, redujo el índice de progresión radiológica, mejoró el estado funcional y mostró un perfil razonable de buena tolerancia en los pacientes.53
También se han publicado varios estudios relacionados con la terapia combinada del MTX con otros DMARD.54,55,56,57) La combinación de MTX con AZA, CPA, HCQ y SSZ mostró mejores resultados que el MTX en monoterapia54,55,57) Resultados diferentes a lo anterior se observaron con dosis muy bajas o subterapéuticas de MTX.56,57
Aunque el 30 % de los pacientes alcanzó la remisión con MTX como monoterapia, el 70 % requiere la combinación de dicha droga con DMARDc o DMARDb.58 Varios estudios han sugerido que iniciar tratamiento con terapia convencional combinada (MTX, antimaláricos y SSZ) o la combinación de MTX con inhibidores del factor de necrosis tumoral (anti-TNF), es superior a la monoterapia con MTX.59,60,61,62,63,64,65,66
El MTX puede ser administrado por las vías oral, subcutánea o intramuscular. La absorción del MTX oral es variable y de acuerdo con el rango de dosis utilizada en el tratamiento de la AR. Los alimentos no afectan la absorción del MTX en grado significativo.
De acuerdo con las recomendaciones del 2019 de la EULAR para el tratamiento de la AR con DMARD sintéticos y biológicos, el MTX es la droga de elección, no solo por su eficacia como modificadora de la AR en sí, sino también por constituir la base de las terapias combinadas, ya sea con GC o con otros DMARDc, DMARDb o DMARDjk. Igualmente se reiteró la importancia de que el MTX (oral o subcutáneo) sea administrado semanalmente, en dosis escalonadas, cada 4 a 6 semanas.35) Se ha insistido en la importancia de la administración del ácido fólico como aspecto central en la terapéutica con MTX.35
Antimaláricos
Los antimaláricos se han utilizado en el tratamiento de la AR por cerca de 65 años. Esta terapia reduce el número de articulaciones dolorosas e inflamadas y la actividad de la AR de acuerdo con la evaluación, tanto del médico como por parte del paciente.67 Al ser comparados con otros DMARD, la cloroquina (CQ) e HCQ tienen un menor efecto, demoran más tiempo en lograr mejoría clínica y no inhiben la progresión radiológica.67 Se ha sugerido que los AM, especialmente la HCQ, deben reservarse como monoterapia fundamentalmente para pacientes con formas leves-moderadas de la enfermedad. Igualmente, constituyen terapias de combinación.67,68
El uso de HCQ como monoterapia tiene eficacia moderada para el tratamiento de la AR. Por lo general se emplea en triple terapia en combinación con otros DMARDs, MTX, SSZ e HCQ.69 En este sentido, se ha demostrado que esa combinación está indicada en pacientes con AR que tienen factores de mal pronóstico, de curso moderado o agresivo e independientemente del tiempo de duración.70).
En general, los AM son buenos en cuanto a seguridad y tolerancia para los pacientes, y aún en la era de las drogas inmunosupresoras y biológicos, la CQ e HCQ ocupan un lugar importante en la práctica clínica de los reumatólogos.70
Salazosulfapiridina
Investigaciones publicadas no han podido demostrar que factores como la edad y el género sean predictivos de respuesta satisfactoria a la SSZ.71,72,73,74,75
Para los pacientes con diagnóstico de AR con inadecuada respuesta a las DMARDc, tales como el MTX y la SSZ, una de las opciones terapéuticas recomendadas es su combinación con DMARDb, como es el caso de los inhibidores del anti-TNF.76,77
Un estudio publicado cuyo objetivo fue comparar la eficacia y seguridad del etanercept y etanercept más SSZ contra SSZ sola, en pacientes con AR activa, mostró que la combinación de un anti-TNF, como el etanercept, con SSZ es eficaz y no se asocia con mayor toxicidad que ambos medicamentos por separado.78,79
Leflunomida
Los DMARD se han administrado ampliamente para el tratamiento de la AR por más de 20 años,80,81) y esto se debe a su capacidad para mejorar los síntomas y signos de la AR activa y, en algunos casos, retardar la progresión radiológica hacia la destrucción articular. La leflunomida (LFD) es un derivado del isoxazol y uno de los DMARDc para tratar a pacientes con AR. La LFD es convertida, a nivel del hígado y del intestino, en un metabolito activo, A77 1726, el cual inhibe a la dihidroorotato deshidrogenasa, enzima que interviene en la vía de la síntesis de la pirimidina.82,83
La eficacia de la LFD en la AR ha sido demostrada en varios ensayos clínicos. Fue aplicada con buenos resultados a pacientes con AR activa, en el marco de un ensayo fase II, aleatorizado, controlado con placebo (Ao). Tres ensayos clínicos de 6 a 12 meses de duración, fase III, a doble ciegas y aleatorizados,84,85,86,87) establecieron, igualmente, la eficacia clínica de dicho medicamento. La LFD fue comparada con el MTX (Pp) y la SSZ84 en dos ensayos controlados con placebo. Estos estudios incluyeron a pacientes que habían recibido previamente DMARDc, así como casos que nunca habían tenido tratamiento con drogas modificadoras de la AR. Los pacientes recibieron placebo o LFD a diferentes dosis: 5 mg, 10 mg o 25 mg diarios. Una sola dosis de carga fue suministrada (50 mg) para el grupo de 5 mg diarios y 100 mg para los grupos de 10 y 25 mg diarios. Se observó evidente dosis/respuesta en los casos con 25 mg diarios comparado con las dosis de 5 y 10 mg/día.88)
Un estudio comparativo de la eficacia clínica y seguridad de la LFD y MTX, con evaluación de los casos durante 2 años mostró, en el primer año de seguimiento, que tanto el tratamiento de la AR con MTX como con LFD fue eficaz. Este resultado se mantuvo en los diferentes puntos de corte de evaluación de la eficacia.89 A 2 años de seguimiento, hubo disminución de la progresión radiológica en los enfermos tratados con LFD.89 En general, se ha visto que tanto la LFD como el MTX enlentecen el daño radiológico articular comparado con los casos controles tratados con placebo, pero la LFD ha sido significantemente más eficaz que el MTX en enlentecer la progresión radiológica de la AR en un año de tratamiento.86
Una evaluación inicial de la American College of Rheumatology 20 (ACR 20) de respuesta al tratamiento con LFD en la AR fue constatada cerca de las 8 semanas, y la respuesta máxima se observó a las 12 semanas.86 La mejoría en la evaluación de los parámetros clínicos (conteo de articulaciones dolorosas e inflamadas, evaluación global por el médico y por el paciente) ocurrió más tempranamente con la LFD comparado con la SSZ. La calidad de vida evaluada por el Health Assessment Questionnaire Disability Index (HAQ DI) fue significativamente mejor con la LFD al comparase con placebo e incluso con el MTX.87
En el 2008 se realizó una revisión de 33 estudios publicados sobre terapéutica en la AR con la LFD,90 y se concluyó que mejora los parámetros clínicos y retrasa la progresión radiológica a los 6 y 12 meses comparado con placebo.
Más recientemente se observó que en pacientes con AR con diagnóstico de osteoporosis, la LFD fue el único DMARDc asociado a incremento significativo de la densidad mineral ósea.91
Tocilizumab
La interleucina 6 (IL-6) tiene un papel primordial en la patogenia de la AR, tiene protagonismo en el desarrollo de síntomas sistémicos, inflamación articular y resorción ósea, y es el daño articular el resultado final.92,93,94,95 Las acciones y los efectos de la IL-6 tienen lugar a través de señalizaciones que incluyen a los receptores de unión de la membrana soluble,92 y sus niveles elevados coinciden con la activación de la enfermedad en los pacientes con AR.94,95
El TCZ es un anticuerpo monoclonal, humanizado, recombinante que bloquea la unión de esta citocina a la membrana de su receptor α soluble.96,97,98 Su eficacia ha sido demostrada en investigaciones fase III y se ha reflejado en el alivio de los síntomas subjetivos e inflamatorios, la inhibición del daño estructural y la mejoría de la función física.99,100
Un estudio sobre la eficacia y seguridad del TCZ en pacientes con AR activa a 5 años de su empleo y respuesta inadecuada al MTX101 mostró inhibición de la progresión radiológica, mejoría mantenida de los síntomas y signos y de la función física.
Varios ensayos fase III han reflejado que la administración intravenosa del TCZ es igualmente segura y eficaz en monoterapia y en combinación con otros DMARD en pacientes adultos con AR.102 Hoy día, la administración puede realizarse con infusión intravenosa o con la inyección subcutánea. La comparación del TCZ subcutáneo, a 162 mg, con TCZ intravenoso, a 8 mg/kg, cada 4 semanas en pacientes adultos con AR que no habían tenido respuesta adecuada a uno o más DMARD, demostró eficacia y perfil de seguridad comparable.103
Más recientemente, se ha observado la remisión sustancial de la enfermedad al iniciarse el tratamiento con TCZ con MTX o no, en pacientes con AR de reciente comienzo que no han sido tratados nunca con DMARD. Esta estrategia tan contemporánea incluyó la reducción gradual de la dosis de TCZ en la medida que se vaya obteniendo remisión sustancial.104,105
Métodos
Se convocó a reumatólogos de todo el país (18 especialistas correspondientes a ocho provincias) expertos en el tratamiento de la AR. La mayoría ya había integrado el Comité Farmacológico de sus respectivos centros atendiendo lo referente a los DMARDc y biológicos, y otros ya habían participado en reuniones de consenso y casi todos estaban dedicados a la investigación en esta área. Diez expertos se ocuparon de la recopilación de información, revisión y confección de cuestionarios relacionados con la terapia convencional y GC en la AR, mientras ocho expertos tuvieron a cargo la recopilación de información, revisión y confección de cuestionarios relacionados con la terapia biológica.
Se efectuó una primera reunión en marzo del 2016, en el hospital provincial de Villa Clara, Cuba, con la participación de todos los expertos. En ese momento se desarrollaron las tareas siguientes: se mostró la bibliografía seleccionada sobre terapia convencional y biológica recopilada previamente por los reumatólogos participantes, se estructuraron dos equipos, uno de ellos abordaría todo lo referente a la terapia convencional en la AR (TCAR) y el uso de GC, mientras que el otro se enfocaría en la terapia biológica en la AR (TBAR). Además, en este primer encuentro se propusieron y fueron acordados los aspectos siguientes: el consenso debía ser dirigido a los reumatólogos. La totalidad de los miembros acordaron incluir en el análisis, no solo la terapia con agentes biológicos, sino también actualizar la terapia convencional existente o disponible en el país. El biológico incluido fue el TCZ por ser el único existente y disponible en Cuba para los pacientes con AR.
Se confeccionaron tres cuestionarios relacionados con el uso de corticoesteroides, TCAR y TBAR. Ambos grupos confeccionaron preguntas que fueron enviadas a los miembros del consenso mediante el correo electrónico, las que debían ser respondidas por todos los integrantes del panel de expertos.
En una segunda reunión, efectuada en octubre del 2016, en la Ciudad de La Habana, se llevó a cabo el análisis de cada una de las respuestas aportadas por los expertos. Las preguntas cuya respuesta contó con el 90 % o más de votos a favor se consideraron como recomendación.
Para su análisis, fueron identificados nueve tópicos que respondieron a las interrogantes siguientes:
¿En qué momento de la evolución de la AR debe ser iniciado el tratamiento con DMARD?
Teniendo en cuenta la evidencia científica, y de acuerdo con la disponibilidad de medicamentos existente en nuestro país, ¿cuál será nuestra posición respecto a la leflunomida, sulfazalacina, cloroquina/hidroxicloroquina, como alternativas terapéuticas en la AR?
¿Cuál sería la indicación, dosis y tiempo de administración de los GC en la AR?
¿Cuándo indicar las pruebas de serología para el virus B, C o virus de inmunodeficiencia adquirida (VIH) en pacientes con diagnóstico de AR?
¿En qué debe consistir la evaluación de un paciente con diagnóstico de AR previa a la terapia con DMARDc y DMARDb?
¿Qué conducta adoptar una vez obtenida la remisión definida como la ausencia de inflamación articular y extraarticular y de actividad de la enfermedad o un estado de baja actividad de la AR (estado en el cual los síntomas están bajo control ayudando al paciente a tener una buena calidad de vida)?
¿Cuándo indicar TCZ en pacientes con AR?
¿Qué factores inciden en la evolución de la AR en nuestro medio?
¿Quién debe indicar biológicos?
Resultados del Consenso
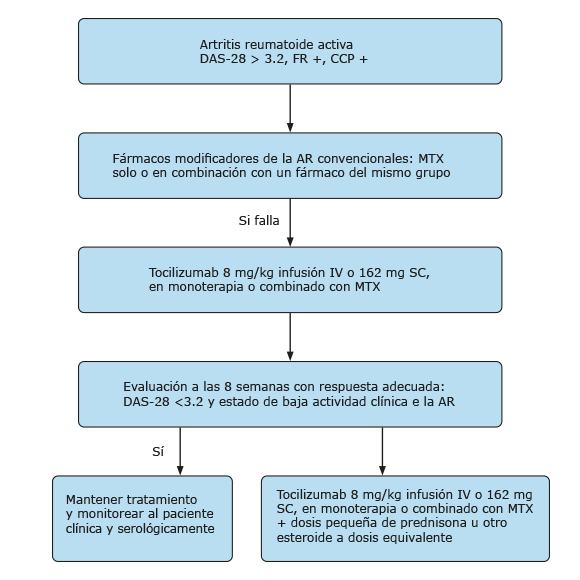
El presente documento consta de 9 recomendaciones (Tabla 1). El nivel de evidencia (NE), grado de recomendación (GR), grado de acuerdo (GA) (porcentaje de panelistas que se mostraron a favor de cada recomendación) y las opiniones de los expertos (OE) fueron conceptos contemplados (Tabla 2). Las recomendaciones presentadas dieron lugar a la elaboración de 1 algoritmo terapéutico (Fig.).
¿En qué momento de la evolución de la artritis reumatoide debe ser iniciado el tratamiento con DMARD?
El 96 % de los expertos consideró que los DMARDc constituyen la primera línea de tratamiento una vez realizado el diagnóstico de la AR, los que deben ser iniciados de forma inmediata. Asimismo, la totalidad de los presentes (100 %) consideró al MTX como la droga de elección en pacientes que han sido diagnosticados de AR.
Teniendo en cuenta la evidencia científica, y de acuerdo con la disponibilidad de medicamentos existente en el país, ¿cuál será nuestra posición respecto a la leflunomida, sulfazosulfasalazina, cloroquina/hidroxicloroquinacomo alternativas terapéuticas en la artritis reumatoide?
Se consideró que en los enfermos con diagnóstico de AR activa en los que el MTX estuviera contraindicado o existiera falla en la respuesta a este, la alternativa sería otro DMARDc. En estos casos, el uso de antimaláricos, SSZ o LFD fueron las opciones que prevalecieron (92 %). Las drogas mencionadas no se aconsejarán en la terapéutica de los enfermos con AR, como terapia de primera línea, a menos que el MTX estuviera contraindicado e, igualmente, como parte del tratamiento combinado.
Tabla 1 Recomendaciones finales del Consenso cubano sobre artritis reumatoide
| No. | Recomendaciones |
|---|---|
| 1 | Los DMARDc constituyen la primera línea de tratamiento una vez realizado el diagnóstico de AR, y el MTX es la droga de elección. |
| 2 | Mantener en el arsenal terapéutico y modificador de la AR a la AZA, pero no la CPA ni a la CF. |
| 3 | Utilizar bajas dosis de prednisona o equivalente (10 mg/día) asociados a DMARDc en pacientes con AR activa de moderada a grave. Se debe valorar su uso por el menor tiempo posible (3 a 6 meses de tratamiento). |
| 4 | Realizar pruebas de serología para virus de hepatitis B, C y pesquisaje para VIH en todos los pacientes con diagnóstico de AR antes de iniciar tratamiento con DMARDc y DMARDb. Asimismo, en los pacientes con AR infectados con el virus de la hepatitis B, C, o VIH, las opciones de tratamiento modificador conservador deben ser SSZ o antimaláricos, siempre y cuando hayan tenido tratamiento previo antiviral y un monitoreo hematológico estricto en estos casos. |
| 5 | Los pacientes en remisión o, al menos, con un DAS-28 por debajo de 3.2, se debe considerar retirar uno de los DMARD o la reducción, a la mínima expresión posible, de la dosis de ambos modificadores de la enfermedad, según el caso. |
| 6 | La evaluación clínica y serológica minuciosa del paciente con AR antes de iniciar terapia con DMARDc y biológicos es fundamental. |
| 7 | Existen factores particulares en Cuba que inciden en el pronóstico no satisfactorio de los enfermos. |
| 8 | El uso del TCZ combinado con MTX o en monoterapia se acepta una vez que haya existido falla al MTX, solo o en combinación. |
| 9 | En Cuba, los biológicos deben ser indicados por el reumatólogo. La administración del TCZ debe ser por la vía y dosis establecidas. |
Teniendo en cuenta la evidencia científica, y de acuerdo con la disponibilidad de medicamentos existentes en el país, ¿cuál será nuestra posición respecto al uso de azatioprina, ciclofosfamida y ciclosporina A como alternativas terapéuticas en la artritis reumatoide?
La idea general es ampliar las posibilidades terapéuticas, especialmente ante las irregularidades de disponibilidad de los DMARDc antes expuestos que en ocasiones existen. Igualmente, se tomó como consenso la no utilización de la ciclofosfamida (CF), excepto en los casos de manifestaciones extraarticulares graves (neumonitis intersticial, vasculitis reumatoidea) (100 %).
En las recomendaciones de la EULAR del 2013 para el tratemiento de la AR con drogas convencionales y biológicas, fueron eliminados tres acápites que habían sido adoptados previamente en las recomendaciones del 2010. Uno de ellos fue descartar el uso potencial de AZA, CPA e incluso CF del arsenal terapéutico de estos pacientes.106
El grupo de expertos cubanos (100 %) consideró mantener en el arsenal terapéutico y modificador de la AR a la AZA. Fue consensado mantener, específicamente, la AZA cuando el paciente con AR no pueda utilizar los DMARDc, MTX, SSZ, antimaláricos y LFD, ya sea por falla previa o intolerancia (100 %).
¿Cuál sería la indicación, dosis y tiempo de administración de los glucocorticoides en la artritis reumatoide?
El grupo de expertos cubano (100 %) consideró contemplar la administración de bajas dosis de prednisona o equivalente (< 7,5 mg/día) asociados a DMARDc en pacientes con AR activa de moderada a grave. Se debe valorar su uso por el menor tiempo posible (3 a 6 meses de tratamiento).
¿Cuándo indicar las pruebas de serología para virus B, C o virus de inmunodeficiencia adquirida (VIH) en pacientes con diagnóstico de artritis reumatoide?
Recomendación 4. Se llegó al consenso (100 %) de realizar prueba de serología para virus de hepatitis B, C y pesquisaje para VIH a todos los pacientes con diagnóstico de AR antes de iniciar el tratamiento con DMARDc y DMARDb. Asimismo, hubo 100 % de acuerdo en que en los pacientes con AR infectados con el virus de la hepatitis B, C, o VIH, las opciones de tratamiento modificador conservador deben ser SSZ o antimaláricos, siempre y cuando hayan tenido tratamiento previo antiviral y un monitoreo hematológico estricto en estos casos.
Tabla 2 Recomendaciones con sus correspondientes niveles de evidencia, grado de recomendación, opinión de expertos presentes y grado de acuerdo. (Basado en las recomendaciones de Oxford Centre para la medicina basada en la evidencia)84).
| No. de la recomendación | NE | GR | OE | GA (%) |
|---|---|---|---|---|
| 1 | 1a | A | 100 | |
| 2 | 1a | A | 96 | |
| 3 | 2 | C | X | 100 |
| 4 | 1a | A | 100 | |
| 5 | 2 | C | 100 | |
| 6 | 1a | A | 96 | |
| 7 | 2b | B | 100 | |
| 8 | 1a | A | 100 | |
| 9 | 1a | A | 100 | |
| 10 | 3b | C | 100 | |
| 11 | 1a | A | 100 | |
| 12 | 1a | A | 100 | |
| 13 | 1a | A | 100 | |
| 14 | - | - | X | 100 |
Leyenda: NE: Nivel de evidencia, GR: Grado de recomendación, OE: Opinión de expertos del consenso, GA: Grado de acuerdo (en porciento).
¿En qué debe consistir la evaluación de un paciente con diagnóstico de artritis reumatoide previa a la terapia con DMARDc y DMARDb?
Recomendación 6. Se acordó que el seguimiento serológico del paciente con AR debe ser antes del inicio y durante la terapia con DMARDc y biológicos (100 % de votos).
¿Qué conducta adoptar una vez obtenida la remisión o un estado de baja actividad de la artritis reumatoide?
Recomendación 5. En los pacientes en quienes se obtuviera la remisión o, al menos, un DAS-28 por debajo de 3.2, se debe considerar retirar uno de los DMARD o la reducción, a la mínima expresión posible, de la dosis de ambos modificadores de la enfermedad, según el caso evaluado (100 % de expertos).
El panel de expertos decidió que a los pacientes que en un momento determinado de la evolución de la AR alcanzaran la remisión o, al menos, un DAS-28 por debajo de 3.2, se considere retirar uno de los DMARD, o la reducción, a la mínima expresión posible, de la dosis de ambos modificadores de la enfermedad, a consideración del especialista.
La idea de pasar de la terapia combinada con DMARDc a monoterapia (con una de estas drogas convencionales) una vez que la respuesta terapéutica haya sido lograda, no fue aceptada por la mayor parte de los expertos (72 %). Ese resultado estuvo sustentado en las consideraciones siguientes: si un paciente estuvo con terapia combinada previa fue debido a la gravedad de la enfermedad, luego la evaluación de los aspectos que realmente mejoraron con la esta se considera fundamental para la decisión de dejar al enfermo con una sola droga tradicional. Se trata de individualizar la decisión.
¿Qué factores inciden en la evolución de la artritis reumatoide en nuestro medio?
Recomendación 7. Realizar conferencias educativas a través de los medios de comunicación masiva y la instrumentación de la maestría y diplomados en reumatología dirigidos a especialistas de otras esferas, particularmente especialistas de medicina general integral.
¿Cuándo indicar tocilizumab en pacientes con artritis reumatoide?
Recomendación 8. El grupo del consenso acordó (100 %) el uso del TCZ combinado con MTX o en monoterapia una vez que haya existido falla al tratamiento con MTX solo o en combinación. Su empleo como terapia de primera línea debe ser individualizado, y se destinará a los pacientes con AR activa en los que el MTX estuviera contraindicado, pacientes que no respondan al MTX después de usar varias dosis escalonadas y en caso de no mejoría con MTX combinado con otros DMARDc (Fig.).
¿Quién y en cuál entorno hospitalario debe ser indicada la terapia biológica con tocilizumab en Cuba?
Recomendación 9. Se acordó que el TCZ debe ser indicado por el especialista en Reumatología (100 %) y que esta terapéutica se debe administrar en sala de hospitalización con experiencia en infusión intravenosa y cuidados de urgencias adecuados (100 %).
El grupo de expertos acordó utilizar las dos vías de administración existentes del TCZ, en dependencia de la disponibilidad en el país. En el caso de la vía intravenosa se acordó la dosis de 8 mg/kg, en infusión, una vez cada 4 semanas (100 %). En los casos de pacientes con peso corporal superior a los 100 kg, la dosis no debe exceder los 800 mg por infusión. La dosis de TCZ subcutánea recomendada es de 162 mg, una vez por semana.
Discusión
Los DMARDc constituyen la primera línea de tratamiento en la AR los que deben ser iniciados de forma inmediata una vez realizado el diagnóstico. El MTX es el medicamento de elección para iniciar la terapia por su eficacia tanto por sí mismo como en terapias combinadas con otros DMARDs, con GC y DMARDb.102,107,108,109,110 Su administración oral o subcutánea debe ser de forma escalonada, semanalmente comenzando por 0,3 mg/kg. El aumento lento de la dosis debe llevarse a cabo cada 4 a 6 semanas.110,111 A modo de comentario, se ha sugerido que su uso a dosis altas (20-30 mg) es más eficaz que dosis más bajas (7,5-15 mg).24,25).La evidencia ha mostrado su beneficio en cuanto a la mejoría de los síntomas y signos de la enfermedad (NE: 1A). Infelizmente, estudios publicados han señalado que la mitad de los pacientes no son derivados al reumatólogo dentro de los 6 meses de iniciada la enfermedad y, por tanto, no reciben el tratamiento adecuado.113,114,115,116)
Los antimaláricos han mostrado alguna eficacia como monoterapia en relación con los síntomas y signos117 y suelen utilizarse con mayor frecuencia en terapias combinadas.118,119,120,121)
Mientras que los GC han demostrado tener propiedades antiinflamatorias y modificadoras de la enfermedad.122,123,124) Existen evidencias de que la adición de GC a los DMARDc en monoterapia es beneficiosa, especialmente a bajas dosis.125,126,127
Se consideró importante tener presente el pesquisaje de las diferentes serologías antes de iniciar el tratamiento modificador de la AR. La ocurrencia de hepatitis C, coincidiendo con AR en un mismo paciente, detectada en el quehacer diario ha llamado la atención de algunos especialistas en reumatología cubanos. La realización de la serología para virus de hepatitis C en los pacientes con AR, antes y durante la terapéutica con MTX ha propiciado la detección más certera de esa entidad. Lo anterior ha permitido detectar pacientes con AR y virus de hepatitis C, B o VIH.121
Antes de comenzar con DMARDc y DMARDb, es fundamental la redacción de una historia clínica con calidad, entiéndase, un interrogatorio minucioso y examen clínico completos en todos los pacientes con AR. Es igualmente importante conocer los antecedentes patológicos personales relacionados con comorbilidades e infecciones recurrentes. Debe ser incluido un hemograma completo, reactantes de fase aguda, velocidad de sedimentación globular (VSG) y proteína C reactiva (PCR), hemoquímica (glicemia, enzimas de función hepática, creatinina, ácido úrico, urea, estudio del perfil lipídico) y examen de orina.
El tratamiento con TCZ puede alterar el perfil lipídico sérico, incremento de la lipoproteína de baja densidad (LDL, por sus siglas en inglés) y de los niveles del colesterol total (Categoría B),128,129 por lo que se deben monitorizar estos parámetros y corregirlos con la dieta y tratamiento oral (estatinas). La administración con TCZ se ha asociado con la perforación intestinal y la peritonitis, por lo cual los pacientes con antecedentes de diverticulitis o ulceración intestinal deben ser controlados estrechamente (Categoría B).120 Debe tenerse en cuenta el conteo de neutrófilos para el uso del TCZ (Categoría A).120,130,131,132
Se ha reportado el riesgo de contraer infecciones graves por el uso de biológicos (Categoría A).119,133 El pesquisaje de la tuberculosis debe realizarse en los casos con antecedente de tuberculosis o convivencia con personas que tuvieron la infección. Los pacientes con tos productiva de más de 21 días de duración deben ser remitidos a su área de salud para descartar la existencia de esta infección. Se estimó la indicación de radiografía de tórax antes de iniciar la terapia con DMARDb, lo que permitiría detectar alguna reactivación de tuberculosis latente o neoformación asintomática.
El pesquisaje de los anticuerpos antipéptidos cíclicos citrulinados (anti-CCP) puede contribuir a confirmar el diagnóstico de AR en los casos que no tengan criterios diagnósticos suficientes o en los casos atípicos. Nos estamos refiriendo específicamente a la AR temprana.134) Los anti-CCP son más específicos que el factor reumatoide para el diagnóstico de AR, e incluso mejor predictor de progresión de las erosiones articulares.135
El índice DAS-28 es un instrumento útil en la práctica clínica para la evaluación objetiva tanto de la progresión de la enfermedad como de la respuesta a la terapéutica.136 Está compuesto por 4 variables: número de articulaciones dolorosas hasta 28, número de articulaciones inflamadas hasta 28, VSG y evaluación, según el paciente, de su estado general de salud. La PCR puede ser utilizada, indistintamente, en lugar de la VSG en el DAS-28.137
La evidencia ha mostrado que, tanto para obtener la remisión como para lograr un estado de baja actividad, debe evaluarse al paciente y realizar adecuaciones en el tratamiento cada 1 a 3 meses. Esto se ha asociado con mejores resultados desde el punto de vista clínico, radiográfico y funcional.138,139,140) De manera que en los casos donde se obtuviera la remisión o, al menos, un DAS-28 por debajo de 3.2, se puede considerar retirar uno de los medicamentos modificadores de la enfermedad o la reducción, a la mínima expresión posible, de la dosis de ambos modificadores de la enfermedad.98,107
La eficacia del TCZ en monoterapia ha sido probada en pacientes con AR activa tanto clínica como radiológicamente102,141,142 y, asimismo, su eficacia en la AR se ha comprobado cuando ha fallado la terapia con DMARDc.143 En este sentido, existen evidencias de que en caso de intolerancia al MTX o en el caso de que su uso mantenido no sea apropiado, el TCZ ha sido superior al MTX y a otros DMARDc.142,144,145,146 Además, el TCZ suele ser eficaz en la AR refractaria a los anti-TNF.97 La Liga Europea contra el Reumatismo recomendó el uso de todos los biológicos en combinación con MTX;106 sin embargo, los datos registrados muestran que aproximadamente la tercera parte de los pacientes están siendo tratados con biológicos como monoterapia.147,148,149,150
Se han confirmado mejores resultados con el TCZ comparado con adalimumab.151 Investigaciones realizadas han demostrado una disminución de la actividad de la enfermedad y mejor remisión con este fármaco.102,132 Se ha estudiado la combinación de TCZ con MTX en AR y se ha comprobado que existe retardo en la progresión radiográfica del daño estructural articular de forma significativa cuando se compara con el MTX solo en pacientes que no responden a este último.152,153 La administración de TCZ por vía intravenosa para el tratamiento de la AR ha sido aprobada en múltiples países. La aplicación de la formulación subcutánea de este producto no requiere de un centro hospitalario, es decir, después de los primeros 6 tratamientos en la clínica u hospital, la aplicación subcutánea puede realizarse en la casa por el propio paciente o por un trabajador de enfermería o por su cuidador.154,155 Cuando existen resultados eficaces con ambas vías de aplicación de un medicamento, los pacientes suelen preferir la opción subcutánea frente a la intravenosa.156
En la literatura, se han reflejado los factores de riesgo asociados a mal pronóstico de la AR.157,158,159,160 A partir de la experiencia y vivencias en la atención y el manejo de pacientes con AR, la mayor parte de los expertos consideró que existen factores particulares en Cuba que inciden en el pronóstico no satisfactorio de los enfermos, entre los que se destacan: derivación tardía al especialista (no es infrecuente recibir al paciente ya tratado varios meses o años atrás por médicos no reumatólogos con antiinflamatorios no esteroideos (AINE) o GC sin ningún DMARDc); la no disponibilidad de los DMARDc, especialmente el MTX en muchas zonas del país, lo que imposibilita el acceso, sobre todo de los enfermos que viven distantes a los servicios de salud que dispensan dicha droga. En el orden diagnóstico y terapéutico, el abordaje temprano de los casos con AR favorece ostensiblemente el pronóstico clínico y radiológico.161,162,163,164,165 No se debe pasar por alto los casos de inicio temprano y los de inicio muy temprano (menos de 3 meses o 6 semanas, respectivamente) a partir del comienzo de los síntomas, en los que el inicio del tratamiento de forma inmediata tiene un gran impacto en el pronóstico de estos enfermos.166 Otro factor de riego en nuestro medio es la no inclusión y la falta de divulgación de los aspectos más relevantes del sistema osteomioarticular y de las conectivopatías en la enseñanza pregrado y en la maestría de la especialidad de reumatología. La intervención educativa a los pacientes con esta enfermedad ha probado ser útil y beneficiosa para estos enfermos.167
Conclusiones
El presente documento refleja las recomendaciones derivadas del análisis de la evidencia y de la realidad cubana en relación con la terapia convencional y biológica en pacientes con AR. Se expusieron aspectos vitales como la importancia del diagnóstico precoz y tratamiento inmediato con DMARDc y DMARDb, la valoración y seguimiento mantenido a estos pacientes, la inmediatez en la instauración del tratamiento biológico y aspectos relacionados con su indicaciones y modo de uso, así como lo referente al uso de los GC. Se consensó modos de actuación para la modificación de los factores de riesgo modificables y particulares en Cuba que inciden en el pronóstico no satisfactorio de los pacientes y la convicción de que los biológicos en la AR debe ser indicado solamente por el especialista en reumatología.