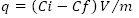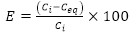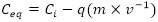INTRODUCCIÓN
La introducción y redistribución de los metales pesados en la biosfera tiene su origen a partir de fuentes naturales y antropogénicas y, entre estas últimas, las operaciones industriales constituyen el principal emisor. La toxicidad y persistencia de los contaminantes metálicos en el ambiente determinan la urgencia de su eliminación (Álvarez et al. 2017; Bhutada y Dahikar 2017).
Como alternativa para contribuir al saneamiento de los ecosistemas, especial atención se ha dedicado a las biomasas bacterianas en monocultivos o en sistemas mixtos, por sus capacidades para remover contaminantes metálicos y por el carácter renovable que presentan estos biosorbentes naturales (Ridha 2015; Hu et al. 2017). Por sus múltiples ventajas se destaca el proceso de biosorción mediante el empleo de células microbianas inactivadas o muertas (Khan et al. 2016; Mahmoud et al. 2017).
La inactivación celular por calor seco proporciona estabilidad operacional al biosorbente, elimina impurezas y expone sitios de unión a metales en la superficie de las células (Zeraatkar et al. 2016). Además, condiciona el proceso de biosorción como mecanismo de captura de los metales, lo que da la posibilidad de regenerar y reutilizar la biomasa y recuperar el metal, sin requerir la adición de nutrientes (Mahmoud et al. 2017). Lo anterior sustenta las aplicaciones prometedoras de las bacterias en estado inactivado en relación con las células vivas, aspecto que se ha informado en trabajos previos (Choińska-Pulit, Sobolczyk-Bednareka y Łaba 2018; Qiao et al. 2019).
Entre los principales atractivos de la biosorción por células inactivadas está la modificación de la composición química celular para favorecer el enlace de los iones metálicos (Khan et al. 2016). Esto se fundamenta por las interacciones que se establecen entre los grupos funcionales disponibles que caracterizan a las diferentes biomasas microbianas inactivadas y las especies metálicas (Barange et al. 2014).
Una estrategia para modificar células inactivadas consiste en aplicar tratamientos químicos a las biomasas, los cuales ejercen efectos diferentes sobre la captura de los iones y son, en muchos casos, dependientes de la especie metálica y del microorganismo (Mane et al. 2010; Khan et al. 2016).
Otro aspecto a considerar está relacionado con la composición metálica heterogénea de las aguas residuales industriales, por lo que la búsqueda y selección de biomasas microbianas funcionales en mezclas de metales constituye una alternativa promisoria para ser aplicada en los sistemas de tratamiento de aguas residuales (Álvarez et al. 2017; Bhutada y Dahikar 2017). Teniendo en cuenta estos antecedentes el presente trabajo se propuso como objetivo determinar la efectividad de biomasas bacterianas, inactivadas y pretratadas, en la biosorción de cinc y cadmio en soluciones monometálicas y bimetálicas.
MATERIAL Y MÉTODO
Material biológico y obtención de la biomasa
Microorganismos empleados: Bacillus cereus (AL-30), Acinetobacter sp. (AL-134) y Micrococcus sp. (AL-138), pertenecientes a la Colección de Cultivos Microbianos de la Facultad de Biología, Universidad de La Habana.
A partir de la obtención de un preinóculo para cada bacteria a 28 ( 2 ºC durante 24 h, en caldo nutriente y en agitación a 120 rpm, se propagaron las biomasas en Erlenmeyer de 1 000 ml con un volumen efectivo de 400 ml del mismo medio de cultivo, inoculado al 10 %. Los cultivos se incubaron a las condiciones referidas anteriormente. Las células se precipitaron por centrifugación 5 000 rpm durante 20 minutos, posteriormente se re-precipitaron con agua bidestilada a 10 000 rpm durante diez minutos y se secaron a 60 oC en estufa durante 12 h. Las biomasas en estado inactivado se conservaron a temperatura ambiente.
Aplicación de tratamientos químicos a las células inactivadas
A las biomasas inactivadas se les aplicaron dos tratamientos químicos independientes con soluciones de NaOH 0,1 M y HCl 0,1 M, en agitación durante dos horas. A continuación las biomasas se lavaron con agua destilada hasta que el pH alcanzó un valor de 6,0; se separaron por centrifugación y se secaron a 60 oC durante 12 h en estufa.
Conformación de los sistemas bacterianos mixtos
Se conformaron sistemas bacterianos mixtos (SBM) manteniendo la concentración equimolar de 2 g.l-1 para cada biomasa. Las combinaciones entre las tres bacterias inactivadas y pretratadas generaron cuatro variantes: SBM-1: Bacillus cereus (AL-30) y Acinetobacter sp. (AL-134), SBM-2: Bacillus cereus (AL-30) y Micrococcus sp. (AL-138), SBM-3: Acinetobacter sp. (AL-134) y Micrococcus sp. (AL-138) y SBM-4: todas las cepas bacterianas.
Determinación de la biosorción de cinc y cadmio
Los monocultivos inactivados y tratados por métodos químicos se pusieron en contacto con las soluciones de los metales en agua bidestilada estéril, en una concentración de biomasa de 2 g.l-1 y de 1,6 mM para ambos metales (ZnSO4.7H2O y CdCl2.4H2O), durante seis horas de contacto.
Como controles se utilizaron células inactivadas no pretratadas con los agentes químicos. Las suspensiones biomasa-metal se agitaron en zaranda a 100 rpm a 28 ± 2 ºC, se ajustó el pH a 6,0 con HCl 0,1M o NaOH 0,1M, según se requirió durante el proceso de biosorción.
En similares condiciones experimentales se evaluó la biosorción por los SBM en agua residual sintética monometálica y bimetálica, en este último caso se utilizaron concentraciones equimolares de ambos iones metálicos y se consideraron a los monocultivos como controles del ensayo. Luego se colectó el sobrenadante que contiene el metal residual, por centrifugación a 5 000 rpm durante 20 minutos y se conservó a 4 ºC hasta su análisis.
Análisis del metal residual
Los sobrenadantes se analizaron para la cuantificación del metal residual (concentración final del metal en solución) por Espectrofotometría de Absorción Atómica (EAA, equipo Philips 9100) con llama de aire-acetileno; se emplearon las siguientes longitudes de onda: Cd (II): 228,8 nm, Zn (II): 253,7 nm. Se preparó una curva de calibración para cada metal, que permitió calcular el coeficiente de correlación lineal (R2), la ecuación de la recta y el metal residual, a través del programa de computación Barnett (Microsoft Excel). Se determinó la cantidad de metal capturado según la ecuación 1 (Volesky 2007):
Donde:
q: miligramos de metal capturado por gramos de biomasa (mg.g-1)
Ci: concentración inicial del metal (mg.l-1)
Cf: concentración final del metal (mg.l-1)
m: masa de la biomasa en la mezcla de reacción (g)
V: volumen de la mezcla de reacción (l).
Determinación de la eficiencia de biosorción de cinc y cadmio
A las seis horas de contacto entre las biomasas (monocultivos y sistemas mixtos bacterianos) y los iones metálicos se determinó la eficiencia de la remoción de cinc y cadmio, mediante la ecuación 2 (Barros et al. 2003):
Donde:
E: eficiencia de la remoción del metal (%)
Ci: concentración inicial del metal (mg.l-1)
Ceq: concentración del metal en equilibrio, calculada por la ecuación 3 (Vieira y Volesky 2003):
Donde:
Ci: concentración inicial del metal (mg.l-1)
q: miligramos de metal capturado por gramos de biomasa (mg.g-1)
m: masa de la biomasa en la mezcla de reacción (g)
V: volumen de la mezcla de reacción (l).
Análisis biométricos
Todos los experimentos se realizaron por triplicado. A los datos se les comprobó la normalidad y homogeneidad de varianza mediante las pruebas de Kolmogorov-Smirnov y Bartlett, respectivamente. Las variables analizadas fueron: metal capturado por gramo de biomasa (q-mg.g-1) y porcentaje de eficiencia (E-%) de biosorción. Se aplicaron los análisis estadísticos paramétricos, prueba de t-student para la comparación de dos muestras a un nivel de significación de 0,01 o el análisis de varianza de clasificación simple cuando se compararon más de dos muestras.
Cuando en este último análisis se obtuvieron resultados estadísticamente significativos se aplicó la prueba de Tukey a posteriori para la comparación de las medias a un nivel de significación de 0,05. Para el procesamiento estadístico de los datos se empleó el programa de computación Microsoft Excel y el paquete estadístico Statistica versión 8.0 para Windows.
RESULTADOS
Biosorción de Zn(II) y Cd(II) por monocultivos inactivados y pretratados por métodos químicos
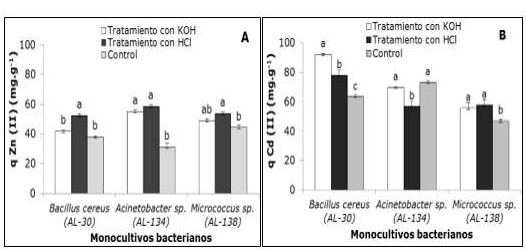
El efecto del pretratamiento con HCl 0,1 M y KOH 0,1 M en la biosorción de Zn(II) y Cd(II) por las biomasas bacterianas en estado inactivado se muestra en la Figura 1 (A y B), respectivamente.
En la Figura 1(A) se observó que se favoreció la captura de los iones Zn (II) por las tres biomasas bacterianas tratadas con HCl y destaca Acinetobacter sp. (AL-134) con ambos tratamientos, al duplicar los valores de remoción de este metal. Sin embargo, esta cepa no mostró resultados favorables con ninguno de los tratamientos en la biosorción de Cd (II) (Figura 1 B), con respecto al control según los análisis estadísticos. Dicho comportamiento difiere del presentado por Bacillus cereus (AL-30) y Micrococcus sp. (AL-138) que alcanzaron, con los dos tratamientos, valores de captura de cadmio significativamente superiores a los respectivos controles.
Remoción de iones metálicos por SBM
En la composición de los SBM se tuvo en cuenta el efecto favorable de los tratamientos químicos. Para la biosorción de los iones Zn (II) los SBM se combinaron a partir de las biomasas bacterianas inactivadas y tratadas con HCl, mientras que para el Cd (II) estas se trataron con KOH. Los SBM mostraron mayores niveles de captura de ambos metales, en relación con los controles, exceptuando el SBM-4 en la remoción del Cd (II); resultados que se muestran en la Figura 2, (A) para el Zn (II) y (B) para el Cd (II).

Figura 2 Remoción de iones metálicos (Zn (II)-(A), Cd (II)-B) por SBM y controles (monocultivos bacterianos) pretratados, en solución acuosa
En la biosorción de Zn (II) (Figura 2 A) se observaron en todos los SBM valores similares entre sí, resultados confirmados estadísticamente. Para el Cd (II), el SBM-1 alcanzó la mayor captura (163,24 ± 2,34 mg.g-1), con respecto a las demás variantes y monocultivos. Para este metal, el SBM-4, constituido por las tres bacterias, presentó la menor biosorción en relación a los otros sistemas mixtos (Figura 2 B).
La eficiencia de remoción de Zn (II) y Cd (II) por los cuatro SBM (Tabla 1) presentó porcentajes elevados, los que están entre 87,6 % ± 2,31 y 100 % ± 5,53.
Tabla 1 Eficiencia de la biosorción de Zn (II) y Cd (II) por SBM

E (%)-Porcentaje de eficiencia. (±) representan desviación estándar de tres repeticiones en cada caso. En la tabla, letras diferentes mayúsculas indican diferencias significativas entre los porcentajes de (E) de los sistemas mixtos. Letras diferentes minúsculas (a) indican diferencias significativas entre los porcentajes de (E) de cada sistema mixto y los controles (monocultivos inactivados tratados químicamente) para p<0,05, según la prueba estadística Tukey a posteriori.
Un valor agregado que presentan los resultados de la eficiencia de remoción de los metales por los SBM es que fueron logrados en solo 6 h del proceso de biosorción. Las combinaciones de las bacterias no presentaron diferencias significativas en sus eficiencias de biosorción del Zn (II), mientras que para los iones de Cd (II) se destacaron los sistemas SBM-1 y SBM-3, resultados confirmados estadísticamente.
Por otro lado, en la Tabla 1 se observa que en la interacción con el Zn (II) todos los SBM alcanzaron porcentajes de eficiencias significativamente superiores a los alcanzados por cada monocultivo que los conforman. Este comportamiento no se detectó para el Cd (II), donde los valores de eficiencia fueron estadísticamente similares entre los sistemas y sus controles; y la menor eficiencia expresada en porcentajes para este metal, con los SBM, fue de 87,6% ± 2,31 (SBM-4).
Mediante un ANOVA de clasificación simple y procedimiento de Tukey a posteriori aplicado para cada SBM y sus respectivos controles, se pudo confirmar las ventajas de utilizar cualquiera de los cuatro sistemas bacterianos mixtos para disminuir las concentraciones de los iones de cinc. Sin embargo, para el cadmio puede resultar más ventajoso emplear cualquiera de las tres bacterias como monocultivo.
Remoción de Zn (II) y Cd (II) de solución bimetálica por SBM
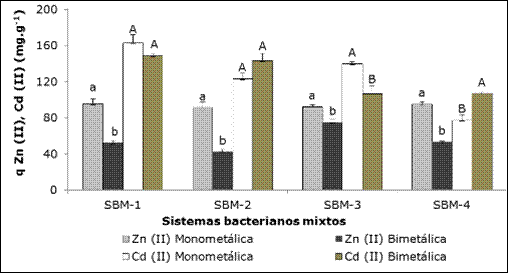
La captura de Zn (II) y Cd (II), a partir de una solución bimetálica, por los sistemas bacterianos mixtos se muestran en la Figura 3.
En la Figura 3 se percibe que el sistema bimetálico presentó una disminución significativa de la captura de los iones Zn (II) con respecto a la alcanzada en las soluciones monometálicas. En el caso del Cd (II) en dos de los sistemas (SBM-1; SBM-2) la remoción del metal fue similar entre ambas soluciones, mientras que SBM-4 removió más cantidad de cadmio de la solución bimetálica. Todos los SBM presentaron mayor afinidad en la remoción de cadmio, a partir de la solución bimetálica con respecto al cinc; resultados confirmados por los análisis estadísticos.
DISCUSIÓN
Los resultados favorables de los métodos químicos aplicados a las biomasas bacterianas pueden deberse a la acción que ejercen sobre los polisacáridos y proteínas celulares, potenciando una mayor disponibilidad de grupos funcionales modificados. Esto permite que se manifiesten submecanismos de biosorción como el intercambio iónico y la atracción electrostática entre los cationes y los sitios activos como aminos, fosfatos, carbonilos, carboxilos, hidroxilos y sulfhidrilos, que presentan una carga neta negativa (Zeraatkar et al. 2016).
El comportamiento heterogéneo entre los tratamientos sobre la captura de los metales puede ser atribuido a la dependencia del proceso de biosorción del microorganismo empleado, al posible efecto de los agentes químicos y a la existencia de mecanismos diferentes de intercambio iónico (Barange et al. 2014). Estas dependencias propician que los tratamientos aumenten o disminuyan la capacidad del biosorbente de capturar los metales. Un efecto positivo se observó en la captura de Cd (II) por Anabaena variabilis y otras especies de cianobacterias (Nagase et al. 2005), así como de Pb (II) y Ni (II) por Aspergillus niger (Rao y Bhargavi 2013), después del tratamiento alcalino. Resultados similares se informaron en la biosorción de Ni (II) por Saccharomyces cerevisiae var. Ellipsoideus, previamente tratada con HCl (Suazo et al. 2010). En contraste con lo anterior, otros autores han informado de la reducción de la captura de Ni (II) por Rhizopus nigricans, debido a daños en la biomasa y sus componentes celulares por tratamiento con NaOH (Sudhan y Abraham 2002).
En la biosorción de los iones metálicos por los SBM es importante tener en cuenta que la combinación de las biomasas en concentraciones equimolares aumenta el número de centros activos para la unión del metal, lo que favorece la biosorción (Uthra y Kadirvelu 2017). Sin embargo, no todos los SBM presentan el mismo comportamiento, tal es el caso del efecto negativo en la remoción de Cd (II) por el SBM-4.
La presencia de las tres bacterias en este sistema pudo ocasionar la formación de grumos y, consecuentemente, la disminución de la disponibilidad de grupos funcionales con afinidad por este ion. Las interacciones biomasa-metal están relacionadas con las características propias de cada microorganismo y del metal (Migahed, Abdelrazak y Fawzy 2016).
Los elevados valores de eficiencia de los tres monocultivos bacterianos y los cuatro SBM evidencian la factibilidad de su empleo en el tratamiento de efluentes contaminados con cinc o cadmio, o con ambos. La validación de esta afirmación está apoyada por criterios previos referentes a biosorbentes muy eficientes, cuando estos alcanzan porcentajes de eficiencias superiores al 60 % (Pethkar, Gaikaiwari y Paknikar 2001), así como a biosorbentes comerciales y otras tecnologías, aplicadas en la remoción de diferentes metales, con eficiencias entre el 95 % y 100 % (El-Naggar et al. 2018; Jaafari y Yaghmaeian 2019).
La variación en la captura del Zn (II) y del Cd (II) de la solución bimetálica se corresponde con resultados anteriores que muestran una afectación de la captura de un metal en presencia de otro. La disminución de la biosorción en un sistema multimetal en relación a un sistema simple se ha atribuido a las características propias de cada metal y del biosorbente, entre otras causas (Migahed, Abdelrazak y Fawzy 2016; Mahmoudet al. 2017).
Por otro lado, se conoce que en soluciones complejas como las mezclas de metales, la competencia interiónica que se establece tiene un importante efecto de antagonismo o sinergismo en la biosorción de los metales individuales (Mahmoud et al. 2017; Okoli et al. 2017) y causa adsorción y desorción sobre la superficie celular simultáneamente.
La preferencia en la captura del cadmio, con respecto al cinc, en una misma solución, puede explicarse por las particularidades de cada ion. Los iones Cd (II) tienen mayor afinidad por los ligandos, lo que permite predecir que desplace al Zn (II) de los sitios de enlace, como una reacción de intercambio metal-metal (Saber y Kin 2003).
Además, las propiedades de los cationes isovalentes como elevados valores de peso atómico (Cd (II)-48; Zn (II) -30), de radio iónico (Cd (II)-0,97 oA; Zn (II)-0,74 oA) (Holan y Volesky 1994), de electronegatividad (Cd (II)-1,69; Zn (II) -1,65) e incremento en la cantidad de órbitas y electrones orbitales externos (Zn: [Ar] 3d104s2, Cd: [Kr] 4d105s2), favorecen las interacciones y fuerzas de enlace entre los iones metálicos y los grupos funcionales de la biomasa (Jiang et al. 2017).
La combinación de biomasas de diferentes microorganismos y de iones metálicos en una misma solución es una estrategia que se ha utilizado para simular las condiciones naturales del efluente a tratar. Resultados significativos se han informado en la biosorción de Hg (II), Cu (II) y Ni (II) por un biosorbente heterogéneo, de biomasa inactivada de bacterias, levaduras y hongos filamentosos (Ridha 2015).
Este biosorbente alcanzó eficiencia en la remoción de los metales superiores al 82,4 % y una captura selectiva del mercurio, debido al elevado peso atómico, electronegatividad y baja solubilidad de este metal. Otro trabajo informó la biosorción de Sr (II) > Pb (II) > Cu (II)> Cs (I) por una combinación de biomasas inactivadas de Bacillus subtilis y Saccharomyces cerevisiae (Hu et al. 2017).
CONCLUSIONES
Los mayores valores de captura de Zn (II) se logran con Acinetobacter sp. (AL-134), tratado con HCl y KOH, mientras que para el cadmio resulta más favorable la aplicación del KOH a Bacillus cereus (AL-30), lo que evidencia que el efecto de un tratamiento químico específico sobre la biosorción de los metales depende de la cepa bacteriana y del metal.
Los cuatro sistemas bacterianos mixtos alcanzan porcentajes de eficiencia superiores al 87 % y al 91 % en la biosorción del cadmio y cinc, respectivamente; los cuales son más efectivos en la captura de los iones Zn (II), con respecto a los monocultivos. Además, presentan mejor funcionamiento en la remoción del cadmio en soluciones bimetálicas. Los SBM podrían tener aplicación en el tratamiento de residuales líquidos impactados con cinc o cadmio, o ambos, así como los monocultivos para la biosorción de los iones de Cd (II).