INTRODUCCIÓN
Debido a que la demanda de alimentos en el mundo aumenta, mientras que recursos primordiales como el suelo y el agua se pierden rápidamente, la agricultura debe ser una actividad que conserve el suelo y mejore las condiciones de aquellos que ya se han degradado. Ante esta situación, la comunidad científica desempeña una labor decisiva en la búsqueda de posibles soluciones para la mitigación de los daños al medio ambiente, e incrementar la producción agrícola (Aguado-Santacruz, 2012). Una de las alternativas para vencer dichos retos es el uso de bioproductos en la agricultura. Entre estos, los biofertilizantes son preparados que contienen microorganismos vivos o latentes (bacterias u hongos, solos o combinados) y, que al ser inoculados pueden vivir en simbiosis con las plantas y le ayudan a su nutrición y protección (Gagreda-Cabrera et al., 2012; Chojnacka, 2015).
El fósforo (P) es uno de los macronutrientes más limitantes para la productividad de los cultivos y su deficiencia es un fenómeno común en suelos agrícolas en todo el mundo. A pesar de la aplicación a largo plazo de fertilizantes a base de fosfatos para aumentar los rendimientos de los cultivos, la disponibilidad de P a menudo es baja. Las plantas obtienen este elemento de la solución del suelo, principalmente de las formas inorgánicas más disponibles, pero debido a su alta reactividad química y su demanda, su disponibilidad se reduce rápidamente (Tapia, 2013; Zhu et al., 2018). En este contexto, la actividad microbiana es de gran transcendencia, al solubilizar los fosfatos no disponibles para la planta, los cuales se encuentran bajo formas orgánicas e inorgánicas. Las bacterias del suelo del género Pseudomonas, son particularmente activas como solubilizadoras de fosfatos (Cuervo, 2010; Otieno et al., 2015).
En procesos de fermentación microbiana para obtener bioproductos con bacterias solubilizadoras de fosfatos se requiere identificar las variables independientes y sus valores óptimos que mayor influencia tienen en el rendimiento del producto deseado. No obstante, es una actividad compleja ya que interactúan varios factores.
El análisis de una variable a la vez en un proceso de fermentación es laborioso, consume tiempo y los resultados generalmente carecen de valor predictivo. Estas limitaciones pueden ser resueltas con el empleo de técnicas estadísticas multivariadas que permiten optimizar las condiciones de fermentación tomando en consideración la interacción entre los factores (Bezerra et al., 2008). Es posible por ejemplo, encontrar el nivel óptimo de cada variable independiente usando el diseño compuesto central (DCC) bajo la metodología de superficie de respuesta (MSR) (Rao et al., 2000; Box et al., 2005; Bezerra et al., 2008). Resultados satisfactorios han sido referidos con este enfoque por varios autores (Abdel-Fattah y Olama, 2002; Xiong et al., 2008; Abo-Zaid et al., 2015).
En Cuba se ha desarrollado un biofertilizante a base de una cepa de Pseudomonas fluorescens, solubilizadora de fosfatos, que se caracteriza por su alta capacidad de solubilizar el fósforo mineral y orgánico, por producir sustancias estimuladoras del crecimiento vegetal y antibióticos (Bach, 2002). Ha sido utilizado con resultados positivos en varios cultivos (Bach, 2002; Dibut et al., 2006; Díaz-Blanco y Márquez-Reina, 2011). Para elaborar el medio de cultivo se emplea melaza cuya composición y calidad varían según el rendimiento. Ante la necesidad de estandarizar su escalado industrial mediante un proceso de fermentación y mejorar la calidad de su formulación, este trabajo tuvo por objetivo optimizar el medio de cultivo y las condiciones de fermentación de la bacteria.
MATERIALES Y MÉTODOS
Cepa bacteriana
Se empleó una cepa de Pseudomonas fluorescens, conservada por liofilización, del Cepario de la Unidad Productora de Vacunas Virales y Bacterianas (UP-7) de LABIOFAM.
Con el objetivo de optimizar el medio de cultivo para el crecimiento de la bacteria se realizaron ensayos a escala de zaranda y posteriormente se optimizaron las condiciones de fermentación velocidad de agitación y flujo de aire en un fermentador con 8.5 litros de volumen efectivo. En cada caso se realizó una validación experimental. Se propuso un diseño factorial para la sustitución de melaza en el medio de cultivo inicial por otra fuente de carbono y la variación de la composición de la fuente de nitrógeno y fósforo. La duración del proceso fermentativo inicial era de 20-22 horas para obtener la biomasa a partir de la cepa bacteriana.
Optimización de medio de cultivo a escala de zaranda
Se realizó el diseño y la formulación del medio de cultivo teniendo en consideración la composición elemental de las bacterias (Scragg, 1997). La optimización se realizó mediante un diseño compuesto central (DCC) para ajustar superficies de respuesta siguiendo la metodología de Box et al. (2005).
Los niveles de los factores se determinaron según ensayos preliminares y la composición previa del medio de cultivo para obtener el biofertilizante a base de P. fluorescens. Se tomaron como variables independientes las concentraciones de las fuentes de carbono, nitrógeno y fósforo. Cada factor con dos niveles: alto y bajo (+1, -1).
Como variable de respuesta se determinó el crecimiento celular (biomasa) por lectura de Densidad Óptica λ =600 nm (DO600). Se aplicó un diseño factorial 23 con puntos estrellas equidistantes y seis repeticiones en el centro del plan considerado como cero. Se realizaron un total de 20 corridas experimentales, con tres repeticiones cada una y se determinó la ecuación de regresión. Para la representación gráfica se utilizó la metodología de superficie respuesta. Las variaciones de los parámetros se presentan en la tabla 1.
Tabla 1 Concentraciones de Fuentes de Nutrientes (g l-1) para la optimización de medio de cultivo a escala de zaranda en la fermentación de Pseudomonas fluorescens.

Con las combinaciones que el análisis de superficie de respuesta arrojó como óptimas para la mayor producción de biomasa, se realizó una fermentación para validar experimentalmente los resultados.
Obtención del preinóculo
Se prepararon tres Erlenmeyers con 100 ml del medio de cultivo formulado con las concentraciones de la fuente de carbono, nitrógeno y fósforo correspondientes al centro del plan. Se esterilizó en autoclave a 121 °C y 111.5 kPa durante 25 minutos. Luego se adicionaron 2 ml del medio de cultivo a cada tubo de la cepa conservada, se agitó hasta desprender el cultivo y la suspensión de células obtenida se añadió a cada Erlenmeyer. El preinóculo permaneció en zaranda durante 18 horas a 220 rpm. Mediante la observación de los caracteres morfológicos de las células bacterianas en la tinción de Gram se comprobó la pureza del cultivo.
Optimización del medio de cultivo
Los medios de cultivo para la fermentación en zaranda se prepararon en Erlenmeyers de 250 ml de capacidad con un volumen de 90 ml del medio de cultivo formulado según el diseño experimental factorial 23 con tres repeticiones de cada tratamiento. La esterilización del medio de cultivo se realizó en autoclave a 121 °C y 111.5 kPa durante 25 minutos. Los Erlenmeyers se inocularon con 10 ml de preinóculo para un volumen total de 100 ml y se colocaron en zaranda 12 horas a 30 °C y 220 rpm. Se midió la DO600 y el pH al inicio de la fermentación y cada dos horas hasta concluir el experimento. Se comprobó la pureza mediante tinción de Gram.
Determinación de biomasa
El incremento en biomasa se determinó por masa seca (mg), se tomaron muestras por duplicado de 1.5 ml de cada dilución en tubos de ensayo (Eppendorfs) previamente secados a 50 °C por 24 h y luego pesados. Los cultivos bacterianos se centrifugaron a 14 000 rpm por 20 minutos a 4 °C y el sobrenadante fue decantado. Los tubos se llevaron al horno a 50 °C hasta lograr peso constante y se utilizó como blanco el medio de cultivo sin inocular.
Para la determinación de la DO600 se tomaron muestras por duplicado de 1.5 ml de cada dilución en tubos de ensayo (Eppendorfs) y se realizó la curva patrón de masa seca (mg).
Se realizaron mediciones de la DO600 al inicio y posteriormente cada dos horas para cada réplica de los medios de cultivo ensayados hasta la fase estacionaria del cultivo, y se construyó la curva de crecimiento.
Además, se cuantificaron los azúcares reductores mediante la técnica del ácido 3,5-dinitrosalicílico (DNS) (Miller, 1959).
Los parámetros cinéticos calculados fueron biomasa producida (ΔX), velocidad específica máxima de crecimiento (μmáx) y rendimiento Yx/s. El Yx/s se calculó como la relación entre la biomasa producida (g) y el consumo total de sustrato (g) (ΔS) (Doran, 2013). A partir de los datos de la curva de crecimiento se graficó el logaritmo natural de la concentración de células en función del tiempo según la ecuación:
lnX = lnXo +μmáx(t - to)
Optimización de las condiciones de fermentación
Para optimizar las condiciones de fermentación se empleó un fermentador de 12 litros de volumen total con 8.5 litros de volumen efectivo. Se tuvieron en cuenta los resultados de la optimización del medio de cultivo y se analizó el efecto de la velocidad de agitación y el flujo de aire sobre la producción de biomasa de la bacteria.
Se empleó un diseño factorial 22 con tres repeticiones en el centro del plan, para un total de 11 corridas experimentales. Como variable de respuesta se determinó el crecimiento celular por DO600 y se correlacionó con la curva patrón de masa seca obtenida.
Se determinó la ecuación de regresión. Para la representación gráfica se utilizó la metodología de superficie respuesta. Los parámetros para la fermentación de 8.5 l de volumen efectivo se presentan en la tabla 2.
Tabla 2 Factores y niveles empleados en la optimización de las condiciones de agitación-aeración en fermentador de 8.5 l de volumen efectivo.

Para validar experimentalmente los resultados, con las combinaciones que el análisis de superficie de respuesta arrojó como óptimas para la mayor producción de biomasa, se realizó una fermentación discontinua durante 12 horas utilizando el medio de cultivo optimizado. El pH se ajustó a 7.4 antes de esterilizar. La concentración de azúcares expresados como reductores al inicio de la fermentación fue de 9.93 g l-1. Se realizó la curva de crecimiento a partir de mediciones de DO600 cada dos horas y se determinó el consumo de sustrato por el método del DNS.
Para la obtención del preinóculo de la fermentación se prepararon dos Erlenmeyers con 500 ml del medio de cultivo optimizado y se esterilizó en autoclave a 121 ºC y 111.5 kPa durante 30 minutos. Luego se adicionaron 10 ml del medio de cultivo a dos tubos de cultivo de P. fluorescens, se agitaron hasta desprender el cultivo y la suspensión de células obtenida se inoculó en cada Erlenmeyers. Estos se mantuvieron en zaranda a 220 rpm durante 12 horas. Se realizó evaluación de la pureza mediante tinción de Gram.
Se prepararon para la fermentación 7.5 l del medio de cultivo optimizado y se esterilizó en autoclave a 121 °C y 111.5 kPa durante 45 minutos. Luego se inocularon con un litro de preinóculo para un volumen total de 8.5 l. La fermentación se realizó durante 12 horas, a 30 °C.
Se realizaron mediciones de la DO600 al inicio y posteriormente cada dos horas para cada réplica de los medios ensayados hasta completar 12 horas. Con los resultados de la DO600 a partir de la curva patrón realizada se determinaron los valores de crecimiento de biomasa en (g l-1), con los que se construyó la curva de crecimiento de la cepa. Se realizó evaluación de la pureza mediante tinción de Gram.
Tratamiento estadístico de los resultados experimentales
Los diseños experimentales empleados y los análisis estadísticos realizados fueron generados y ejecutados mediante software Statistic Package for Social Science (SPSS) versión XV- Centurión y Microsoft Excel para Windows. En ambos procesos de optimización se obtuvo un modelo que representa la curva de regresión con los coeficientes significativos. En cada caso se realizó un análisis de varianza y se mostraron los resultados a través de diagramas de Pareto. El intervalo de confianza establecido fue de 95%, tomando como significativos aquellos factores que tenían un valor de Probabilidad (P)>F menor de 0.05.
RESULTADOS Y DISCUSIÓN
Optimización de medio de cultivo a escala de zaranda
Al considerar el efecto de las tres variables independientes (concentraciones de carbono, fósforo y nitrógeno) en el diseño factorial utilizado, se obtuvo una ecuación de la forma:
Y=bo+b1X1+b2X2 +b11X12+b12X1X2 +b22X22
Se comprobó que una disminución en las concentraciones de las fuentes analizadas, favoreció la producción de biomasa (Figura 1). Las fuentes de carbono, nitrógeno y fósforo fueron significativas con 95% de nivel de confianza. Los resultados se correspondieron con los informados en el análisis de varianza por otros autores (Xiong et al., 2008; Wang y Wan, 2009). El aumento en la concentración de la fuente de carbono, puede disminuir la producción de biomasa de la cepa, como una posible consecuencia a la inhibición del crecimiento por exceso de sustrato (van Keulen et al., 2011).

Figura 1. Diagrama de Pareto del efecto de las fuentes de carbono, nitrógeno y fósforo en la en la optimización del medio de cultivo para la producción de biomasa.
El análisis mediante la metodología de superficie respuesta evidenció que la variable dependiente se incrementó cuando las fuentes de carbono y de amonio se encontraban en el nivel bajo (Figura 2). Resultados similares fueron observados por Becerra (2007).

Figura 2 Gráficas de superficie de respuesta (A) y de contorno (B) entre las variables que representan las fuentes de carbono y fósforo.
Por otra parte, el crecimiento de biomasa mostró su máximo valor cuando las concentraciones de carbono y fósforo se encontraban en el nivel bajo y alto respectivamente (Figura 3). Cuando los dos factores se hallaban en el nivel alto se observó una disminución en la producción de biomasa, lo que confirmó el efecto negativo de esta interacción.

Figura 3 Gráficas de superficie de respuesta (A) y de contorno (B) entre las variables que representan las fuentes de carbono y nitrógeno.
Sin embargo, la mayor producción de biomasa se obtuvo principalmente por el aumento en la concentración de la fuente de fósforo y un nivel bajo en la concentración de la de nitrógeno (Figura 4). No se evidenció una etapa de adaptación en el microorganismo. Se ha demostrado que si un cultivo exponencial se inocula en el mismo medio de cultivo y en condiciones similares, el crecimiento exponencial se inicia inmediatamente y se reduce el tiempo en la fase de latencia.
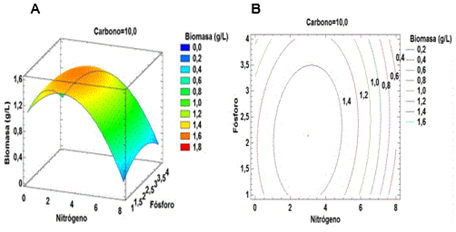
Figura 4 Gráficas de superficie de respuesta (A) y de contorno (B) entre las variables que representan las fuentes de nitrógeno y fósforo.
La cinética de crecimiento de la cepa de P. fluorescens en el medio de cultivo optimizado mostró que la fermentación concluyó a las 12 horas ya que el valor de absorbancia se mantuvo constante en las últimas mediciones realizadas (Figura 5). Este resultado confirmó que el microorganismo se encontraba en fase estacionaria (Kulkarni, 2002).

Figura 5 Crecimiento de Pseudomonas fluorescens en el medio de cultivo optimizado a nivel de zaranda mediante la metodología de superficie respuesta.
Los resultados a nivel de zaranda demostraron la utilidad del empleo de la metodología de superficie respuesta para optimizar el proceso fermentativo (Tabla 3). Esta metodología se aplica ampliamente en procesos analíticos y se ha consolidado por sus innumerables ventajas de generar grandes cantidades de información de un pequeño número de experimentos y la posibilidad de evaluar el efecto de interacción entre las variables en la respuesta (Bezerra et al., 2008). En procesos de fermentación donde intervienen especies de Pseudomonas se ha utilizado por diferentes autores con resultados positivos (Dutta et al., 2004; Tanyol et al., 2015).
Optimización de las condiciones de fermentación
Mediante el análisis realizado se constató que tanto la velocidad de agitación, como el flujo de aire ejercieron una influencia significativa en el aumento de biomasa en la fermentación para un intervalo de confianza del 95% como se muestra en el diagrama de Pareto (Figura 6).
Mediante la aplicación del análisis de regresión se generó la ecuación cuadrática: Biomasa (g l-1) = 1.674 - 0.237 A - 0.514 B - 0.741A2 + 0.162AB - 0.471 B2

Figura 6 Diagrama de Pareto del efecto de la velocidad de agitación y el flujo de aire en la producción de biomasa.
A partir del modelo de regresión se obtuvo la gráfica de superficie de respuesta para la interacción agitación-flujo de aire (Figura 7) donde se representan los contornos para la producción de biomasa como función de la velocidad de agitación y el flujo de aire. El círculo concéntrico más pequeño de la superficie de contorno se encontró en el intervalo de valores codificados de velocidad de agitación-flujo de aire donde el crecimiento de biomasa alcanzó sus valores máximos. Esta región va desde 640 a 710 rpm y de 0.79 a 0.99 vvm, muy cercana a los niveles centrales 700 rpm y 1 vvm.
A través de la utilización del análisis matemático se determinó que los valores óptimos de velocidad de agitación y flujo de aire fueron de 677 rpm y 0.88 vvm, respectivamente. Se apreció un óptimo local en esta zona para la variable dependiente. Según el modelo matemático con estas condiciones se logró obtener una concentración máxima de biomasa de 1.76 g l-1.
Operando el fermentador a 677 rpm se garantiza una concentración de nutrientes homogénea en el recipiente. Esto posibilita una mayor producción de biomasa ya que el microorganismo tiene fácil acceso a los nutrientes requeridos para sus procesos bioquímicos. Sin embargo, a valores superiores disminuye la biomasa ya que la agitación mecánica crea esfuerzos cortantes que pudieran afectar a las estructuras celulares.

Figura 7 Gráficas de superficie de respuesta (a) y de contorno (b) mostrando el efecto de la velocidad de agitación y el flujo de aire sobre la producción de biomasa de Pseudomonas fluorescens en fermentador de 8.5 litros.
La validación experimental de los resultados obtenidos en la optimización de las condiciones de velocidad de agitación-flujo de aire mostró que en la curva de crecimiento se obtuvo un valor máximo de producción de biomasa de 1.73 g l-1 (Figura 8) que se correspondió en un 98.3% al estimado por el modelo predictivo (R2=0.9856). Este resultado evidenció que el modelo se correspondió con los datos experimentales.

Figura 8 urva de crecimiento de Pseudomonas fluorescens en fermentador de 8.5 litros de volumen efectivo en condiciones de velocidad de agitación y flujo de aire óptimas.
Cuando cesó el crecimiento celular, no existía un agotamiento completo de la fuente de carbono y energía a pesar de comenzar la fermentación con un valor bajo de azúcares reductores (9.93 g l-1), lo que indicó que la inhibición del crecimiento de la biomasa no ocurrió por agotamiento del sustrato limitante en el proceso (Figura 9) sino quizás por exceso. Al concluir el periodo de fermentación más de la mitad del sustrato no había sido utilizado. Otros autores como Patil et al. (2016) en la optimización del medio de cultivo para la producción de arginina deiminasa por P. putida observaron una respuesta similar de consumo incompleto de la fuente carbonada que unido a los niveles de nitrógeno condujeron a un incremento del pH que limitó el crecimiento bacteriano. Este aspecto podría considerarse para estudios posteriores.

Figura 9 Relación entre la concentración de biomasa y el consumo de azúcares reductores en la fermentación de Pseudomonas fluorescens en fermentador de 8.5 litros de volumen efectivo.
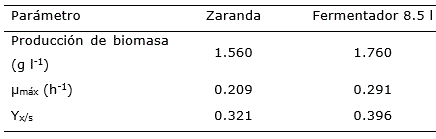
Los parámetros cinéticos obtenidos en el fermentador fueron superiores a los alcanzados en zaranda (Tabla 4), por lo que se obtuvo un mayor aprovechamiento de los componentes del medio de cultivo por la bacteria. Resultados similares fueron obtenidos por Sun et al. (2006) cuando emplearon medios de cultivo con la misma concentración inicial de azúcares reductores.
Tabla 4 Parámetros cinéticos obtenidos en zaranda y fermentador de 8.5 l de volumen efectivo para la producción de biomasa de Pseudomonas flurescens.
Operando el fermentador bajo las condiciones óptimas de agitación y flujo de aire, disminuyó a 8 horas el tiempo en que el microorganismo finalizó la fase de crecimiento exponencial.
El medio de cultivo semisintético diseñado para la cepa P. fluorescens permitió reducir las concentraciones de carbono, nitrógeno y fósforo en 29%, 50% y 44% respectivamente con respecto al medio de cultivo propuesto originalmente. Además, incrementó en un 34% la producción de biomasa. Las condiciones óptimas de velocidad de agitación y flujo de aire (677 rpm y 0.88 vvm) en el fermentación de 8.5 litros de volumen efectivo redujeron el tiempo de fermentación a 12 horas. En este sentido, se corroboró que la aplicación de técnicas estadísticas de diseño experimental en el desarrollo de procesos de fermentación contribuye a reducir la variabilidad y tiempo del proceso, a disminuir los costos y el número de ensayos a realizar (Box et al., 2005; Bezerra et al., 2008).















