INTRODUCCIÓN
La agroexportación en Perú ha causado un gran dinamismo (Perú Opportunity Fund, 2011) y se ha consolidado como la segunda fuente de divisas (Minagri, 2018). Para Creus (2017) debido al creciente reconocimiento del papel que juegan los procesos biológicos en el funcionamiento del suelo y en la producción agrícola, se ha buscado contrarrestar el efecto de la rápida pérdida de la calidad ambiental, con la promoción de la denominada agricultura sostenible. En este contexto, es necesario el uso racional de fertilizantes sintéticos y una opción para su reemplazo son el uso de microorganismos promotores de crecimiento vegetal, donde se encuentran especies de hongos y bacterias.
En la rizosfera de las plantas están presentes microorganismos fijadores de N2 (diazotrofos) (Cárdenas et al., 2010; Clavijo et al., 2012; Caldwell et al., 2015). De acuerdo con estudios realizados muchas de las bacterias fijadores de N2 presentan, además, diversos mecanismos que favorecen el desarrollo de plantas, lo que hace que sean consideradas como bacterias promotoras del crecimiento vegetal (PGPR, del inglés, Plant Growth Promotion Rhizobacteria)(Kumar y Rao, 2012). Un grupo de las PGPR más destacadas son las pertenecientes a los géneros Azotobacter y Azospirillum, las cuales son bacterias de vida libre que constitutivamente poseen la cualidad de fijar N2 atmosférico (Kumar y Rao, 2012; Arjun et al., 2015).
El uso de PGPR como biofertilizantes, tiene como objetivo una agricultura sostenible, estrategia que consta con una amplia aceptación mundial como uno de los métodos seguros para el control de plagas y la promoción del crecimiento de las plantas (Mhatre et al., 2018).
Entre las bacterias más estudiadas y frecuentes en la rizosfera de Coffea spp. se encuentan especies de los géneros Rhizobium, Azotobacter, Azospirillum, Acetobacter y Pseudomonas (Caldwell et al., 2015). Se han descrito algunos mecanismos por los cuales estos microorganismos podrían inducir el crecimiento de las plantas, entre los que se mencionan la síntesis de hormonas, como por ejemplo las auxinas (ácido indol acético), citoquininas y ácido abscísico. También se incluye la solubilización de fosfatos, la fijación de nitrógeno atmosférico y la síntesis de compuestos que inhiben el crecimiento de microorganismos fitopatógenos, como sideróforos, quitinasas, antibióticos, etc. (Lugtenberg y Kamilova, 2009).
Conociendo que la agricultura en Perú ha tomado impulso en los últimos años y dentro de ella el desarrollo cafetalero, el deterioro del suelo y la demanda de café orgánico, hace necesaria la búsqueda de alternativas para mejorar su productividad y calidad. Es preciso, además, el desarrollo de tecnologías amigables con el ambiente que puedan responder al crecimiento de la demanda de fertilizantes. Atendiendo a lo anterior, el presente trabajo tuvo como objetivo seleccionar cepas bacterianas nativas de la rizosfera de plantas de cafeto con actividad in vitro de promoción del crecimiento vegetal.
MATERIALES Y MÉTODOS
Se tomaron 500 g de muestras de suelo de la rizosfera (20 cm de profundidad aproximada) de plantas de cafeto (Coffea spp.) en cuatro fincas (Santa Rosa, Autiki, San Pedro y 28 de Julio) de Pichanaqui, departamento Junín (Perú) cuyas coordenadas geográficas son 10°55′25″S 74°53′44″O. El clima en la región se ha determinado como subtropical, semihúmedo y con precipitaciones anuales de aproximadamente 2200 mm y una temperatura promedio de 26 °C (Cuba e Ita, 2017). De acuerdo con la Leyenda de Suelos de FAO (1994), el tipo de suelos analizados son del Sub Grupo asociado Tipo Dystrudeptos-Tipo Udifluventes que se caracterizan por tener de 0 a 4% de pendiente, profundos, de textura franco arcilloso, de permeabilidad moderadamente lenta.
Aislamiento y caracterización
Las muestras de suelo fueron pre-enriquecidas en caldo NFb modificado (5 g ácido málico, 0.5 g K2HPO2, 0.2 g MgSO4.7H2O, 0.1 g NaCl, 0.02 g CaCl2, 4 ml Na-EDTA (1.64%, m/v) en un litro de agua) por 5 días a 28 °C. A partir de esta se realizaron diluciones seriadas en solución salina (0.85%, m/v) y seguidamente se inocularon por agotamiento (diluciones 10-3-10-5) en placas de Petri que contenían medio de cultivo sólido NFb (Agar 1.5%, m/v), Agar Ashby (20 g manitol, 0.2 g K2HPO4, 0.2 g MgSO4, 0.2 g NaCl, 0.1 g KSO2, 5g CaCO3, 15 g de Agar y 1 l de agua) y el medio de cultivo diseñado en el Laboratorio de Bioprocesos (6 g manitol, 6 g glucosa, 0.5 g extracto de levadura. 0.5 g K2HPO4, 0.2 g NaCl, 0.005 g NaMoO4.5H2O, 0.005 g MnSO4.4H2O, 0.1 CaCO3 en un litro de agua). Se realizaron ensayos por triplicado.
Se seleccionaron colonias grandes y viscosas y se purificaron. Se describió la morfología de la colonia considerando la elevación, margen, superficie y opacidad. Para la identificación de los aislados se realizó una tinción de Gram y adicionalmente se realizaron pruebas bioquímicas de actividad oxidasa, catalasa, KOH y ureasa (Holt et al., 1994; Buchanan y Bagi, 1994). Los aislados con identificación preliminar se nombraron según nomenclatura del laboratorio, se conservaron a 4°C y se conformó una colección de cepas para posteriores análisis.
Fijación biológica de N 2
La fijación de N2 de las cepas se evaluó por el método indirecto de valoración de ion amonio, utilizando la técnica colorimétrica de Berthelot (fenol-hipoclorito)Weatherburn, 1967). Para la cuantificación de nitrógeno amoniacal se cultivó cada cepa en tubos de ensayo, de 50 ml de capacidad, con 20 ml de medio de cultivo Burk (0.2 g l-1 Mg2SO4, 0.8 g l-1 K2HPO4, 0.2 g l-1 KH2PO4, 0.13 g l-1 CaSO4, 0.0015 g l-1 FeCl3, 0.000253 g l-1 Na2MoO4·2H2O y 20 g l-1 de sacarosa con 10% (m/v) de suelo rizosférico estéril. Los tubos se incubaron a 28 °C durante 96 horas a 150 rpm. Terminado la incubación se tomaron 5 ml de cada cultivo y se añadieron 5 ml de KCl 2M, se homogenizaron y se dejaron en reposo por 1 hora para precipitar, seguido se tomaron los caldos libres de suelo y se centrifugaron a 2 000 rpm por 20 minutos. Se recuperó el sobrenadante y se agregaron 0.08 ml de solución alcohólica de fenol al 10% (v/v), 0.08 ml de Nitroprusiato sódico al 0.5% (v/v) y 0.2 ml de solución oxidante (20% de citrato de sodio, m/v; 1% KOH, m/v y 1% de hipoclorito de sodio, v/v 1.5 N). Las soluciones se dejaron reposar por 1 hora y posteriormente se leyó la absorbancia en espectrofotómetro UV/Visible a una longitud de onda de 632.9 nm en el software MetaSpec Pro. Para la estimación de la concentración, se prepararon soluciones de NH4Cl en un rango 0.8 - 5.6 mg l-1 para realizar la curva patrón. Los ensayos fueron por triplicado. Para conocer la concentración neta fijada de nitrógeno se reemplazó los valores de la absorbancia en la curva patrón estimada, el resultado fue expresado en mg l-1 de nitrógeno fijado como NH4. Se seleccionaron las cepas que presentaron los valores más altos de nitrógeno fijado.
Producción de ácido indol acético (AIA)
Las cepas se inocularon en medio de cultivo caldo Triptófano (Merck) durante de 72 horas a pH 7 y 28 °C. Posteriormente se centrifugaron a 2000 rpm por 30 minutos y se recuperó 1 ml del sobrenadante. Seguidamente se agregaron 2 ml del reactivo de Salkowski (4.5 g de FeCl3 y 10.8 M de H2SO4; Glickmann y Dessaux, 1995) y se dejó reaccionar por 30 minutos en oscuridad. Para tener mayor agudeza en la detección de AIA se midió la absorbancia en el espectro visible para una muestra de 30 µg ml-1 de AIA (HIMEDIA) con 2 ml de reactivo de Salkowski. A partir los resultados se seleccionó la longitud de onda (λ) para leer la absorbancia en una curva patrón de AIA con las concentraciones de 5, 10, 15, 25 y 30 µg ml-1. Se seleccionaron las cepas que presentaron los mayores valores de producción de ácido indol acético.
Solubilización de fosfatos
Se realizaron pruebas cualitativas de solubilización de fosfatos de las cepas. Los resultados positivos fueron evidenciados por la formación de halos de coloración amarilla alrededor de las colonias debido al viraje a pH ácidos. Para ello, se utilizó el medio de cultivo agar SMRS-1 (0.2 g l-1 KCl, 0.5 (NH4)2SO4, 0.3 g l-1 MgSO4.H2O, 0.004 g l-1 FeSO4.7H2O, 0.2 g l-1 NaCl, 5 g l-1 Ca3(PO4)2, 10 g l-1 glucosa, 0.5 g l-1 extracto de levadura, 0.1 g l-1 Púrpura de Bromocresol (Becerra et al., 2011).
Se inoculó cada cepa en medio de cultivo caldo SMRS-1 sin indicador de pH (púrpura de bromocresol), se incubaron a 28 °C y 120 rpm. Después de 24 horas de crecimiento se centrifugó a 2500 RPM por 30 minutos, se recuperó la biomasa y se realizaron lavados celulares, y la concentración celular se ajustó a 3x108 ufc ml-1 con la escala de McFarland (McFarland, 1970). Se adicionaron 10 µl en la placa de Petri con medio de cultivo SMRS-1 y se dejó secar la microgota. Como control negativo se inoculó agua destilada estéril. Se identificaron por observación visual los halos de solubilización a los 5 días de incubación (28 °C). Todas las pruebas se realizaron por triplicado. Para hallar el índice de solubilización se siguió la fórmula utilizada por Santana y Vásquez (2002) índice de solubilización=(diámetro de la colonia+halo)/diámetro de la colonia. Se seleccionaron las cepas que presentaron índices de solubilización elevados.
Identificación molecular
Se procedió a la identificación de las cepas seleccionadas para cada una de las actividades promotoras de crecimiento vegetal. Para la extracción de ADN se cosechó una biomasa equivalente a 0.5-2 ml de cada cultivo de entre 4 a 6 horas de crecimiento a 30 °C en medio de cultivo tripticasa de soya (Merk) y se usó el protocolo modificado de Holmes y Quigley (1981). Para ello, se centrifugaron 1.5 ml de cultivo a 13 000 rpm por 5 min, luego se transfirió el pellet a 1 ml agua destilada y se incubó por 5 minutos a 100 °C, inmediatamente se congeló a -20°C por 10 minutos. Luego se centrifugó a 13 000 rpm por 10 minutos, se recuperó el sobrenadante en un tubo con dos volúmenes de etanol absoluto frío, se centrifugó nuevamente a 13 000 rpm por 10 minutos, se descartó el sobrenadante y se dejó secar al ambiente para luego resuspender con 20 μl de agua.
Para la amplificación de secuencia 16S rRNA por PCR se estandarizó 5 μl de volumen como el requerido para generar los amplicones mediante PCR de la región 16S rRNA. Se fijaron 30 ciclos para los cebadores 27f (5'-AGAGTTTGATCCTGGCTCAG-3'), 1492r (5’-GGTTACCTTGTTACGACTT-3’). Para ello se usó la enzima Taq DNA Polimerasa, y se fijó la temperatura de desnaturalización en 95 °C durante 20 segundos, mientras que, la temperatura de anidamiento fue 55 °C por 30 segundos. Finalmente, la temperatura de extensión se fijó en 72 °C por 30 segundos. El producto esperado fue evaluado por electroforesis en gel de agarosa (1%) y enviado a secuenciar por síntesis en la plataforma ABI 2000 por Macrogen INC. (Korea).
Los cromatogramas se analizaron mediante el software Chromas v 2.6.6 y se compararon las reacciones forward y reverse. Seguidamente se generó una secuencia consenso entre ambas reacciones. El producto de la reacción fue ingresado a la base de datos BLASTn (http://blast.ncbi.nlm.nih.gov), usando la opción megablast (secuencias más parecidas).
Análisis estadísticos
Todos los ensayos se realizaron por triplicado. Los datos se sometieron a pruebas de varianza para determinar las diferencias entre los ensayos, y la prueba de Turkey α<0.05 para comparar medias entre los ensayos. Los datos se analizaron mediante InfoStat-Statistical Software versión 2018.
RESULTADOS
Se realizaron 60 aislamientos de bacterias. El medio de cultivo NFb fue el que permitió realizar la mayor cantidad de aislamientos, de los cuales se seleccionaron 12 por presentar características macroscópicas (culturales), microscópicas y bioquímicas de posibles microorganismos diazotróficos, de acuerdo con el manual de Bergey (Baldani et al., 2015). Todos con colonias circulares, translúcidas y convexas, células de forma bacilar y Gram negativas (Tabla 1) y con actividades relacionadas con la promoción del crecimiento vegetal (Tabla 2). Los aislados seleccionados, caracterizados e identificados se nombraron como 1A, 1E, 1F, 1G, 1H, 1I, 2C, 2D, 2F, 2G, 2J y 2K y formaron parte de la colección de cepas del laboratorio.
Tabla 1. Características culturales y bioquímicas de 12 cepas aisladas de la rizosfera de plantas de cafeto (Coffea spp.) y seleccionadas por sus actividades promotoras del crecimiento vegetal.
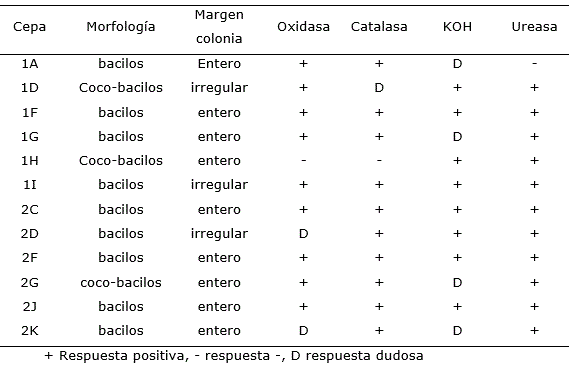
Tabla 2. Actividades relacionadas con la promoción del crecimiento vegetal en cepas bacterianas aisladas de la rizósfera de plantas de cafeto (Coffea spp.).
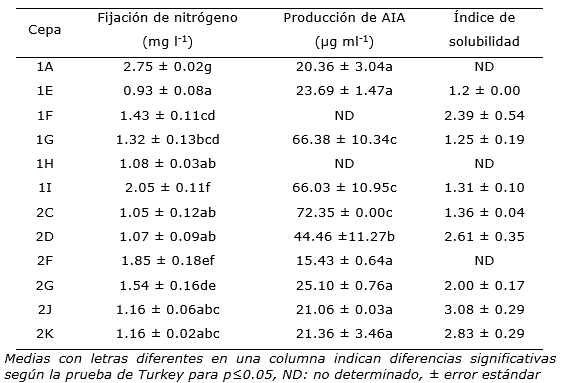
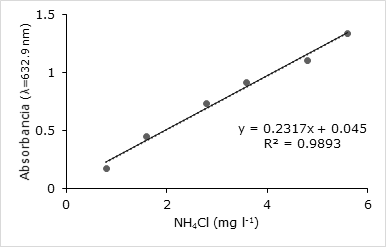
La curva patrón obtenida de NH4Cl (R2=0.9893) en un rango de concentraciones de 0.8 a 5.6 mg l-1 fue adecuada para la cuantificación de ion amonio en la determinación de forma indirecta de la fijación de nitrógeno atmosférico de las cepas, cultivadas en un medio de cultivo libre de N2 (Figura 1). Todas las cepas seleccionadas fijaron N2 atmosférico (Tabla 2).
Las cepas 1A y 1I presentaron la mayor concentración en este método. De acuerdo con los resultados, la cepa 1A y 1I obtuvieron 2.75 y 2.05 mg l-1respectivamente (Tabla 2).
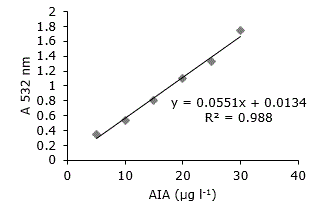
De acuerdo con los resultados de las lecturas de la solución de AIA (30 µg ml-1) en el espectro UV-vis se determinó como λmáx 531 nm (Figura 2). Por otro lado, la curva patrón obtenida tuvo un R2=0.988 (Figura 3). Los resultados de los análisis mostraron que el 83.3% de las cepas poseían la capacidad de sintetizar AIA (Tabla 2). En este grupo se encontró la cepa 2C la cual producía 72.35 µg ml-1 luego de dos días de incubación en medio de cultivo con triptófano. Otras cepas con elevada producción de AIA fueros 1I y 1G con 66.03 y 66.38 µg ml-1 respectivamente (Tabla 2).

Figura 2. Espectro de absorbancia en el espectro visible para la reacción del reactivo de Salkowski con AIA (30 μg l-1).
De acuerdo con los resultados de índice de solubilización se observó que el 75% de las cepas poseía capacidad de solubilización de fosfatos (Tabla 2). Las cepas con mayores índices fueron 2J, 2K y 2D con 3.08, 2.83 y 2.61 respectivamente.
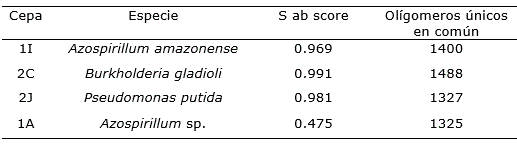
Atendiendo a los resultados de los ensayos de actividad promotora del crecimiento in vitro, para la identificación molecular se seleccionaron las cepas 1I, 1A, 2C (Figura 4) y 2J. En general, las secuencias analizadas mostraron un porcentaje de similitud alto (Tabla 3). Ello, excepto para la cepa 1A que mostró un valor bajo para esta puntuación, debido a la baja calidad de la secuencia, indicó una identificación confiable de las secuencias buscadas. Se identificaron tres géneros: Azospirillum (Figura 4), Pseudomonas y Burkholderia.

Figura 4. Colonias translúcidas típicas del género Azospirillum en medio de cultivo NFb. (a) Cepa 1I (Azospirillum amazonense), (b) Cepa 1A (Azospirillum sp.) aisladas de la rizosfera de Coffea spp.
DISCUSIÓN
Los resultados de este estudio corroboraron hallazgos previos de otros autores relacionados con que de la rizosfera de plantas de Coffea spp. se pueden aislar bacterias con actividad promotora del crecimiento vegetal.
En este sentido, trabajos como el de Jiménez-Salgado et al. (1997) mostraron que la mayor diversidad relacionada con la rizosfera de Coffea arabica estaba dominada por acetobacterias, como las principales responsables de la fijación de N2 y no encontraron aislados de Azotobacter. Otros autores tampoco lograron aislar este género de la rizosfera y suelo no rizosférico de plantas de cafeto pero identificaron la presencia de Bacillus, Burkholderia, Pseudomonas y Serratia (Muleta et al., 2007a; Muleta et al., 2007b; Muleta et al., 2009; Muleta et al., 2013). Incluso, estudios más recientes con enfoques metagenómicos a la rizosfera de cafetales coinciden con el hecho de no haber encontrado género de Azotobacter (Ogutu et al., 2016). Sin embargo, en casi todos los estudios mencionados se logró aislar Azospirillum spp. Una de las características más destacadas del género Azospirillum y de otros diazotróficos es la fijación biológica de N2 (Baldani et al., 2015).
En el presente estudio se obtuvieron cepas de Azospirillum, Burkholderia y Pseudomonas de la rizosfera de plantas de cafeto con actividades promotoras del crecimiento vegetal. Algunas cepas con más de un tipo de actividad como Azospirillum amazonense 1I, que posee actividad de fijación de nitrógeno, solubilización de fosfatos y producción de compuestos indólicos. Otras que se destacaron por un tipo de actividad como Burkholderia gladioli cepa productora de compuestos indólicos y Pseudomonas putida cepa solubilizadora de fosfatos.
También en Perú, Fernández (2015) obtuvo cepas de Azotobacter y Pseudomonas de la rizosfera de cafeto, en el distrito Naranjal de la provincia de Chanchamayo, como principales promotoras de crecimiento vegetal. Sin embargo, no aislaron bacterias de los géneros Azospirillum y Burkholderia a pesar de la cercanía geográfica con los sitios muestreados en este estudio.
Es común obtener aislados de suelo rizosférico con capacidad de fijar N2. Sin embargo, muchos estudios estiman la actividad nitrogenasa a través del ensayo de reducción de acetileno (Hardy et al., 1968) por ser más sensible y preciso. Sin embargo, es necesario disponer de equipamiento para la cuantificación. En este contexto, el método de Berthelot (Weatherburn, 1967) para estimar el N2 fijado mediante la cuantificación de nitrógeno amoniacal se posiciona como una alternativa. De acuerdo con los resultados obtenidos en la curva patrón de NH4Cl (R2=0.98) se constató que las 12 cepas obtenidas alcanzaron concentraciones entre 0.93 ± 0.08 y 2.75 ± 0.02 mg l-1. Otros autores han utilizado este método con resultados satisfactorios (Piña et al., 2016).
Los valores de producción de AIA por las cepas obtenidas en el presente trabajo fueron altos con respecto a otros estudios. Por ejemplo, Clavijo et al. (2012) con cepas de Sphingobium scionense alcanzaron valores cercanos a 46.47 μm ml-1. En otro caso, Angulo et al. (2014) obtuvieron hasta 28.09 μg ml-1 de AIA en una cepa de Rahnella aquatillis. No obstante, es ampliamente conocido que Azospirillum sp. posee la propiedad de sintetizar altas cantidades de AIA (Kumar y Rao, 2012).
Fernández (2015) demostró que cepas de los géneros Azotobacter y Pseudomonas, aislados de rizosfera de cafetos, solubilizaron fosfatos en sus dos componentes: bicálcico y tricálcico. Este autor refirió que el 88% y 93% de las cepas de los dos géneros, respectivamente, solubilizaron fosfatos. Porcentajes mayores al encontrado en la presente investigación solo con fosfato tricálcico.
Las cepas identificadas mostraron importantes resultados como promotoras de crecimiento vegetal. El género Azospirillum pertenece a un grupo de bacterias Gram negativas, fijador de nitrógeno, productor de auxinas, giberelinas y citocininas, así como de producir sideróforos y bacteriocinas (Tapia-Hernández et al., 1990). De igual forma, las especies de Burkholderia se refieren como fijadoras de nitrógeno con gran potencial de uso como promotoras de crecimiento vegetal, en la biorremediación y el control biológico (Caballero-Mellado et al., 2007). Por otra parte, Pseudomonas putida se reconoce como una especie eficiente en la solubilización de fosfatos y en la producción de AIA (Patten y Glick, 2002; Upadhyay et al., 2009). La presencia nativa de estas especies en la región cafetalera de Perú es importante porque abre la posibilidad de utilizarlos como biofertilizantes. Estas bacterias juegan un papel importante para el incremento de la productividad y el manejo del cultivo. La diversidad microbiana rizosférica lleva una variedad de microorganismos que ofrecen propiedades beneficiosas para los ecosistemas de las plantas (Bhardwaj et al., 2014; Chojnacka, 2015).
Estos resultados sientan las bases para estudios exhaustivos y continuos de su campo de aplicabilidad como inoculantes potencialmente importante para las prácticas agrícolas en el cultivo del cafeto. Inoculaciones con potentes microorganismos nativos están de acuerdo con opiniones contemporáneas sobre el posible rol de microorganismos promotores del crecimiento vegetal y que sostienen el suelo para mejorar los rendimientos.