INTRODUCCIÓN
Sophora toromiro (Phil.) Skottsb. (Fabaceae) es una especie arbórea endémica de la Isla de Pascua (Chile) y extinta en su habitad de origen (Maunder, 1997; Peña et al., 2000). Ha sobrevivido en un pequeño número de individuos que permanecen en jardines botánicos y colecciones privadas (Maunder 1997; Espejo et al., 2016). Por otro lado, Sophora representa uno de los géneros de plantas medicinales más importantes debido a sus componentes químicos y destacada actividad farmacológica (Aly et al., 2019).
Estudios previos muestran inconvenientes en la propagación sexual y asexual de esta especie (Alden y Zizka, 1989; Iturriaga et al., 1994; Espejo y Rodríguez, 2013), probablemente relacionado a una limitada diversidad genética (Maunder et al., 1999), lo que sugiere que sea considerada recalcitrante para su propagación.
En este escenario, el cultivo in vitro de tejidos se ha propuesto como una alternativa viable para la propagación y establecimiento de bancos de germoplasma (Rayas et al., 2019; Rosati y De la Cruz-Chacón, 2019). Sin embargo, la propagación in vitro de S. toromiro ha sido poco explorada. Autores como Iturriaga et al. (1994) y Jordan et al. (2001) informaron del potencial morfogénico de diferentes explantes para propagar in vitro esta especie, pero con resultados discretos. Indicaron, además, dificultad para la formación de raíces y por lo tanto para una eficiente regeneración de nuevas plantas. Profundizar en los estudios para propagar in vitro S. toromiro podría contribuir a su rescate y conservación. El presente trabajo tuvo como objetivo determinar la respuesta organogénica de explantes nodales de S. toromino en condiciones in vitro.
MATERIALES Y MÉTODOS
Material vegetal
El material vegetal utilizado como fuente inicial de explantes, correspondieron a segmentos nodales de aproximadamente 2.5 cm de longitud con dos yemas, provenientes de plantas obtenidas a partir de embriones cigóticos mantenidos in vitro. Las plantas madre provinieron del vivero comercial Brujas de Talagante, Chile.
Propagación in vitro
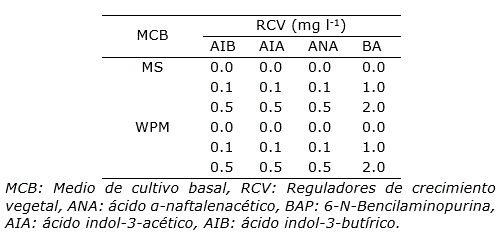
Para la formación de brotes, los explantes se colocaron en medio de cultivo MS (Murashige y Skoog, 1962) y WPM (Lloyd y McCown, 1980), con diferentes reguladores de crecimiento vegetal (RCV): 1.0 y 2.0 mg l-1 de 6-N-Bencilaminopurina (BAP), 0.1 y 0.5 mg l-1 de ácido indol-3-butírico (AIB), ácido α-naftalenacético (ANA) y ácido indol-3-acético (AIA), también se incluyeron controles sin la adición de RCV (Tabla 1).
Tabla 1. Medios de cultivo y reguladores de crecimiento utilizados para la regeneración in vitro de plantas Sophora toromiro.
Dos segmentos nodales fueron colocados de manera vertical en cada frasco de cultivo de 60 ml de capacidad que contenía 15 ml de medio de cultivo. A los 45 días de cultivo, se cuantificó el número de brotes por explante y se midió la altura del brote principal (cm).
Los brotes formados fueron escindidos y transferidos individualmente a frascos con los medios de cultivo MS y WPM a los cuales se adicionaron 0.1 y 0.5 mg l-1 de ANA, AIA y AIB para lograr el enraizamiento. Se incluyeron controles sin la adición de RCV (Tabla 1). A los 60 días de cultivo se cuantificó el número de explantes que formaron raíces y se calculó el porcentaje de enraizamiento por tratamiento. Además, se midió la longitud de la raíz principal (cm).
Todos los medios de cultivo fueron ajustados a pH 5.8 con HCl 1N o NaOH 1N, y se adicionaron 2 g l-1 de Gelrite y 20 g l-1 de sacarosa. Los explantes se mantuvieron en cámara de crecimiento incubados en fotoperiodo de 16 h luz/8 h oscuridad con luz fría de intensidad lumínica 3000 lux, y 22 ± 2 °C.
Diseño experimental y análisis estadístico
El diseño experimental aplicado fue un Diseño Completamente al Azar (DCA) con arreglo bifactorial, donde se evaluó el medio de cultivo y el tipo de regulador de crecimiento sobre la formación de brotes y raíces, resultando en 24 tratamientos con tres repeticiones. Cada unidad experimental correspondió a un frasco que contenía dos explantes, con un total de seis explantes por tratamiento. yij = µ + τi + βj + (τβ)ij + ɛij
Donde, Y ij es la variable evaluada (número de brotes, altura de brote, porcentaje de enraizamiento y longitud de raíz), µ es la media de las observaciones, Ti es el efecto del medio de cultivo, βj es el efecto del regulador de crecimiento, (τβ) ij es el efecto producido por la interacción entre τ x β, y el residual ɛij representa la variación aleatoria.
El efecto de los tratamientos sobre las variables respuesta, número de brotes, altura de brote (cm), porcentaje de enraizamiento y longitud de raíz(cm), se analizó mediante análisis de varianza, y las medias fueron comparadas con la prueba de Tukey (p<0.05) utilizando el software Statistica V.7.0 (StatSoft, Tulsa, OK, USA). Los valores de porcentaje de enraizamiento se normalizaron mediante la transformación angular de Bliss. Previo al análisis de varianza, la normalidad de los datos fue analizada mediante la prueba de Shapiro-Wilks y la homocedasticidad mediante la prueba de Levene. Los valores que no tuvieron distribución normal fueron transformados como √x+0.1
RESULTADOS
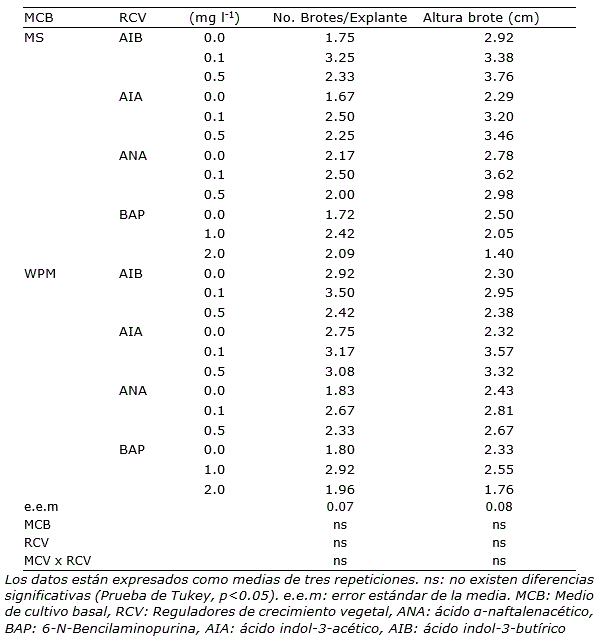
Los explantes generaron múltiples yemas adventicias en todos los medios de cultivo evaluados, incluso en aquellos que carecían de reguladores de crecimiento vegetal (Tabla 2). No se encontraron diferencias significativas para la variable número de brotes (p>0.05). Estos resultados sugieren que la formación de brotes a partir de segmentos nodales de plantas obtenidas in vitro a partir de embriones cigóticos, se puede lograr mediante cualquiera de los dos medios de cultivo usados en este experimento, inclusive prescindiendo de la adición reguladores de crecimiento vegetal (Figura 1).
Las características fenotípicas de los brotes mostraron variaciones en los diferentes medios de cultivo con los RCV, sin embargo, no se encontraron diferencias significativas para la variable altura del brote principal (p>0.05; Tabla 2). La menor altura de brote numéricamente se observó cuando estos crecieron con la concentración más alta ensayada de BAP (2 mg l-1), tanto en el medio de cultivo MS como en WPM, que alcanzó 1.40 cm y 1.76 cm, respectivamente.
Aunque la biomasa de las plántulas no se evaluó en la presente investigación, los brotes que crecieron en el medio de cultivo MS visualmente exhibieron un mejor aspecto. Se observaron foliolos verdes y de mayor tamaño en comparación con los brotes que crecieron en medio de cultivo WPM, que fueron menos frondosos y de color verde poco intenso, con independencia del tipo de RCV (Figura 1 A, B)
Tabla 2. Efecto de dos medios de cultivo y concentración de reguladores de crecimiento vegetal sobre la formación y crecimiento de brotes in vitro en Sophora toromiro a partir de segmentos nodales.
El efecto del medio de cultivo y los reguladores de crecimiento vegetal, así como, la interacción entre estos dos factores, mostró diferencias altamente significativas para la formación y crecimiento de raíces (p<0.001; Tabla 3). Los explantes que formaron la mayor cantidad de raíces (42.1%) fueron aquellos que crecieron en el medio de cultivo MS con 0.5 mg l-1 de ANA. Respecto al crecimiento de las raíces, se encontró que en el medio de cultivo MS + 0.1 mg l-1 de AIB se produjo el mayor crecimiento de raíces con 7 cm a los 60 días (Tabla 3; Figura 1). La formación y crecimiento de raíces en los medios de cultivo y RCV mostraron respuestas heterogéneas, se observó en varios tratamientos que existió escasa o nula diferenciación de raíces (Tabla 3).
Tabla 3. Efecto de dos medios de cultivo y concentración de reguladores de crecimiento sobre el enraizamiento y longitud de raíz principal in vitro en Sophora toromiro.
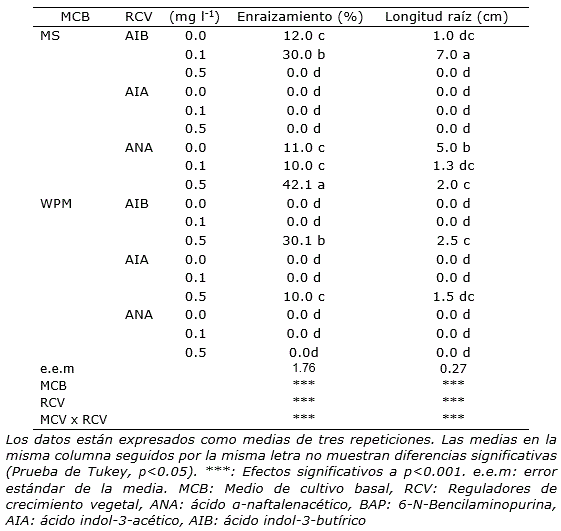

Figura 1. Explantes obtenidos in vitro a partir de segmentos nodales de Sophora toromiro. Brotes desarrollados in vitro después de 60 días en medio de cultivo (A) WPM + 0.1 mg l-1 de AIB y (B) MS + 0.5 mg l-1 de AIB. Planta enraizada obtenida de brotes de tallo cultivados in vitro después de 60 días de cultivo en medio (C) MS + 0.1 mg l-1 de AIB, y (D) MS + 0.5 mg l-1 de ANA.
DISCUSIÓN
Los resultados de este estudio mostraron evidencias de que es factible la formación y el crecimiento de brotes a partir de segmentos nodales obtenidos de embriones cigóticos en S. toromiro. Estudios previos en esta especie (Jordan et al., 2001) y en Sophora alopecuroides (Tsolmon et al., 2019) indicaron que la presencia de citoquininas, BA (Benciladenina), en medio de cultivo MS generaba alto número de brotes. En el presente trabajo, la adición de BAP tanto en medio de cultivo MS como en WPM, no exhibió diferencias respecto al uso de auxinas o incluso cuando no se utilizaron RCV, lo que sugiere que la formación y crecimiento de brotes se pueden lograr en esta especie a partir del tipo de explante inicial usado. Estos resultados están en concordancia con estudios previos en otras especies del género Sophora, donde en el medio de cultivo MS con la adición de BAP o 2iP se formaron yemas adventicias en explantes de Sophora tonkinensis (Jana et al., 2013; Wei et al., 2018).
La formación de brotes en segmentos nodales en S. toromiro mejoró sustancialmente comparado con los informes previos donde se usaron embriones cigóticos como fuente inicial de explantes (Jordan et al., 2001), incluso fue superior con respecto a explantes de segmentos nodales cultivados en medio de cultivo NN + ANA o BA (Iturriaga et al., 1994). Profundizar en estos aspectos en estudios posteriores permitirá optimizar la propagación in vitro de esta importante especie vegetal.
ANA y AIB son auxinas que se han utilizado ampliamente para la inducción de raíces en muchas especies de plantas (Bermúdez-Caraballoso et al., 2019; Mançano et al., 2019), incluyendo fabáceas leñosas como Acacia auriculiformi (Yadav et al., 2016) y Senegalia nigrescens (Bodede et al., 2018). De acuerdo con los resultados obtenidos en esta investigación, también son aptas para generar raíces en explantes de S. toromiro. Los resultados mostraron avances en la formación de brotes y raíces en S. toromiro, particularmente con incremento en el porcentaje de enraizamiento, respecto de estudios previos, en los cuales se logró entre un 10 y 20% (Iturriaga et al., 1994; Jordan et al., 2001).
En S. toromiro,Iturriaga et al. (1994) informaron que la formación de raíces se logró (10%) al cultivar segmentos nodales en medio de cultivo NN + ANA y BAP; por otro lado, Jordan et al. (2001), refirieron que el enraizamiento se logró en unos pocos explantes crecidos en agua destilada + ANA y BAP, e indicaron dificultades para la formación de raíces. Los resultados de la presente investigación, mostraron evidencias de que es factible usar el medio de cultivo MS para la formación de brotes, y con la adición de ANA, mejora el enraizamiento, en contraste con los estudios anteriores. Sin embargo, se evidencia que la formación de raíces es una etapa crítica para la regeneración in vitro de esta especie, y sugiere que es necesario mayor investigación para mejorar la fase de formación y crecimiento de raíces.
CONCLUSIONES
Explantes de segmentos nodales de Sophora toromiro tienen un potencial para la formación de brotes in vitro cuando son cultivados en medio de cultivo MS o WPM incluso sin la adición de reguladores de crecimiento. La inducción de raíces se puede conseguir en medio de cultivo MS con la adición de ANA, sin embargo, esta fase debe ser mejorada para asegurar una eficiente regeneración de plantas.














