INTRODUCCIÓN
La agricultura es el principal sector de crecimiento económico de los países en desarrollo (Nehra et al., 2016). Las producciones agrícolas mundiales se sustentan, principalmente, con el uso de cantidades elevadas de insumos como fertilizantes químicos y plaguicidas. Sin embargo, estos productos tienen un impacto negativo en los agroecosistemas, y constituyen un riesgo para la salud del hombre y los animales (Vejan et al., 2016). Debido a esta situación, los científicos buscan nuevas vías para disminuir el uso de productos agroquímicos, mediante su sustitución por otros menos agresivos al medioambiente y que contribuyan a obtener rendimientos que permitan satisfacer las demandas de la población.
Una de las estrategias para disminuir las poblaciones de organismos fitopatógenos, es el desarrollo de productos a base de Rizobacterias Promotoras del Crecimiento Vegetal (RPCV), los cuales constituyen una alternativa agroecológica y sostenible a la aplicación de compuestos sintéticos (Mishra et al., 2016; Méndez-Bravo et al., 2018). Los mecanismos de acción antifúngica de las RPCV sobre las plantas están relacionados con un aumento de la resistencia sistémica inducida, la producción de antibióticos, sideróforos y diferentes enzimas líticas, las cuales hidrolizan componentes de la pared celular de los hongos fitopatógenos y afectan su crecimiento y desarrollo (Moreno et al., 2018a; Thakur y Parikh, 2018).
En Cuba, la presencia de plagas fúngicas y bacterianas constituye una de las causas fundamentales de pérdidas económicas en numerosos cultivos importantes como el frijol común (Phaseolus vulgaris L.) (Martínez et al., 2014). Esta leguminosa, junto al arroz (Oryza sativa L.), constituyen la dieta básica de numerosos países latinoamericanos, y representa una fuente de proteína importante en países en vías de desarrollo, así como de otros elementos nutricionales como vitaminas, minerales y fibras (Moreno et al., 2018b). Considerando que los microorganismos de la rizosfera de las plantas poseen potencial biotecnológico (Haldar y Sengupta, 2015) se podrían aislar RPCV con propiedades como antagonistas frente a organismos fitopatógenos y productoras de enzimas.
Dentro de las RPCV, las bacterias formadoras de endosporas, entre las que se encuentra el género Bacillus, constituyen un grupo atractivo para el desarrollo de bioproductos de uso agrícolas en sustitución de los químicos. Sus características están bien documentadas y facilitan el desarrollo de formulaciones estables debido a que son resistentes a diversas condiciones ambientales (Thakur et al., 2017; Sabaté et al., 2018). Por otra parte, muchas de estas cepas son productoras de enzimas como celulasas, proteasas, amilasas y lipasas, y se utilizan como fuente de estos biocatalizadores que pueden tener aplicaciones en la producción de alimentos, bioetanol, papel, detergente y en la industria textil (Dida, 2018; Salvador et al., 2019). Atendiendo a ello, contar con cepas que posean estas características aisladas de la rizosfera de especies cultivadas como el frijol común y adaptadas a los suelos de cultivo constituye una prioridad para las investigaciones. En este contexto, el presente trabajo tuvo como objetivo obtener aislados de bacilos formadores de endosporas a partir de la rizosfera de diferentes cultivares de frijol (Phaseolus vulgaris L.) de tres tipos de suelo con potencial biotecnológico.
MATERIALES Y MÉTODOS
Colecta de suelo rizosférico
Se colectó suelo rizosférico de tres cultivares de Phaseolus vulgaris L. presentes en los municipios Colón y Unión de Reyes de la provincia de Matanzas, Cuba, en el mes de febrero de 2019. En Colón se muestrearon las cultivares Cuba Cueto 259-negro y Tomeguín 93, en la localidad de Río Piedra (Colón); mientras que en Unión de Reyes se tomaron muestras de Tomeguín 93 en Sabanilla y de Cul 156 y Tomeguín 93 en la localidad de Cabezas. El suelo en las áreas de colecta de Colón es de tipo Redzina Negra subtipo negro grisáceo, y en las áreas de colecta de Sabanilla y Cabezas de tipo Ferralítico Amarillento y Redzina roja, respectivamente (Hernández et al., 2015). La temperatura promedio en Colón en el mes de colecta fue de 23.6 °C, con máximas promedio de 28 °C y mínimas de 19.2 °C; mientras que las precipitaciones tuvieron un acumulado de 8 mm, aproximadamente. En Unión de Reyes la temperatura promedio fue de 24.1 °C, con temperaturas máximas y mínimas promedio de 28.7 °C y 19.8 °C, respectivamente. Las precipitaciones acumuladas en el mes de febrero fueron de 7 mm.
Las plantas de frijol provinieron de semillas suministradas por la Empresa Provincial de Semillas de Jovellanos de la misma provincia. Se tomaron 11 muestras de suelo rizosférico en cada área de cultivo mediante un diseño de bandera inglesa. Cada muestra contenía aproximadamente 15 g de suelo rizosférico, la cual se introdujo en envases plásticos estériles de 50 ml de volumen con ayuda de una espátula también estéril. Cada muestra estuvo compuesta por suelo rizosférico proveniente de 15 a 20 plantas.
Aislamiento
Con el objetivo de incrementar la población de células bacterianas, se resuspendieron 10 g de cada muestra en 100 ml de medio de cultivo Caldo Nutriente en Erlenmeyers de 250 ml de volumen. Las suspensiones se mezclaron vigorosamente y se colocaron a 37 °C en una incubadora (Boxun®) con agitación (125 rpm) durante 72 h (Johnson y Bishop, 1996).
Los cultivos de suelo en Caldo nutriente se calentaron a 80 °C por 12 min en baño María para eliminar las formas vegetativas y comenzar el aislamiento a partir de endosporas bacterianas (dos Santos et al., 2018). Se realizaron diluciones seriadas (10-1 - 10-9) en solución de NaCl al 0.9%. Se tomaron alícuotas de 100 µl de las últimas tres diluciones y se diseminaron sobre medio de cultivo Agar Nutriente (AN) en placas Petri (9 cm Ø) con ayuda de una espátula de Drigalski. Las placas se incubaron a 37 °C durante 72 h. Se seleccionaron colonias bacterianas con diferentes morfologías, las cuales se purificaron por agotamiento por estrías en placas Petri con medio de cultivo AN, y se colocaron en iguales condiciones de temperatura y tiempo de incubación de 24 h. Posteriormente se observaron los caracteres morfológicos mediante la tinción de Gram y se seleccionaron los aislados con forma bacilar, Gram positivos y esporulados. Los aislados obtenidos se purificaron mediante la técnica de siembra por agotamiento y posteriormente se nombraron a partir del nombre del cultivar y la localización (Tabla 1).
Ensayos bioquímicos
Producción de cianuro de hidrógeno (HCN)
Los aislados se inocularon por agotamiento por estrías en placas Petri (9 cm de diámetro) sobre medio de cultivo AN que contenía 4.4 g l-1 de glicina (Lorck, 1948). Se humedecieron papeles de filtro Whatman No. 1 con una solución compuesta por carbonato de sodio (2%) y ácido pícrico (0.5%) y se colocaron sobre la superficie interior de cada tapa. Las placas se sellaron con papel Parafilm® y se incubaron a 37 °C durante 4 días. El cambio de coloración en el papel de filtro de amarillo a amarillo claro, pardo oscuro y pardo rojizo, indicó el potencial cianogénico de los aislados como débil, moderado y fuerte, respectivamente. Se incubó una placa Petri sin inocular como control negativo.
Producción de enzimas hidrolíticas
β-1,3-glucanasa y/o quitinasa
Se determinó la capacidad de producir β-1,3-glucanasa y/o quitinasa por los aislados, en placas Petri con medio de cultivo compuesto por 4.0 g l-1 de levadura panadera y 15 g l-1 de agar (Gaye, 2016). Las placas se incubaron a 37 °C durante 48 h. La producción de una o ambas enzimas se determinó por la presencia de una zona clara alrededor de las colonias.
Proteasas
El ensayo de producción de proteasas se realizó en medio de cultivo semisólido con leche descremada (Chaiharn et al., 2008). Los aislados se colocaron con la ayuda de un asa de siembra sobre placas Petri (9 cm Ø) con medio de cultivo compuesto por 15 g l-1 de leche descremada, 0.5 g l-1 de extracto de levadura y 15 g l-1 de agar. Las placas se incubaron a 37 °C durante 48 h. La presencia de un halo claro alrededor de las colonias indicó la producción de proteasas. Se midieron los diámetros del halo y de la colonia con una regla milimetrada, para el cálculo del índice de potencia mediante la fórmula siguiente: IP (%) = (Z -C)/C * 100, donde Z: diámetro del halo claro alrededor de la colonia (mm), C: diámetro de la colonia bacteriana (mm).
Lipasas
La producción de lipasas se determinó mediante el método de Kim y Hoppe (1986). Los aislados se inocularon en placas Petri con medio de cultivo compuesto por peptona (10 g l-1), cloruro de calcio (0.1 g l-1), cloruro de sodio (5 g l-1), agar (15 g l-1) y 10 ml de Tween 80 (sorbitol monooleato; m/v). Las placas se incubaron a 37 °C por 48 h. La presencia de una zona de deposición opaca alrededor de la colonia indicó la producción de lipasas. Se determinó el índice de potencia de las colonias con actividad lipídica de manera similar al ensayo de producción de proteasas.
Amilasas
La producción de amilasas se determinó de acuerdo con el método de Karnwal (2011). Los aislados se sembraron en medio mínimo de sales que contenía almidón soluble (1.0%) y agar 15 g l-1. Las placas se incubaron durante 48 h a 37 °C y la producción de enzimas se observó mediante tinción del medio de cultivo con 20 ml de disolución iodada (2% de yodo y 0.2% de yoduro de potasio). La zona sin coloración alrededor de la colonia indicó la producción de enzimas amilasas.
Celulasas
Los aislados se sembraron en placas Petri con medio mínimo de sales con sal sódica de carboximetilcelulosa (1%) y agar 15 g l-1. Las placas se incubaron a 37 °C durante 48 h. El medio de cultivo se tiñó con 20 ml de una disolución de rojo Congo 0.5% durante 20 minutos y posteriormente se lavó el medio de cultivo con una disolución de cloruro de sodio (1 mol l-1) (Carder, 1986). Se determinó el índice de potencia mediante la medición de la zona clara alrededor de la colonia como se describió previamente.
Análisis estadístico
Los datos se procesaron con el programa estadístico SPSS versión 18.0 sobre Windows. Se determinó el ajuste de los datos a una distribución normal mediante la prueba de Bartlett y la homogeneidad de la varianza mediante la prueba de Kormogorov-Smirnov (Sigarroa, 1985). Se realizó un análisis de varianza simple para determinar diferencias entre los índices de potencia de los aislados estudiados. Para la comparación entre las medias se utilizó la Prueba de Rangos Múltiples de Duncan (Duncan, 1955) (p<0.05). Las medias y los errores estándar de cada cepa, en los diferentes ensayos, se determinó a partir de tres réplicas.
RESULTADOS Y DISCUSIÓN
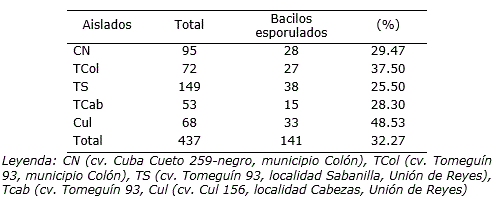
Se obtuvo un total de 437 aislados a partir de la rizosfera de las plantas de frijol de diferentes cultivares muestreados, de los cuales 141 (32.27%) correspondieron a bacilos Gram positivos con capacidad para producir endosporas (Tabla 2). Este resultado puede estar asociado con la presencia de otras bacterias Gram positivas resistentes a temperatura elevadas, como formas cocoides (Oslo y Nottingham, 1980) o a las condiciones de cultivo que limitaron la formación de estas estructuras.
Tabla 2 Aislados de bacilos esporulados Gram positivos obtenidos a partir de la rizosfera de plantas de cinco cultivares de Phaseolus vulgaris L.
Producción de cianuro de hidrógeno
La producción de cianuro de hidrógeno constituye uno de los indicadores importantes, que se evalúan en la búsqueda de aislados bacterianos con actividad antagónica de organismos fitopatógenos. Los sitios de colecta con mayor número de aislados productores de cianuro de hidrógeno correspondieron a los de la localidad de Cabezas, con los cultivares Tomeguín 93 (13.33%) y Cul 156 (12.12%) de la misma localidad (Figura 1) donde el suelo es de tipo Redzina roja. Entre los aislados analizados no se observaron productores de HCN en los obtenidos a partir de la rizosfera del mismo cv. Tomeguín 93 en la localidad de Sabanilla que tiene suelo de tipo Ferralítico Amarillento. Dicho resultado sugiere profundizar en la influencia del tipo de suelo en la composición de aislados de la rizosfera de este cultivar y sus propiedades.
Los porcentajes bajos (0-13%) de aislados productores de HCN, obtenidos en la presente investigación, coinciden con los resultados referidos por El-Sayed et al. (2014) quienes observaron 34 aislados con esta característica (6.45%) entre 531 analizados. De manera similar, Thakur et al. (2017) informaron aproximadamente 11%, mientras que Thakur y Parikh (2018) refirieron 12% de aislados productores de HCN a partir de la rizosfera de Arachys hipogea L. En otros géneros bacterianos como Pseudomonas, es posible obtener porcentajes elevados (88%) de aislados con la maquinaria bioquímica para la síntesis de cianuro de hidrógeno; sin embargo, estudios con aislados del Bacillus, evidencian valores inferiores en relación con esta propiedad (Saharan y Nehra, 2011). La ausencia de aislados productores de este metabolito secundario, a partir de la rizosfera de plantas de la cultivar Tomeguín 93, en la localidad de Sabanilla, puede estar relacionado con la diversidad baja de microorganismos presentes en el área de cultivo, con la capacidad genética de producir este compuesto. Sin embargo, un muestreo más amplio en la zona podría elevar la probabilidad de encontrar aislados con esta propiedad.
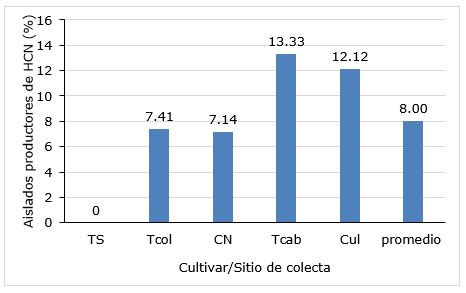
Figura 1 Porcentaje de aislados productores de cianuro de hidrógeno con respecto al total según el cultivar de frijol (Phaseolus vulgaris L.) y la localidad. Leyenda: +++: alta, ++: moderada, +: baja. CN (cv. Cuba Cueto 259-negro, municipio Colón), TCol (cv. Tomeguín 93, municipio Colón), TS (cv. Tomeguín 93, localidad Sabanilla, Unión de Reyes), Tcab (cv. Tomeguín 93), Cul (cv. Cul 156, localidad Cabezas, Unión de Reyes).
El aislado TCol54 mostró la producción más elevada de HCN (Tabla 3). TCab23 y Cul53 produjeron niveles moderados de este metabolito y el resto de los aislados seleccionados como positivos evidenciaron actividades bajas.
Tabla 3 Aislados bacterianos formadores de endosporas procedentes de la rizosfera de Phaseolus vulgaris L. productores de HCN.

La producción alta y moderada de cianuro de hidrógeno por TCol54 y Cul53, respectivamente, evidencia las potencialidades de estos aislados como agentes biocontroladores, ya que este compuesto se ha propuesto como un metabolito secundario volátil que actúa indirectamente en el control de organismos fitopatógenos (Laville et al., 1998). En otros trabajos, se le atribuye la propiedad de formar quelatos con metales y elevar su disponibilidad para las plantas, lo que potencia su crecimiento y desarrollo (Rijavec y Lapanje, 2016). Por lo tanto, el uso de aislados bacterianos productores de HCN en suelos deficientes de nutrientes, podría contribuir a la biofertilización de los cultivos y al desarrollo de una agricultura más agroecológica.
Producción de enzimas líticas
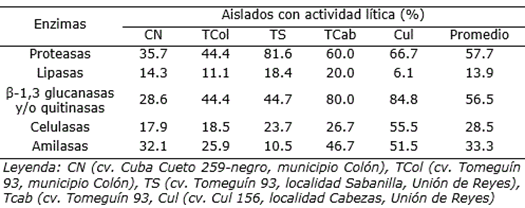
Los porcentajes más elevados de aislados productores de proteasas (81.6%) se obtuvieron en el cultivar Tomeguín 93 de la localidad Sabanilla. Por otra parte, los cultivares Tomeguín 93 y Cul 156, de la localidad de Cabezas, mostraron los valores más altos de aislados productores de las enzimas β-1,3 glucanasas y/o quitinasas, con 80.0 y 84.8%, respectivamente; mientras que en celulasas (55.5%) y amilasas (51.5%) se observaron en el cultivar Cul156 de la localidad de Cabezas (Tabla 4). La producción de enzimas como β-1,3 glucanasas, quitinasas, proteasas, lipasas, celulasas y amilasas por las RPCV, se emplea como una prueba común para seleccionar cepas con características biocontroladoras (Chaiharn et al., 2008; Geetha et al., 2014; Alia et al., 2020).
Tabla 4 Porcentaje de aislados productores de β-1,3 glucanasas y/o quitinasas, proteasas y lipasas según el cultivar de frijol (Phaseolus vulgaris L.) y el sitio de colecta.
Los resultados de este trabajo estuvieron en correspondencia con estudios previos de bioprospección realizados en la rizosfera de diferentes especies de plantas, donde se evidenciaron las potencialidades de los bacilos como microorganismos productores de enzimas hidrolíticas como lipasas (Geetha et al., 2014), proteasas (Thakur et al., 2017) y quitinasas (Dar et al., 2018). De manera similar, otros autores aislaron bacilos productores de amilasas y/o celulasas de Capparis spinosa L., Glinus lotoides L. y Tribulus terrestris L. (El-Sayed et al., 2014), Zingiber officinale Rosc. (Dinesha et al., 2015), arroz, Triticum aestivum L. (Modi et al., 2017; Przemieniecki et al., 2018) y Phaseolus vulgaris (Mokrani et al., 2018). Además, existen referencias de cepas de Bacillus productoras de estas enzimas, aisladas a partir de otras fuentes como estiércol vacuno (Ramachandran et al., 2016) y compost (De Marco et al., 2017).
Por otra parte, las diferencias en la composición de aislados por cultivar y sitio de colecta, así como su actividad de producción de enzimas podrían estar influenciados, además de por sus características genéticas, por el tipo y composición del suelo sometido a manejo agroecológico histórico de las áreas de cultivo. Por ejemplo, el uso intensivo de productos agroquímicos contaminantes, puede disminuir la diversidad de microorganismos presentes en un momento dado y por tanto, la probabilidad de encontrar una cantidad mayor de microorganismos con determinadas características genéticas. En el caso de los aislados productores de proteasas, celulasas y amilasas, es posible que un suelo rico en materia orgánica, asociado a un manejo agroecológico, puede sostener poblaciones diversas de microorganismos que produzcan estas enzimas, las cuales hidrolizan las proteínas, la celulosa y el almidón presentes en la materia orgánica. Los monómeros derivados de la hidrólisis de estas biomoléculas son utilizados por los microorganismos como fuente de nitrógeno y energía (Mishra et al., 2016; De Marco et al., 2017; Dida, 2018).
Entre los aislados seleccionadas como mayores productores de enzimas β-1,3-glucanasas y/o quitinasas estuvieron: Cul22, TCab2, TCol72, TS34, TS147, TS104; mientras que TS96, TS149, CN15, TS142, TCol40, TCol21 mostraron las producciones más elevadas de proteasas y TCol35, TS124, TS104 de enzimas lipasas (Tabla 5).
Tabla 5 Producción de enzimas β-1,3-glucanasas y/o quitinasas, proteasas y lipasas por aislados bacterianos formadores de endosporas aislados de Phaseolus vulgaris L.

La actividad β-1,3-glucanolítica y/o quitinolítica, proteolítica y lipídica mostrada por varios de los aislados analizados, indicaron un uso potencial de éstos como agentes biocontroladores de hongos fitopatógenos. Esto se debe a la capacidad que tienen estas enzimas de inhibir el crecimiento de las hifas de los hongos, ya que pueden provocar la lisis celular o modificar las paredes celulares de estos organismos, compuestas fundamentalmente por quitina, β-1,4-N-acetil-glucosamina, cadenas de β-glucano y proteínas (Haldar y Sengupta, 2015; Alia et al., 2020). Por ejemplo, un estudio sobre el complejo enzimático micolítico de Bacillus subtilis 739, evidenció que las enzimas quitinasa, β-1,3-glucanasa y proteasa, tienen la mayor contribución a la lisis de los micelios de varias especies de hongos fitopatógenos como Alternaria alternata (Fr.) Keissl., Bipolaris sorokiniana (Sacc.) Shoemaker, Fusarium culmorum (WG Sm) Sacc. y Rhizoctonia solani J.G. Kühn (Aktuganov et al., 2007). Además, la activación de las quitinasas y β-1,3-glucanasas pueden provocar la Resistencia Sistémica Inducida en las plantas, con lo cual se incrementan las defensas frente a hongos fitopatógenos diversos Yedidia et al., 1999). De manera similar, la acción conjunta de lipasas, proteasas, quitinasas y glucanasas, pueden inhibir el desarrollo de diferentes microorganismos patógenos como Botrytis cinerea Pers., Sclerotium rolfsii (Sacc.), Fusarium oxysporum f. sp. appi, Phytophthora spp. (Mont.) de Bary , R. solani, Pythium ultimum Trow, y Monographella nivalis (Schaffnit) E. Müll (Glick, 2012; Przemieniecki et al., 2018).
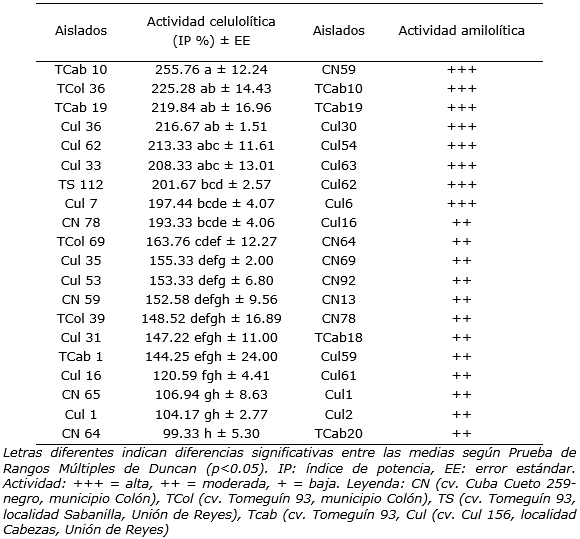
Los aislados bacterianos mayores productores de celulasas mostraron índices de potencia en un intervalo aproximado entre 201 a 255% (Tabla 6). Las RPCV con la capacidad de producir celulasas y amilasas tienen un valor elevado en la dinámica de los agroecosistemas, ya que degradan los residuos orgánicos de almidón y celulosa del suelo en azúcares simples y liberan al medioambiente minerales que pueden ser utilizados por estas bacterias en sus procesos metabólicos. Además, los productos de la hidrólisis enzimática incrementan la diversidad de microorganismos beneficiosos alrededor de la rizosfera, con funciones en el crecimiento y desarrollo de las plantas (Mishra et al., 2016). Por otra parte, los aislados productores de celulasas tienen importancia para acelerar el proceso de compostaje de la materia orgánica, con el objetivo de obtener abono orgánico (De Marco et al., 2017).
Tabla 6 Aislados bacterianos de la rizosfera de Phaseolus vulgaris L. de tres cultivares con las mayores actividades celulolíticas y amilolíticas.
Se ha comprobado que aislados de bacilos esporulados, pertenecientes al género Bacillus, productores de celulasas (Vijay y Nivedita, 2017; Alia et al., 2020) y amilasas (Shebba et al., 2017; Tsegaye et al., 2019), además de constituir agentes potenciales para el control de hongos fitopatógenos, representan una fuente para la obtención de estas enzimas, que poseen distintas aplicaciones en industrias y procesos tecnológicos, como la producción de bioetanol, detergente, papel, alimento animal en conjunto con hemicelulasas y pectinasas; así como en la industria alimenticia para la clarificación de vinos y la elaboración de jugos y cervezas (Menendez et al., 2015; Singh et al., 2016a; Singh et al., 2016b; Saini et al., 2017). En tal sentido, los aislados obtenidos en este estudio podrían tener potencial para posteriores usos tales como los descritos. Sin embargo, es importante desarrollar otros estudios de termoestabilidad y resistencia al cultivo en diferentes pH, para identificar los aislados de mayor actividad y tolerancia a temperaturas elevadas y a cambios de pH en el medio de cultivo. Por otra parte, estos aislados, tienen ventajas importantes como la de un crecimiento rápido que podría permitir ciclos de fermentación cortos, la capacidad de secretar las enzimas analizadas al medio extracelular y ser manipulados de manera segura (Pandey et al., 2000).
A partir de los resultados se logró conformar una colección de bacilos formadores de endosporas obtenidos de la rizosfera de tres cultivares de frijol y tres sitios de colecta, con 141 aislados entre los cuales el 8% fueron productores de cianuro de hidrógeno, productores de enzimas hidrolíticas como proteasas (57.7%), lipasas (19.3%), quitinasas y/o β-glucanasas (56.5%), celulasas (28.5%) y α-amilasas (33.3%).
CONCLUSIONES
La rizosfera de los cultivares de frijol común (Phaseolus vulgaris L.) Cul 156, Cuba Cueto 259-negro y Tomeguín 93 cultivados en diferentes suelos contiene bacilos formadores de endosporas con potencial biotecnológico productores de cianuro de hidrógeno y enzimas hidrolíticas (proteasas, lipasas, quitinasas y/o β-glucanasas, celulasas y α-amilasas). Constituyen candidatos potenciales para el desarrollo de productos bioplaguicidas agroecológicos, para el control de organismos patógenos en el cultivo del frijol. Además, las cepas productoras de proteasas, celulasas y amilasas, pudieran ser fuentes para la obtención de enzimas con diferentes fines industriales.















