ENFERMEDAD POR CORONAVIRUS 2 (COVID-19)
Inicios de una pandemia
El 7 de enero de 2020, el nuevo coronavirus SARS-CoV-2 (severe acute respiratory syndrome coronavirus 2) fue oficialmente reconocido por las autoridades chinas como el agente causal de una serie de casos de neumonía diagnosticados en Wuhan, China, durante el mes previo (diciembre/2019)1. La enfermedad que produce este virus ha sido nombrada, en su idioma original, Novel Coronavirus Infectious Disease 2019, de donde surge su conocido acrónimo COVID-19; fue declarada por la Organización Mundial de la Salud (OMS) como una emergencia de salud pública internacional el 30 de enero de 20202, y como una pandemia el 11 de marzo siguiente3.
El virus de la COVID-19 se replica de forma eficiente en el tracto respiratorio superior y tiene características epidemiológicas diferentes de los coronavirus humanos convencionales, que son los que producen muchos de los resfriados comunes que aparecen en las temporadas de invierno4. El inicio de sus síntomas es más lento, por lo que las personas infectadas tienen un período de incubación más prolongado (hasta 2 semanas) y, mientras permanecen asintomáticos u oligosintomáticos, mantienen su movilidad y sus actividades habituales, lo que contribuye a la propagación de la infección; que también tiene afinidad por las células del tracto respiratorio inferior, donde se continúa replicando y puede producir manifestaciones radiológicas de condensación inflamatoria sin que el paciente tenga síntomas propios de una neumonía5.
Al momento del cierre de este artículo habían en el mundo 1.840.093 casos confirmados, según el Panel COVID-19 del Centro de Ciencia e Ingeniería de Sistemas (CSSE) de la Universidad Johns Hopkins (JHU)6 y el mapa de casos de la OMS (Figura 1)7; y en Cuba, 669 casos con 18 fallecidos6,7.
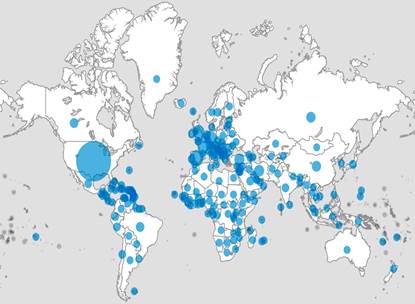
Figura 1 Mapa de casos confirmados de la Organización Mundial de la Salud. Tomado de World Health Organization. Coronavirus (COVID-19) - WHO Health Emergency Dashboard7.
Origen filogenético
Se sabe que siete especies de estos beta-coronavirus causan infecciones en humanos, cuatro provocan principalmente síntomas leves parecidos a la gripe, y las tres restantes producen enfermedades potencialmente fatales (SARS [severe acute respiratory syndrome], MERS [Middle East Respiratory Syndrome] y COVID-19)8.
El análisis evolutivo y la secuenciación genética del SARS-CoV-2 muestra más del 80% de identidad con el SARS-CoV y el 50% con el MERS-CoV; por lo tanto, la evidencia del análisis filogenético indica que el SARS-CoV-2 de la COVID-19 pertenece al género beta-coronavirus1,9,10; y el murciélago, reservorio de una amplia variedad de coronavirus, es su huésped natural, y podría transmitirse al humano a través de hospederos intermedios desconocidos, entre los que podrían estar los animales domésticos8,11,12. El contacto directo con estos hospederos intermedios o el consumo de animales salvajes pudo ser la vía principal de la transmisión interespecie del SARS-CoV-2; pero su origen y forma de transmisión reales continúan sin dilucidar12.
Transmisión
Independientemente a la alta probabilidad de origen zoonótico del SARS-CoV-2, se ha demostrado que tiene una transmisión efectiva de persona a persona, principalmente a través de secreciones respiratorias, pero también se puede aerosolizar (microgotas de Flügge) o detectar en las heces13. Huang et al14, en 16 pacientes con COVID-19 ingresados en terapia intensiva, detectaron el ARN (ácido ribonucleico) del virus en muestras de vías respiratorias inferiores (esputo o aspiración endotraqueal) en el 100% de los casos, mucosa nasal (81%), heces fecales (69%), orofaringe (63%), contenido gástrico (46%), mucosa anal (25%), conjuntiva (6,7%) y orina (6,2%). De lo que se deduce que la transmisión del virus va más allá de la vía respiratoria.
El SARS-CoV-2 puede permanecer viable hasta 3 horas (h) en forma de aerosol, y en ciertas superficies hasta 72h: monedas de cobre (4h), guantes de latex (8h), cartón (24h), ropa -incluidas las mascarillas o nasobucos- (48h) y acero inoxidable o plástico -donde se incluyen las pantallas de los dispositivos electrónicos- (48-72h)13.
La transmisión puede ocurrir en pacientes sintomáticos y asintomáticos, con tasas de infección secundaria variables; el tiempo medio de incubación, también variable, oscila entre 2-5 días (hasta 14) y el 97,5% de los casos experimenta síntomas dentro de los 11-12 días de exposición15,16.
Estudios recientes en mujeres embarazadas infectadas con COVID-19 revelan que la gravidez no implica un mayor riesgo de complicaciones o mal pronóstico en comparación con la población general, y hasta el momento no hay evidencia de transmisión vertical del virus de la madre al feto o recién nacido durante el parto o la lactancia. Actualmente, no existe clara evidencia sobre el momento óptimo del parto, ni sobre su seguridad por vía vaginal o si mediante cesárea se previene la transmisión vertical; por lo tanto, la ruta y el momento del parto deben individualizarse en función de las indicaciones obstétricas y el estado materno-fetal17-20. No obstante, tras el nacimiento, puede producirse la transmisión de la madre al recién nacido por las vías habituales; por lo que deben adoptarse las medidas más acertadas, que incluyen el aislamiento21.
Síntomas
Las manifestaciones clínicas comunes, encontradas en varios estudios, incluyen fiebre (88,7%), tos predominantemente seca (67,8%), fatiga/astenia (38,1%), tos con expectoración (33,4%), disnea (18,6%), odinofagia (13,9%) y cefalea (13,6%); además, una parte de los pacientes han manifestado síntomas gastrointestinales, como diarrea (3,8%) y vómitos (5,0%), así como rinorrea (4,8%), dolores musculares, confusión mental, anosmia y ageusia1,12,15,22. La fiebre y la tos son los síntomas dominantes. La anosmia aparece frecuentemente junto a otros síntomas bien conocidos de la COVID-19, pero entre 10-20% de los pacientes aparece de forma aislada, lo que ayudaría a identificar a enfermos hasta ese momento asintomáticos23. Son más vulnerables los ancianos y los pacientes con comorbilidades1,22,23.
Según Clerkin et al15, los informes de China revelan que la gran mayoría de los pacientes (81%) presentan síntomas leves, sin neumonía o con afectación parenquimatosa benigna. Entre los restantes, un 14% presentó síntomas graves (disnea, polipnea ≥30 respiraciones por minuto, saturación de oxígeno ≤93%, relación PaO2/FiO2 <300, con o sin aparición de infiltrados pulmonares >50% en 24-48 horas), y en un 5% se consideraron críticos (síndrome de insuficiencia respiratoria aguda o distress respiratorio [ARDS, por sus siglas en inglés], shock séptico y disfunción o fallo múltiple de órganos).
Formas clínicas
Se reconocen, en principio, tres formas clínicas principales de la enfermedad (A, B y C)4,5,24, a las que se han sumado posteriormente otras cuatro (D-G) que son resultado de la mayor gravedad de la enfermedad15,25-27:
Enfermedad respiratoria alta con síntomas leves.
Enfermedad respiratoria baja (neumonía) no complicada.
Neumonía grave que comienza con síntomas leves durante 7 a 8 días y luego progresa a un rápido deterioro con aparición de un síndrome de insuficiencia respiratoria aguda (ARDS) grave que requiere soporte vital avanzado.
Síndrome de respuesta inflamatoria sistémica: tormenta de citocinas y síndrome de activación macrofágica.
Coagulopatía/Trombogenicidad.
Shock séptico/cardiogénico.
Fallo múltiple de órganos.
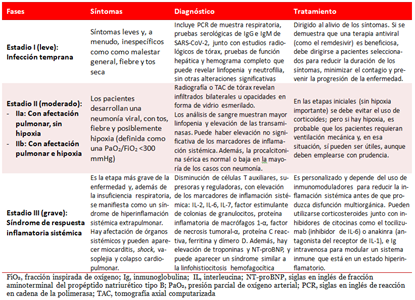
Siddiqi y Mehra26 han propuesto tres fases de la COVID-19 (Tabla 1), donde se resumen los aportes de otros varios autores28-30, que ayudan a orientar el diagnóstico y la conducta terapéutica.
MANIFESTACIONES CARDIOVASCULARES DE LA COVID-19
Aspectos generales
La enzima convertidora de angiotensina-2 (ECA-2), receptor crucial del SARS-CoV-2, también se expresa en el corazón, por lo que proporciona el enlace entre los coronavirus y el sistema cardiovascular27. La COVID-19, como la influenza estacional, causa una enfermedad leve y autolimitada en la mayoría de las personas infectadas; pero puede ser grave, sobre todo en pacientes mayores o con comorbilidades como: diabetes mellitus, enfermedad pulmonar obstructiva y renal crónicas, entre otras afecciones, donde se incluyen las enfermedades cardiovasculares5. Estas pueden volverse inestables en el contexto de la infección viral como consecuencia del desequilibrio entre el aumento de la demanda metabólica inducida por la infección y la reducción de la reserva cardíaca27.
Los pacientes con enfermedades cardiovasculares subyacentes, que son más prevalentes en adultos mayores, tienen mayor riesgo de complicaciones y muerte durante la intensa respuesta inflamatoria a la COVID-19 que las personas más jóvenes y saludables31.
Fisiopatología
Pérez22 expone un gráfico muy representativo sobre la fisiopatología de la lesión cardíaca aguda en la COVID-19, que fue publicado por Fernando de la Guía32 -al resumir la información de varias publicaciones, entre ellas las de Chen et al33 y Zheng et al34-, el cual hemos modificado para imprimirle una visión más integradora (Figura 2)8,15,27,28,31,35-39.
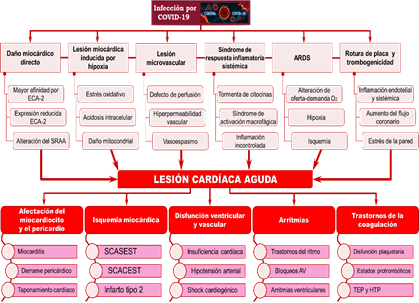
Figura 2 Mecanismos fisiopatológicos de la lesión cardíaca aguda en la COVID-19 y sus principales manifestaciones clínicas8,15,27,28,31,35-39. Modificada de @Cardio_delaGuia (Fernando de la Guía)32. ARDS, siglas en inglés de síndrome de insuficiencia respiratoria aguda; AV, aurículo-ventriculares; ECA-2, enzima convertidora de angiotensina-2; HTP, hipertensión pulmonar; SCACEST, síndrome coronario agudo con elevación del ST; SCASEST, ídem sin elevación del ST; SRAA, sistema renina-angiotensina-aldosterona; TEP, tromboembolismo pulmonar.
Aunque el mecanismo fisiopatológico exacto de la lesión miocárdica causada por COVID-19 no está totalmente esclarecido, informes previos han mostrado que en el 35% de los pacientes con infección grave por SARS-CoV, el ARN del virus fue detectado en el corazón; y como se ha demostrado que estos dos coronavirus tienen genomas altamente similares (más del 80% de identidad)8, podrían compartir iguales mecanismos de infección40, por lo que es evidente la elevada posibilidad de que el SARS-CoV-2 produzca un daño directo a los miocardiocitos8,22,35.
En el estudio de Guo et al35, los niveles plasmáticos de troponina T se correlacionaron significativamente de forma lineal con los niveles plasmáticos de proteína C reactiva de alta sensibilidad, lo que indica que la lesión miocárdica puede estar estrechamente asociada con la patogénesis inflamatoria durante el progreso de la enfermedad.
Lo cierto es que en su fisiopatología se invocan múltiples factores que engranan el mecanismo de producción de la lesión cardíaca aguda, entre los que destacan el daño miocárdico y vascular directo, la hipoxia, el síndrome de respuesta inflamatoria sistémica, la disfunción endotelial y la trombogenicidad. Todos estos factores se resumen en la figura 2.
Insuficiencia cardíaca preexistente
La disnea y la fatiga, síntomas cardinales de la insuficiencia cardíaca, son muy comunes en pacientes con COVID-19, particularmente en sus etapas más avanzadas; por lo tanto, su diagnóstico se hace más difícil en pacientes con insuficiencia cardíaca crónica. Además, tanto la COVID-19 como la insuficiencia cardíaca provocan hipoxemia, que es el mecanismo fisiopatológico básico que conduce a la muerte28,29.
Del mismo modo, los pacientes con insuficiencia cardíaca también son propensos a la descompensación hemodinámica durante el estrés de las enfermedades infecciosas graves31.
Miocarditis
Inciardi et al25 describen el caso de un paciente sin antecedentes de enfermedad cardiovascular, que ingresó por COVID-19 con disfunción significativa del ventrículo izquierdo, el cual tenía una miopericarditis aguda grave. Entre sus principales hallazgos destaca que la afectación cardíaca en la COVID-19 puede ocurrir, incluso, sin signos y síntomas de infección respiratoria.
La miocarditis viral tiene un amplio espectro en su presentación clínica, que va desde pasar inadvertida hasta la aparición de arritmias potencialmente mortales o insuficiencia cardíaca avanzada41. Produce inflamación miocárdica focal o global, con áreas de necrosis, que producen alteraciones electrocardiográficas, ecocardiográficas, y elevación de los marcadores de daño miocárdico que pueden confundirse con un síndrome coronario agudo. La patogenia de la afectación cardíaca asociada al SARS-CoV-2 puede reflejar un proceso de replicación y diseminación del virus a través de la sangre o el sistema linfático procedente del tracto respiratorio25,31; no obstante, aunque los mecanismos ultraestructurales no se conocen completamente, una posible unión a un receptor viral del miocito puede favorecer la internalización y posterior replicación de las proteínas de la cápside y el genoma viral25,42.
Insuficiencia cardíaca aguda
La miocarditis viral aguda, en este caso por el SARS-CoV-2, no es la única causa de insuficiencia cardíaca aguda -que puede llegar a ser grave-. El enorme engranaje de los mecanismos moleculares y celulares que se imbrican en la fisiopatología de la COVID-19, en sus etapas más avanzadas, explican por qué se produce la disfunción ventricular, independientemente a la afectación directa del miocardiocito por el virus. La hipoxia producida por el distress respiratorio disminuye el aporte de oxígeno al miocardio, el que -a su vez- tiene elevadas las demandas de este gas por la estimulación simpática secundaria a la infección8,15,27; por otra parte, el síndrome de respuesta inflamatoria sistémica favorece al aumento de las citosinas que tienen un conocido efecto depresor del miocardio. Además la inflamación y la estimulación simpática aumentan el riesgo de arritmias y la posibilidad de isquemia miocárdica aguda28,31,35,36,43.
Arritmias
La hipoxemia puede desencadenar fibrilación auricular, que es la arritmia más común entre las personas de edad avanzada28,43, la cual podría ser refractaria al tratamiento antes de que mejore la función pulmonar; por otra parte, la respuesta inflamatoria sistémica y los trastornos de la coagulación presentes en la COVID-19 hacen muy complejo su tratamiento anticoagulante28-30.
La taquicardia sinusal es frecuente en pacientes graves, incluso sin afectación cardíaca, por el aumento de las demandas periféricas y la estimulación simpática; la aparición de arritmias malignas está más asociada a la presencia de miocarditis, síndrome coronario agudo e insuficiencia cardíaca.
Síndrome coronario agudo
Los pacientes con cardiopatía isquémica e insuficiencia cardíaca previas tienen un mayor riesgo debido a que la respuesta inflamatoria sistémica puede desencadenar rotura o erosión de las placas de ateroma en pacientes con enfermedad coronaria subyacente o sin ella28-30,43; pues las placas no significativas, que no producen síntomas, pueden ser especialmente vulnerables por su alto contenido lipídico y la debilidad de su cápsula.
El efecto procoagulante de la inflamación sistémica puede aumentar la probabilidad de trombosis del stent, por lo que la evaluación de la función plaquetaria y su adecuado tratamiento antiagregante deben considerarse en aquellos con antecedentes de intervención coronaria percutánea27.
Según Bonow et al31, en su editorial de JAMA (Journal of the American Medical Association), estos eventos coronarios agudos podrían resultar del aumento en las demandas miocárdicas desencadenadas por la infección, y producen la lesión o el infarto de miocardio, como ocurre en el infarto tipo 244; además, las citocinas circulantes, liberadas por una respuesta inflamatoria sistémica grave, podrían conducir a la inestabilidad y ruptura de la placa aterosclerótica.
Trastornos de la coagulación y tormenta de citocinas
La respuesta a la infección viral produce un estado de hipercoagulabilidad que, unido a la inflamación de las células endoteliales, puede generar disfunción plaquetaria y predisposición a la formación de trombos que, aunque son más frecuentemente venosos, también pueden aparecer en el sistema arterial y producir infartos a cualquier nivel; así como tromboembolia e hipertensión pulmonares. La expresión máxima de este trastorno es la presencia de una coagulopatía similar al síndrome antifosfolípido o el establecimiento de una coagulación intravascular diseminada24,27.
Zhang et al45, describen el caso de un hombre de 69 años con antecedentes de hipertensión, diabetes y accidente cerebrovascular que ingresó en terapia intensiva por empeoramiento de los síntomas (ARDS con necesidad de ventilación mecánica) y se encontraron signos de isquemia bilateral en miembros inferiores y en dos dedos de la mano izquierda, así como infartos cerebrales bilaterales múltiples en la tomografía. El paciente tenía leucocitosis, trombocitopenia, tiempo de protrombina prolongado y elevación de fibrinógeno y dímero D; además posteriormente se demostró la presencia de anticuerpos anticardiolipina IgA y anticuerpos anti-β2-glucoproteína I, IgA e IgG.
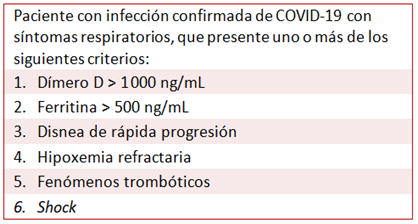
Por su parte, Gauna y Bernava46, en un artículo publicado en este número de CorSalud, plantean la existencia de una respuesta inmune trombótica asociada a la COVID-19 (RITAC) donde, lejos de la posibilidad de que aparezca en individuos inmunodeprimidos, se presenta en inmunocompetentes, debido a la aparición de un síndrome de activación macrofágica acompañado de una activación patológica de la trombina, con la consecuente producción de múltiples episodios trombóticos. Razón por la que son muy útiles las determinaciones de ferritina y dímero D. Los criterios diagnósticos de la RITAC se muestran en el recuadro 1.
El síndrome de activación macrofágica, que es una reacción patológica inflamatoria sistémica, frecuentemente fatal, -y que se puede desencadenar por enfermedades infecciosas, reumáticas y neoplásicas (Figura 3)47,48-, forma parte de la denominada tormenta de citocinas que aparece en los pacientes con COVID-19, que es un estado hiperinflamatorio que asemeja una linfohistiocitosis hemofagocítica secundaria (LHHFs), caracterizada por una liberación exagerada de citocinas que puede terminar en un fallo múltiple de órganos24,49,50. Según Mehta et al24, la LHHFs es comúnmente desencadenada por infecciones virales, aparece en 3,7-4,3% de los pacientes con sepsis y clínicamente produce fiebre persistente, citopenias e hiperferritinemia; además, en la mitad de los enfermos, provoca afectación pulmonar, incluido el ARDS.
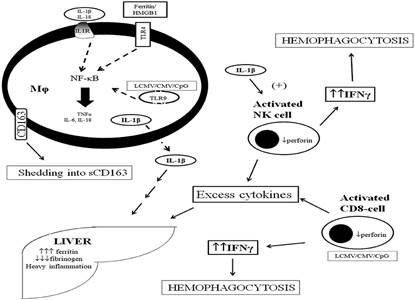
Figura 3 Conceptos actuales en la fisiopatología del síndrome de activación macrofágica en la sepsis. La sobreproducción de IL-1β se efectúa mediante la estimulación de TLR por ferritina y HMGB1, y por el efecto autocrino per se de IL-1β sobre IL-1R a nivel de los macrófagos. Esta estimulación conduce a una tormenta de citocinas y la liberación de CD163 de la membrana celular de los macrófagos. Las citocinas sobreproducidas estimulan una mayor producción de ferritina por el hígado y la disfunción hepática, mientras que IL-1β conduce a la sobreproducción de IFNγ por las células NK, lo que conduce a la hemofagocitosis. La producción excesiva de citocinas puede ocurrir de manera independiente por alteraciones en la función de las células NK y CD, lo que conduce a su sobreactivación. CMV, citomegalovirus; CpG, oligonucleótidos bacterianos; IFNγ, interferón gamma; IL, interleucina; IL-1R, receptor de IL-1; LCMV, coriomeningovirus linfocítico; Mϕ, macrófago, NF-κB, factor nuclear kappa B; NK, células natural killer; TLR, receptor tipo Toll; TNFα, factor de necrosis tumoral alfa. Tomada de Karakike E, Giamarellos-Bourboulis EJ. Front Immunol. 201948) (Licencia CC BY-NC-ND 4.0). Se mantiene el idioma original al respetar la licencia de reproducción.
Esta tormenta de citocinas unida a los trastornos de la coagulación relacionados con la trombogenicidad45, principalmente a nivel de los pequeños vasos, tiene claras implicaciones cardiovasculares que, evidentemente, repercuten en el pronóstico de los pacientes con COVID-19 (Figura 2).
Función diastólica
Yang y Jin29 plantean que el deterioro temporal de la función diastólica, detectado por ecocardiografía, puede atribuirse al síndrome de respuesta inflamatoria sistémica ante la infección viral, pues está demostrado que varias citocinas como el factor de necrosis tumoral y la familia de interleucina-6, tienen una influencia inotrópica negativa clínicamente significativa; lo que podría contribuir también a la aparición de insuficiencia cardíaca o al deterioro de una preexistente.
Cardiopatías congénitas
Aunque no hay publicaciones de pacientes con cardiopatías congénitas afectados por la COVID-19 y no se puede asegurar que tengan mayor riesgo de contagio, sí existe el consenso de que aquellos con cardiopatías congénitas complejas deben ser considerados como enfermos de alto riesgo de complicaciones y mortalidad, debido a su conocida disminución de la reserva funcional51; por eso, la prevención es primordial, y ante la presencia de síntomas o la sospecha de infección, debe priorizarse la realización de pruebas diagnósticas para garantizar las estrategias terapéuticas más oportunas52.
Procedimientos de Cardiología Intervencionista
Existe el consenso unánime de las diferentes sociedades científicas (Sociedades Española53,54 y Europea de Cardiología, American College of Cardiology’s Interventional Council55 y de la Society of Cardiovascular Angiography and Intervention55) de suspender todos los procedimientos electivos (Recuadro 2) durante la pandemia de COVID-19 y realizar solamente, bajo estrictas condiciones de protección y control, los urgentes; donde es imprescindible la adecuada utilización de los medios de protección56.
Caso muy especial es el de Cuba donde existen pocos centros que realizan este tipo de procedimientos, con un limitado número de especialistas entrenados, por lo que estos profesionales (cardiólogos y enfermeros) que laboran en las Unidades de Hemodinámica y Cardiología Intervencionista de nuestro país deben mantenerse al margen de la atención ambulatoria de pacientes sospechosos o confirmados de COVID-19; pues, si se contagian, podrían poner en riesgo al resto del personal entrenado y, en consecuencia, la adecuada atención de aquellos que -con o sin esta infección viral- presentan un síndrome coronario agudo con indicación de cateterismo cardíaco urgente.
Welt et al55 plantean claramente que se debe evitar la presencia simultánea de dos cardiólogos intervencionistas o dos equipos de trabajo con iguales habilidades en una misma área, para evitar el contagio; por lo que en muchos hospitales se han habilitado turnos especiales, con diferentes horarios, pues si alguno se infecta no se suspendería el servicio.
Todos los responsables de Unidades de Hemodinámica y Cardiología Intervencionista deben coordinar la capacitación adecuada del equipo de trabajo con el Departamento de Epidemiología y Control de Infecciones para garantizar la disponibilidad del material necesario y su apropiado uso para la protección individual y colectiva54,55; además, por precaución, a todos los pacientes que entren al recinto se les debe colocar una mascarilla quirúrgica (nasobuco) para evitar la diseminación de microgotas de Flügge potencialmente infectadas.
Se mantiene la indicación precisa de intervencionismo coronario percutáneo en pacientes con síndrome coronario agudo con elevación del segmento ST (SCACEST), o sin elevación del ST (SCASEST), pero con criterios de alto y muy alto riesgo25,57-59, especialmente cuando presenten inestabilidad hemodinámica (disfunción ventricular moderada-grave o shock cardiogénico), isquemia recurrente, alta sospecha de enfermedad de tronco coronario izquierdo o arritmias ventriculares malignas.
En este número de CorSalud se publica un trabajo donde Gómez Guindal58 expone el protocolo de atención a pacientes con síndrome coronario agudo en el Hospital de Fuerteventura (Islas Canarias, España). Este protocolo se puede extrapolar a Cuba, porque es el de un territorio insular con características similares a la mayoría de las provincias de nuestro país, que no cuentan con las posibilidades de realizar estudios hemodinámicos y procedimientos de cardiología intervencionista, y tienen que remitir sus casos a un centro de referencia.
Es muy importante conocer que puede existir lesión miocárdica aguda (infarto tipo 2 o miocarditis) en cerca del 7% de los pacientes con COVID-1944,55,58, por lo que el diagnóstico diferencial con los síndromes coronarios agudos “primarios” o tipo 1, es imprescindible para definir la conducta a seguir: en el infarto tipo 2, si el paciente tiene estabilidad hemodinámica, se debe aplazar o diferir el procedimiento invasivo.
TRATAMIENTO
Fármacos para la COVID-19
Es importante recalcar que, como en casi todas las enfermedades, el tratamiento debe ser personalizado y en concordancia con la gravedad (estadios) de la infección (Tabla 1), porque en las fases avanzadas el pronóstico es sombrío y la recuperación, escasa; por lo que su rápido reconocimiento, antes de que se instaure la disfunción multiorgánica, unido al inicio precoz del tratamiento adecuado puede lograr mejores resultados. En estos casos está indicado el uso de inmunomoduladores para reducir la inflamación sistémica26 y anticoagulantes (heparina de bajo peso molecular) en caso de manifestaciones tromboembólicas24,45,46.
En las etapas iniciales se ha difundido el uso de hidroxicloroquina y azitromicina. En este número de CorSalud se publica un importante artículo de Barja et al60, que trata sobre el riesgo de muerte súbita relacionada con el uso de estos fármacos, debido al efecto que tienen sobre el intervalo QTc. Los autores explican detalladamente cuándo suspender o mantener estos medicamentos, en base a criterios electrocardiográficos; por lo que sus indicaciones deben ser de consulta obligada para quienes se responsabilizan con el tratamiento de los pacientes con COVID-19.
Fármacos cardiovasculares
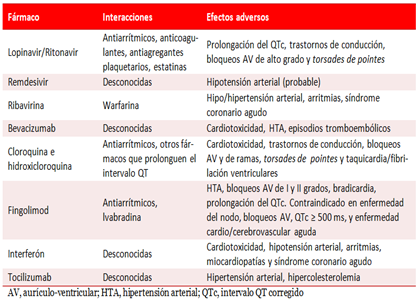
La COVID-19 tiene importante repercusión sobre los pacientes con enfermedad cardiovascular, quienes alcanzan mayor riesgo de eventos adversos, porque la propia infección se asocia a complicaciones cardiovasculares, y en su tratamiento se utilizan fármacos que pueden interactuar con los de la enfermedad cardíaca subyacente22,61,62 o tener efectos secundarios directos como la peligrosa prolongación del intervalo QT (Tabla 2)60,62.
Tabla 2 Medicamentos utilizados para la COVID-19, según sus interacciones y efectos adversos cardiovasculares. Modificada de Vetta et al. J Cardiol Cardiovasc Res. 2020;1(2):1-1262.
El SARS-CoV-2 alcanza las células humanas mediante su unión a la enzima convertidora de angiotensina-2 (ECA-2), que se encuentra en altas concentraciones en los tejidos cardíaco y pulmonar. Esta enzima tiene importantes funciones en la regulación neurohumoral, por lo que su unión con el virus puede producir alteraciones en las vías de señalización relacionadas con la ECA-2 y conllevar lesiones agudas en ambos órganos8,61.
Tal vez por eso ha existido preocupación respecto al riesgo de usar sus inhibidores (IECA) o los antagonistas de los receptores de angiotensina-2 (ARA-2), pues el aumento de la expresión de la ECA-2 inducida por estos fármacos (IECA y ARA-2) -hipotéticamente- agravaría la lesión pulmonar de los pacientes con COVID-1963; sin embargo, es todo lo contrario. Henry et al64 encontraron efectos beneficiosos de estos medicamentos en pacientes ingresados con neumonía viral, ya que IECA y ARA-2 redujeron significativamente la respuesta inflamatoria pulmonar y la liberación de citocinas causadas por la infección viral; probablemente relacionado con un aumento compensatorio de la ECA-265-67. De hecho, Kuba et al68 plantean que la regulación negativa de esta enzima, mediada por el SARS-CoV, contribuye a la gravedad de las patologías pulmonares, pues la ECA-2 es clave para reducir la gravedad del edema y la insuficiencia pulmonares agudos.
Por estas razones, hasta el momento, no existe ninguna evidencia que avale la suspensión de IECA y ARA-2 en pacientes con COVID-1935,69, y mucho menos para prevenir el contagio, o por temor a enfermar y tener mayor riesgo de complicaciones. Aunque en el estudio de Guo et al35, también citado por Madjid et al43, hubo más pacientes que tomaban estos fármacos en el grupo de troponina T elevada, su uso no se asoció con la tasa de mortalidad.
PRONÓSTICO
Factores de mal pronóstico
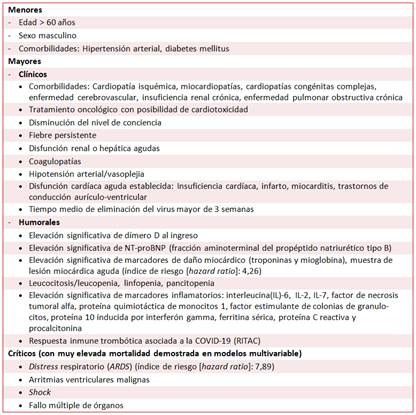
La edad mayor de 60 años, el sexo masculino y la presencia de comorbilidades (hipertensión arterial, diabetes mellitus, enfermedades cardíaca, cerebrovascular, renal crónica y pulmonar obstructiva crónica preexistentes) son los principales factores clínicos asociados a la gravedad y mortalidad de la COVID-19 (Recuadro 3)8,9,22,24-27,31-36,43,61. Aunque exista enfermedad cardíaca previa, los pacientes que no presenten afectación aguda del miocardio (troponinas normales o levemente elevadas), tienen mejor pronóstico; pues se ha demostrado que la elevación del NT-proBNP, la presencia de daño miocárdico (elevación de troponinas > 99 percentil), de distress respiratorio (ARDS) y la aparición de arritmias malignas, son factores independientes asociados de forma importante con la mortalidad8,31,35,36,43,70.
Aspectos pendientes
Muchas inferencias clínicas respecto a la evolución de los pacientes se han hecho en relación con las infecciones previas más conocidas por coronavirus (SARS-CoV y MERS-CoV)27,34,38, y todas tienen un fundamento científico establecido sobre las bases de la similitud genómica de estos con el nuevo SARS-CoV-2; además, muchas se han demostrado en los afectados por la COVID-19; pero no es menos cierto que aún quedan muchos aspectos por aclarar en relación a esta pandemia. Uno de ellos es la inmunidad, pues con las pruebas de detección de anticuerpos se logra determinar si una persona ha tenido la infección viral; si resultan positivas se pueden asegurar dos cosas: que la persona ha tenido la enfermedad y que, por lo tanto, tiene cierto grado de inmunidad; lo que es imposible de precisar es «cuánta» inmunidad se tiene y qué tiempo va a durar.
Por su parte Huang et al14, como comentamos al principio, en pacientes con COVID-19 confirmado, ingresados en terapia intensiva, encontraron que las muestras del tracto respiratorio inferior tenían mayor carga viral y una eliminación más lenta del virus, en comparación con las de las vías respiratorias superiores. Además, solo en 13 (81%) pacientes las muestras nasofaríngeas resultaron positivas para SARS-CoV-2 y en 10 (63%), las orofaríngeas; mientras que en todos los pacientes (100%) las muestras de las vías respiratorias inferiores (esputo o aspiración endotraqueal) fueron positivas.
Lo más llamativo de estos datos es que, a pesar de ser pacientes gravemente enfermos por la COVID-19, solo se confirmó la presencia del virus en la totalidad de los casos cuando las muestras se obtenían de las vías respiratorias inferiores. Estos hallazgos tienen implicaciones importantes e invitan a una reflexión: si esto ha ocurrido en pacientes con una reconocida alta carga vírica, ¿qué pasará entonces con aquellos donde la carga viral sea menor? Evidentemente muchos pacientes realmente infectados, con capacidad de contagiar, escapan al diagnóstico; y este es uno de los factores más importantes por lo que la COVID-19 ha alcanzado tales dimensiones.
Evolución cardiovascular a largo plazo
Las experiencias previas han demostrado que en los pacientes con neumonía, el aumento de la actividad inflamatoria sistémica y procoagulante puede persistir mucho después de la resolución de la infección y sus efectos clínicos se han relacionado con un mayor riesgo de enfermedad cardiovascular hasta 10 años después27,34,61; por eso Corrales-Medina et al38 plantean que es probable que los casos actualmente infectados por COVID-19 experimenten resultados similares.
El tratamiento con corticosteroides aumenta la posibilidad de eventos cardiovasculares adversos; sin embargo, los datos de seguimiento a largo plazo sobre los sobrevivientes de epidemias de virus respiratorios son escasos8,34. En cambio, Wang et al71, en un estudio con 25 sobrevivientes de SARS, encontró que el metabolismo de los lípidos permaneció alterado hasta 12 años después de la recuperación clínica, mientras que las alteraciones cardiovasculares observadas durante la hospitalización en 8 pacientes con influenza H7N9 se recuperaron totalmente en 1 año.
En realidad es imposible hacer consideraciones a largo plazo, cuando sabemos que es una enfermedad de reciente conocimiento que fue declarada como una emergencia de salud pública internacional el 30 de enero de 20202. Las inferencias actuales se basan en las infecciones previas por virus de similares características27,38,71. Estudios futuros con seguimientos prolongados pondrán en evidencia la repercusión cardiovascular real a largo plazo de la COVID-19.
Como plantea Bansal8, la gran expansión y virulencia de la COVID-19 implica que un elevado número de pacientes afectados tengan una enfermedad cardíaca preexistente o la desarrollen en el curso de la infección; pero la repercusión precisa de la coexistencia de ambas enfermedades a largo plazo aún no está bien establecida, debido a la reciente expresión de este virus en los humanos; por lo que se necesitan más investigaciones para conocer específicamente su incidencia, todo el espectro de su presentación clínica y el pronóstico de las diferentes manifestaciones cardiovasculares en estos pacientes. La repercusión aguda la vivimos día a día al atender a nuestros pacientes; la de a largo plazo, aún está por definir.