INTRODUCCIÓN
El nodo sinusal constituye el marcapasos fisiológico del corazón. Diferentes estados fisiopatológicos conducen a una reducción de su función, lo que se conoce en clínica cardiológica, como disfunción sinusal1,2; sin embargo, para la mejor comprensión de su estado de enfermedad se requiere dilucidar cómo opera el nodo sinusal en condiciones normales. Recientes avances han revolucionado nuestro conocimiento al respecto y aportan bases para futuros tratamientos.
BREVE RESEÑA HISTÓRICA
En el siglo XVIII Albrecht von Haller dio el convincente argumento de que el latido cardíaco se originaba dentro del propio corazón, sin necesitar la entrada de impulsos nerviosos, y a finales del siglo XIX Walter Gaskell observó que la señal eléctrica comenzaba en el seno atrial, se propogaba de ahí a los atrios y después a los ventrículos1. El descubrimiento del nodo sinusal (NSA) se le debe a Sir Arthur Keith y Martin Flack. Durante una expedición marítima Wenckebach le sugirió a Keith el estudio de la unión sinoauricular que él había nombrado en sus experimentos ultimus moriens. El Dr. Keith y el estudiante de medicina Martin Flack observaron en corazones humanos y de varios mamíferos una masa compacta de células musculares distintas a las del miocardio circundante que le recordó a Keith el nodo descrito por Tawara2. En 1907 realizaron la publicación oficial de sus hallazgos.
EL NODO SINUSAL
El NSA constituye el marcapasos fisiológico debido a que es el sitio de origen de la actividad eléctrica del corazón3,4, se localiza en la unión de la vena cava superior con la aurícula derecha y, en profundidad, es epicárdico (Figura 1). En el humano, el NSA es una estructura compacta, rodeada por una gran cantidad de tejido adiposo y, según un estudio reciente5, presenta una forma oblongada. Es reconocida la dificultad para su identificación macroscópica en el cadáver. Nooma et al.6 solo pudieron observarlo en 1 de 16 corazones estudiados, pero elaboraron una nueva técnica que consistió en la eliminación del epicardio del atrio derecho en la zona del sulcus terminalis combinándolo con la apertura de la vena cava superior, posterior a esto fue cepillado el tejido adiposo de esa área con agua a 40°C y un surfactante (Triton X, diluido 1:10 con agua del grifo). Lo anterior permitió ver en todas las muestras una estructura blanca que se apreciaba mejor al colocar un papel negro por detrás, en el interior del atrio derecho. La correspondencia de la estructura blanca con el NSA fue corroborada histológicamente con la tinción tricrómica de Masson.
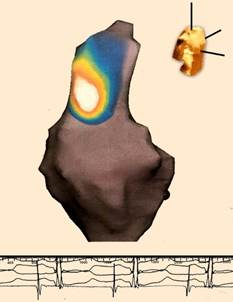
Figura 1 Mapeo del origen del impulso eléctrico en el nodo sinusal mediante un sistema de navegación EnSite (St. Jude) con catéter Array y tecnología Endocardial Solutions de no contacto (con capacidad para visualizar 3600 puntos de un solo latido).
Se obtienen asas con distintos colores donde el blanco representa el sitio de origen del latido en el nodo sinusal, ubicado en la aurícula derecha en relación estrecha con la desembocadura de la vena cava superior. El resto de los colores constituyen la secuencia de propagación del impulso en la vecindad del nodo sinusal. En la parte superior derecha de la figura se visualiza un torso que representa que la imagen cardíaca ha sido tomada en vista oblicua anterior derecha.
Irrigación sanguínea
La arteria del NSA es la responsable del aporte sanguíneo a esta estructura, tiene un origen proximal en la arteria coronaria derecha en el 55-65% de los pacientes, 25-45% en la arteria circunfleja, y de ambas en el 10%7. Clásicamente esta arteria ha sido utilizada como referencia para la localización del NSA, pero se ha demostrado que hasta en el 47,1% de los casos posee un origen retrocavo que podría hacer no útil este punto de referencia para precisar la anatomía del NSA(6. La realización reciente de estudios morfométricos plantea que el diámetro máximo promedio de la arteria del NSA en humanos es de 765,1 ± 229,1 µm y el mínimo, de 465 ± 152,7 µm, sin mostrar diferencias significativas con el NSA de cerdos, según un análisis comparativo5.
Algunos estudios anatómicos han sugerido que la verdadera irrigación del NSA parte desde su periferia, a través de una densa red arteriolar que se dicotomiza después de un número variable de ramas, las cuales terminan en una red capilar glomerular consistente en anillos capilares glomerulares pericelulares8. Existe evidencia de la falta de ramas derivadas de la arteria del NSA que hacen cuestionable el nombre con el que es designada. Lopes et al.9 afirmaron que “es la red y no la arteria del marcapaso la mayor responsable de la nutrición del nodo sinusal”.
Inervación
El NSA está densamente inervado por terminales posganglionares adrenérgicas y colinérgicas10. Esta red neural proviene de los subplexos epicárdicos dorsal (contiene el 26% de todos los ganglios del corazón) y ventral atrial derechos (contiene el 11% de los ganglios epicárdicos en el humano)11. Existe una densidad de receptores β-adrenérgicos y muscarínicos que es 3 veces mayor en el NSA que en el miocardio atrial circundante10,11. La inervación vagal se encuentra lateralizada, el nervio vago derecho tiene un efecto más pronunciado sobre el NSA a diferencia del izquierdo que ejerce su acción principalmente sobre el nodo aurículo-ventricular12.
Histología
Presenta forma de media luna con su eje largo paralelo al surco terminal, con una longitud media de 13,5 mm (rango 8 - 21,5 mm)13. Con técnicas de marcaje inmunoenzimático de la conexina 43 se ha observado que el NSA alcanza hasta 29,5 mm, lo que sugiere que los límites nodales basados solamente en la histología son insuficientes. Valores notablemente menores se encontraron mediante mensuraciones por morfometria del NSA en 10 corazones humanos que revelaron que este posee una longitud de 1,4-3 mm y un ancho de 0,4-1,6 mm(5.
Las células del NSA se denominan células P (por su aspecto relativamente pálido al microscopio electrónico), tienen núcleos únicos (algunas pueden ser multinucleadas) y discos intercalares pobremente definidos. El aspecto celular pálido también ha sido observado en perros, caballos y cerdos5,14. Estas células están empaquetadas en una densa matriz de tejido conectivo, pero hacia la periferia pueden verse entremezcladas con miocitos atriales ordinarios.
Las células P varían en tamaño, forma y propiedades electrofisiológicas y pueden ser divididas en tres clases mayores: 1) células en forma de huso elongado (de hasta 80 μm) que pueden ser multinucleadas 2) células en huso, las cuales tienen un cuerpo débilmente estriado y de menor longitud que las anteriores (hasta 40 μm) y 3) células en araña, las cuales muestran una forma irregular con extremos romos10. No se encontraron células multinucleadas en un estudio reciente que analizó aspectos morfométricos del NSA en humanos5. Evidencias actuales sugieren que el tamaño de estas células no guarda relación con la densidad de las tres corrientes principales implicadas en la actividad de marcapasos, como habían sugerido estudios previos15. Recientemente se describieron telocitos dentro del NSA, un tipo único de célula intersticial con telópodos extremadamente largos, con prolongaciones delgadas y segmentos dilatados llamados podomas16.
Separada del NSA existe un área paranodal formada por células atriales que contienen una mezcla de expresión intermedia de conexina 43 entre los miocardiocitos atriales y los del NSA, y que se dispone a lo largo de la cresta terminal, lo que contribuye a expandir el área con actividad de marcapasos. Aún más, se han descrito extensiones del NSA mayores de 2 mm hacia la vena cava superior y la cresta terminal. Las regiones más distales del NSA constituyen el tallo, el cual se encuentra fragmentado en más de la mitad de los casos, y forma agrupaciones celulares separadas que llegan hasta la entrada de la vena cava inferior que parecen contribuir al conjunto de marcapasos subsidiarios. En la periferia del NSA puede observarse el llamado efecto mosaico, caracterizado por la entremezcla de células nodales y atriales con reducción gradual en la proporción de las células del nodo a medida que se avanza hacia el tejido atrial17. La morfología de las células también cambia y adopta un aspecto transicional entre células del NSA y atriales, lo cual se conoce como efecto gradiente.
Con el decursar de los años la población de células sinusales tiende a disminuir hasta llegar a predominar la matriz de colágeno en la cual se encuentran inmersas, también se ha observado que aumentan de volumen, lo cual ocurre por hipertrofia celular18,19. La reducción del número de células P a lo largo del proceso de envejecimiento sin dudas contribuye a la prevalencia aumentada de disfunción sinusal en edades avanzadas de la vida. En algunos pacientes mayores de 80 años no son detectables células del NSA y, a pesar de ello, conservan el ritmo sinusal. Se ha postulado que son necesarias muy pocas de estas células para mantener el ritmo sinusal.
Actividad de marcapasos
No existe una correlación anatómica exacta entre el NSA compacto y su expresión funcional como marcapasos. Los primeros estudios de mapeo epicárdico demostraron una actividad compleja de marcapasos en corazones humanos, que cubría una región de 7,5 × 1,5 cm, centrada alrededor del eje largo del surco terminal. Los trabajos más recientes han confirmado el carácter multicéntrico del complejo NSA. Se plantean múltiples orígenes del impulso eléctrico y varios sitios de salida (Figura 2). Latido a latido el sitio de activación sinusal varía de 0 - 41 mm y estos hallazgos parecen sustentar la observación clínica de la alta variación en la morfología de la onda P del electrocardiograma vista en sujetos normales13. Las partes altas del NSA se asocian con mayores frecuencias de descarga y lo contrario ocurre en las porciones más bajas.
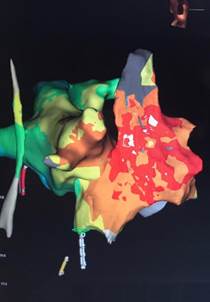
Figura 2 Mapa de activación temporal de las aurículas derecha e izquierda en 3D obtenido mediante un sistema de navegación EnSite (St. Jude) NavX PRECISION.
El mapeo fue realizado en ritmo sinusal, en vista oblicua anterior derecha. El color blanco representa el sitio de activación más precoz y guarda relación con la actividad del nodo sinusal. Obsérvese que existen varios sitios precoces que apoyan la existencia de más de un sitio de origen o de salida. Por orden de precocidad le sigue el color rojo que constituye la despolarización de la aurícula derecha en su zona lateral y crista terminalis. Le sigue el color naranja, verde, azul y por último, los tonos violetas, que le dan un sentido secuencial a la propagación del impulso desde la aurícula derecha a la izquierda.
Teoría de los dos relojes
Dos mecanismos distintos que coexisten al mismo tiempo son los responsables de la actividad de marcapasos en el NSA. El reloj de membrana (también llamado de voltaje) y el reloj de calcio17 (Figura 3). Los elementos moleculares implicados en el funcionamiento de ambos relojes se encuentran en microdominios de tipo caveolas, ricas en caveolina-3, y que contienen una subpoblación de balsas lipídicas, o pueden estar en un sistema rudimentario de túbulos T que se encuentran en íntima relación con compartimientos subcelulares abundantes en canales de rianodina tipo 2 (RyR2), que dentro del NSA solo se han observado en células que actúan como marcapasos subsidiarios, este sistema de túbulos T funcionaría como un supereje de calcio20.
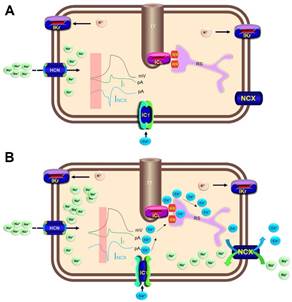
Figura 3 Mecanismos de producción de la actividad automática normal en el nodo sinusal a través de la interacción de los relojes de calcio (Ca2+) y de membrana. A. Refleja los primeros momentos de la pendiente de ascenso de la fase 4 del potencial de acción, y los gráficos de densidad de corriente If y NCX (señalado por el rectángulo sombreado). Obsérvese el incremento progresivo de la corriente If portada por iones sodio que penetran a través de los canales HCN (izquierda de la figura), lo que da lugar a una despolarización progresiva que no es suficiente para alcanzar el umbral de disparo (reloj de membrana). B. El rectángulo sombreado destaca la aceleración diastólica tardía que se manifiesta al final de la fase 4 del potencial de acción y que permite que se alcance el umbral de disparo. Durante este período de tiempo ocurre la entrada de iones Ca2+ por los canales tipos T que inducen la ocurrencia de episodios de liberación local de Ca2+ desde el RS (chispazos de Ca2+) a través de canales RR tipo 2 (reloj de Ca2+). Dicho Ca2+ se intercambia por iones sodio a través de canales NCX, lo que potencia poderosamente el régimen de despolarización de fase 4. HCN, canales activados por hiperpolarización con compuertas moduladas por nucleótidos cíclicos; ICL, canales lentos de Ca2+; ICT, canales transitorios de Ca2+; If, corriente If; IKr, canales de potasio (K) con rectificación tardía y cinética rápida de inactivación; mV, milivoltios; NCX, intercambiador sodio(Na)-Ca2+; pA, picoamperios; RR, canales de rianodina tipo 2; RS, retículo sarcoplasmático; TT, túbulos T.
El reloj de membrana
El término reloj de membrana se refiere a las corrientes que más contribuyen a la despolarización espontánea temprana en las células del NSA. Estas son: a) corriente If , b) el rectificador tardío (IKr) con su cinética rápida de inactivación y c) la ausencia del rectificador anómalo o interior (IK1) en el NSA.
Papel de If
La corriente If es portada por los canales HCN (hyperpolarization activated, cyclic nucleotide gated) localizados en la membrana plasmática. Son canales catiónicos no específicos, de baja conductancia, de los cuales se han descrito 4 isoformas. En humanos se ha encontrado que los canales HCN1, HCN2 y HCN4 se expresan en alta densidad en el NSA21. El potencial de inversión de If ocurre a -20 mV, perdiéndose la conductancia a potenciales más positivos con recuperación de esta a potenciales hiperpolarizados (finales de la fase 3). Los HCN son permeables a los iones sodio y potasio con amplio predominio del primero (proporción 4:1), lo cual contribuye a la despolarización de las células sinusales.
Dos propiedades biofísicas de HCN son verdaderamente intrigantes: la primera consiste en la falta de selectividad al potasio, a pesar de contar con todos los aminoácidos esenciales para cumplir esta función; la segunda, es que la polaridad de la compuerta de voltaje esta invertida, lo que provoca un efecto contrario a lo que sucede en la mayoría de los canales regulados por compuerta de voltaje: la despolarización causa el cierre de la compuerta mientras que la hiperpolarización produce su apertura22.
If juega un importante papel en la disminución de la frecuencia cardíaca observada con el envejecimiento. Durante esta fase de la vida existe capacidad de respuesta ante la estimulación simpática, pero la frecuencia cardíaca máxima del corazón se encuentra disminuida, esto se atribuye en parte a un desplazamiento hacia la izquierda de la relación de Boltzmann (Eje X: voltaje de membrana - Eje Y: apertura de compuertas) debido a una pérdida de la sensibilidad al AMPc (monofosfato de adenosina cíclico) que se piensa esté relacionado a una proteína similar a Trip8b (proteína que regula a los canales HCN1 en el cerebro)23. La administración extrínseca de AMPc puede revertir estos efectos. A pesar de conocerse que If juega un papel en el aumento de la frecuencia cardíaca tras la estimulación simpática y que ciertas mutaciones en los canales HCN4 dan lugar a disfunción sinusal, aún no está del todo claro la interrelación entre HCN4 y el sistema nervioso autónomo. Kozasa et al.24 estudiaron ratones manipulados genéticamente con una nueva mutación que induce ganancia de función de los canales HCN4, con posibilidad de reducción de los niveles de expresión de 0 a -3 veces respecto a ratones con genotipo salvaje, y observaron que la sobreexpresión de HCN4 atenúa la bradicardia inducida por estimulación vagal cervical, pero solo en presencia de estimulación β-adrenérgica, lo que sugiere que los canales HCN4 atenúan la respuesta vagal del NSA. A pesar de que If es una corriente crítica en la actividad de marcapasos se ha demostrado que algunas células automáticas de la región intercava del conejo, que carecen de expresión de If, pueden conservar su capacidad de despolarización espontánea; en estos casos el reloj de calcio parece tener una mayor contribución15.
Actualmente se reconocen, al menos, tres aplicaciones prácticas respecto a If25:
La introducción en la práctica clínica de la ivabradina, un bloqueador selectivo de If, aprobado para la reducción de la frecuencia cardíaca en la cardiopatía isquémica y la insuficiencia cardíaca, sin efecto en la contractilidad y el dromotropismo.
El descubrimiento de mutaciones en HCN4, principalmente con pérdida de función que conducen a un fenotipo de bradicardia, y la descripción de taquiarritmias asociadas a la única mutación con ganancia de función descrita hasta el momento.
El desarrollo de marcapasos biológicos que pretenden sustituir el uso de los electrónicos. Los resultados en este campo demuestran que If puede transferir su capacidad de marcapasos a células silentes cuando es implantada in situ por métodos genéticos o celulares, como por ejemplo vectores virales.
Papel de IKr
El papel que juega IKr es el de repolarizar al potencial de acción1 lo que permite que If se manifieste25, pero esto -necesariamente- tiene que acompañarse de la ausencia de la corriente IK1, cuya función principal es la estabilización del potencial de membrana. Monfredi et al.15 describieron una nueva relación entre If e IK (rectificador tardío) en células marcapasos de la región intercava del conejo, caracterizada por mayores densidades de If cuando existe mayor capacidad repolarizante por parte de IK, lo cual garantiza el aumento del automatismo.
Papel de IK1
Debido a la falta de IK1 en el NSA su potencial es lábil, lo cual contribuye significativamente a la despolarización temprana de la fase 4. Sin embargo, estudios recientes afirman que la presencia de IK1 es determinante en la ignición del potencial de acción en células automáticas, lo que cambia radicalmente algunos puntos de la teoría del reloj de membrana. Sun et al.26 demostraron que IK1 puede promover automatismo en miocardiocitos ventriculares adultos mediante regulación a la alta de If, y observaron que es suficiente la actuación de IK1 e If para inducir oscilaciones rítmicas de marcapasos, si estas se encuentran en las proporciones de densidad apropiadas en células no excitables de ratón; y llamaron a este efecto «activación de If inducida por IK1». Por su parte, Chen et al.27 lograron inducir actividad automática cuando se conseguían ciertas proporciones de HCN2 e IK en un modelo de células humanas embrionarias de riñón utilizadas como sistema de expresión heterólogo. Estos autores concluyeron que existe una dinámica muy exacta de interacción entre estas dos corrientes y que IK1 es necesaria para generar actividad automática, incluso para hacer modificaciones de la frecuencia de disparo de las células marcapasos, y extrapolaron sus hallazgos al NSA, pues afirman que en ese tejido el mecanismo funciona a conductancias muy bajas de IK1.
También se ha informado que la corriente de fondo de sodio (INa,B) mediada por canales catiónicos no selectivos, cuya entidad molecular específica aún no ha sido descubierta, podría contribuir a la actividad de marcapasos en células del NSA y el nodo aurículo-ventricular; su conductancia, medida por primera vez recientemente, mostró valores de 3,2 ± 1,2 picosiemens28.
El reloj de calcio
Se creía que toda la actividad automática podía explicarse por el reloj de membrana, pero se ha comprobado que este opera en encarrilamiento mutuo con el reloj de calcio. Se ha demostrado que desde el retículo sarcoplásmico se liberan de manera estocástica, espontánea, repetida y sincrónica, iones de calcio que funcionan como pulsos despolarizantes breves conocidos como chispazos de calcio o liberación local de calcio. Este escape se produce a través de canales de rianodina tipo 2 e incrementa su frecuencia en respuesta a la corriente que aportan los canales transitorios de calcio (ICaT) de la membrana celular, mediante el mecanismo de liberación de calcio inducida por calcio29. La máxima conductancia a este catión, mediada por ICaT, se alcanza en el último tercio de la fase 4, las chispas de calcio que inducen, generan una corriente subsarcolemal que estimula al intercambiador Na/Ca (NCX) a trabajar en el sentido interior. NCX extruye el calcio que se fuga desde el retículo sarcoplásmico y a cambio introduce iones de sodio que, en adición al aportado por If, produce la aceleración final de la pendiente de fase 4, lo cual permite alcanzar el potencial de disparo (Figura 3B).
El carácter robusto de este sistema combinado de relojes quedó firmemente comprobado con el uso del nuevo inhibidor selectivo de NCX, ORM-10962 y su combinación con el bien conocido inhibidor de If, la ivabradina30. Los autores demostraron que el bloqueo individual de If o NCX no produjo en sus modelos bradicardia grave ni inestabilidad, ya que cada una de esas corrientes compensa el déficit de la otra y hace que el NSA posea una fuerte capacidad de despolarización. Este alto factor de seguridad garantiza la estabilidad de la función de marcapasos. Sin embargo, Yue et al.31 con el uso de un modelo murino transgénico, deficiente (knockout) para el gen NCX-1 (intercambiador de sodio-calcio cardíaco), observaron que existía ausencia de onda P en su electrocardiograma y falta de despolarización atrial demostrada mediante electrogramas intracavitarios. Además, concluyeron que la ausencia de expresión de NCX-1 deshabilita la capacidad del reloj de calcio de despolarizar la membrana, y que If era incapaz de producir despolarizaciones espontáneas en células aisladas del NSA, aunque en el NSA intacto si se generaban disparos intermitentes del potencial de acción.
Sincronía celular
Las células del NSA se encuentran agrupadas en paquetes que poseen diferentes frecuencias de descarga; sin embargo, existe una frecuencia rectora debido a un mecanismo de encarrilamiento cuyas bases mecanicistas no han sido completamente dilucidadas. Hay fuertes dudas de que esta sincronía pueda atribuirse completamente al acoplamiento intercelular mediado por conexinas, ya que solo se han observado escasos niveles de expresión de la conexina 45 (isoforma predominante) en la región central del NSA, mientras que las otras se expresan solo en la periferia (conexina 40, 43, y 45)32, por lo que últimamente se ha desviado la atención a los desmosomas que están abundantemente expresados y no parecen jugar el mismo rol que en los miocitos ventriculares.
En modelos de ratones con pérdida de función de la desmoplaquina (esencial para el ensamblaje del desmosoma) se desarrolla un fenotipo primario que manifiesta un incremento en el número de pausas sinusales en reposo y cambios en el sitio de activación primario dentro del NSA a lo largo de varios latidos, y que se acompaña de variaciones en la morfología de la onda P33. El aislamiento de las células del NSA permite observar tres tipos de comportamiento celular clasificados por Kim et al.34, como rítmico, disrítmico y latente. En su trabajo, las células rítmicas presentaban automatismo bien acoplado en tiempo y espacio a los episodios de liberación local de calcio desde el retículo sarcoplasmático, mientras que las células disrítmicas y latentes presentaban desacoplamiento parcial o total en el reloj de calcio. La estimulación β-adrenérgica recluta a ambos tipos de células para que disparen rítmicamente a través de una liberación local de calcio eficaz, lo que trae consigo la sincronía de los dos relojes. No se conoce si estas células se agrupan en diferentes conglomerados o sin son responsables de determinados rangos de frecuencia cardíaca, pero podrían constituir el mecanismo que da lugar a la localización cambiante del marcapaso dentro del NSA20.
Tsutsui et al.35 también encontraron células del NSA sin actividad automática en humanos y observaron que hasta el 50% de ellas comenzaban a descargar tras exponerse al β-agonista isoprenalina. Estas células se encontraban más despolarizadas y presentaban liberación de calcio local desacoplada del reloj de membrana.
Conducción nodal y acoplamiento fuente-sumidero
El sentido anterógrado que posee la propagación del impulso eléctrico en el NSA está determinado por el efecto mosaico, la interdigitación de las células nodales con los miocitos atriales de trabajo y el efecto de gradiente17. La forma en que se propaga el estímulo eléctrico desde el NSA hasta los miocitos atriales circundantes es compleja. Se ha propuesto que esta comunicación podría establecerse a través de barreras funcionales, comunicación estructural independiente a vías especializadas de conducción y verdaderas vías de conducción especializadas. Estudios recientes, que han utilizado mapeo óptico, han demostrado vías de salida a nivel superior, medio e inferior, que se correlacionan con los únicos sitios donde no existe aislamiento por tejido conectivo y grasa en estudios histológicos36. Hasta 5 vías de salida han sido bien documentadas con el empleo de diversas técnicas37. Mitrofanova et al.16) han sugerido que los telocitos podrían contribuir también a la conducción del impulso.
Llama la atención que la gran masa de miocitos atriales que exhiben potenciales de reposo en -85 mV no induzcan, por influencia electrotónica, hiperpolarización de las células del NSA (potencial de reposo en -60 mV); y que el desajuste fuente-sumidero (source-sink mistmach) entre el NSA (fuente) y los miocardiocitos atriales (sumidero) no produzca un fenómeno de disipación de cargas que haga imposible el alcance del potencial de acción atrial hasta su valor umbral. Estas posibles situaciones parecen ser prevenidas por aislamiento funcional y estructural en la forma de fibrosis, la cual confiere un alto grado de confinación eléctrica y mecánica17. Las vías especializadas de salida desde el NSA, al poseer unas velocidades de conducción tan lentas -debido a los bajos niveles de expresión de conexina 43-, traen como consecuencia acumulación de cargas en cantidad suficiente para excitar a los miocitos atriales36. Existen evidencias recientes de que la disposición arquitectónica existente dentro del NSA es un fuerte determinante de su biorritmicidad38.
En la actualidad se considera que el acoplamiento entre las células del NSA y los miocitos atriales es crucial para establecer el encarrilamiento mutuo que se establece entre las diferentes agrupaciones celulares dentro del NSA.
Otro tema importante en vías de esclarecimiento lo constituye el firme comportamiento del NSA frente a condiciones adversas. Li et al.39 determinaron, con el uso de mapeo óptico infrarrojo, reconstrucción histológica 3D y mapeo molecular en corazones humanos explantados, que el NSA protege su funcionamiento tras la administración de adenosina (estímulo usado para estresar su función), al desplazar su marcapasos líder desde la región central hacia sitios superiores o inferiores, y cambiar el sitio de salida del impulso. Las variaciones en el sitio de disparo dentro del NSA también se producen en respuesta a la estimulación simpática (desplaza el marcapasos líder hacia la cabeza del NSA) o vagal (favorece el desplazamiento hacia sitios inferiores con menor frecuencia de descarga)10. Desde el punto de vista molecular se encontró heterogeneidad en la sensibilidad a la adenosina determinada por diferentes niveles de expresión de las proteínas A1R (receptor A1 de adenosina) y GIRK (canal de potasio rectificador interior acoplado a proteína G que determina a la corriente IK-Ado), lo cual sería la base de tal comportamiento. Frente a la supresión por sobrestimulación atrial o fibrilación auricular, la protección del NSA ocurrió mediante bloqueo de entrada en sus diferentes vías de conducción. Las evidencias mostradas por este estudio sugieren que los mecanismos de seguridad contra fallos, se basan principalmente en modificaciones del automatismo o la conducción, o ambas; es decir, actuación de marcapasos redundantes y cambios en las vías de conducción.
EPÍLOGO
Se han resumido y presentado las más novedosas evidencias sobre la irrigación sanguínea del nodo sinusal, la génesis del automatismo -explicada por la teoría de los dos relojes, la importancia de la sincronía intercelular, la conducción eléctrica y el acoplamiento eléctrico entre las células del NSA y los miocitos atriales.














