INTRODUCCIÓN
Uno de los objetivos fundamentales en el enfoque inicial del paciente crítico es la valoración y la manipulación de los sistemas cardiovascular y respiratorio, para asegurar un óptimo balance entre oferta y demanda tisular de oxígeno y sustratos metabólicos esenciales1. En este sentido, la monitorización hemodinámica, resulta imprescindible para lograr una terapia hídrica y un soporte vasopresor e inotrópico racionales, dirigidos a metas terapéuticas tempranas. Si bien determinar la demanda es una acción necesaria, esta monitorización también permite detectar los excesos de hidratación, que igualmente generan resultados negativos en el paciente1.
La monitorización hemodinámica ideal debería ser poco invasiva, fiable, precisa, fácil de realizar, continua y a pie de cama. En la actualidad, todavía no se dispone de un sistema que reúna todas estas características, pero los avances tecnológicos desarrollados en los últimos años permiten disponer de «nuevos parámetros» que exploran los aspectos más importantes de la hemodinámica, como son el nivel de precarga, su dependencia, la función ventricular o la valoración de los objetivos de la reanimación hemodinámica. Por otro lado, existe nueva tecnología que permite obtener muchos de ellos de manera menos invasiva, al igual que los viejos parámetros, incorporados a la práctica clínica1.
Probablemente debido a los costes, las exigencias técnicas, la necesidad de entrenamiento y las condiciones médicas requeridas para el uso apropiado e interpretación correcta de los métodos dinámicos, la mayoría de los médicos todavía emplean los parámetros estáticos como la presión venosa central (PVC) para guiar la terapia con volumen2,3. La práctica usual es la monitorización de parámetros hemodinámicos simples como frecuencia cardíaca, presión arterial (PA), PVC, índice de shock y presión de pulso (PP)2,3.
El presente trabajo tiene como objetivo describir el sustento fisiológico del monitoreo hemodinámico y los medios para su determinación.
MÉTODO
Se realizó una revisión narrativa de la literatura mediante los artículos recuperados en las bases de datos Scopus, SciELO, PubMed, Lilacs, BASE y Redib, en el período comprendido entre noviembre de 2018 y febrero de 2019.
Se emplearon filtros para la selección de artículos en los idiomas inglés y español, con los términos “hemodinámica”, “monitoreo hemodinámico”, “variabilidad de la presión de pulso”, “monitoreo hemodinámico invasivo”, “monitoreo hemodinámico mínimamente invasivo” y “monitoreo hemodinámico no invasivo”, así como sus traducciones al inglés. Se seleccionaron los artículos publicados entre 2016 y 2020 que cumplieron los criterios de validez: tratar la base fisiológica del monitoreo hemodinámico y las técnicas para su realización. Y se agregaron otros, fuera de ese marco de tiempo, debido a su importancia para esta revisión, con un porciento de actualización de 86,49%.
FUNDAMENTOS FISIOLÓGICOS DEL MONITOREO HEMODINÁMICO
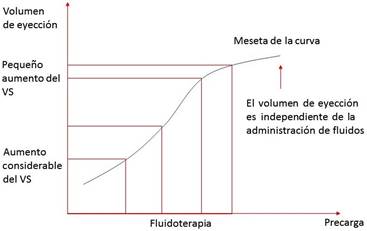
La base para usar la PVC y la presión en cuña pulmonar para guiar el uso de los líquidos viene del dogma equivocado que estos parámetros estáticos reflejan el volumen intravascular; específicamente, se cree en general que pacientes con baja PVC o presión en cuña pulmonar están hipovolémicos, mientras que valores altos reflejan sobrecarga de volumen1-3. Sin embargo, debido a que los pacientes críticos tienen cambios en el tono vasomotor, presión intratorácica, alteraciones de la distensibilidad y en la geometría de los ventrículos, hay una pobre relación entre estos parámetros hemodinámicos y los volúmenes telediastólicos de ambos ventrículos1-3; pues puede que estos volúmenes no reflejen la posición del paciente sobre la curva de Frank-Starling (Figura 1) y, por lo tanto, su dependencia de precarga. La PVC y la presión en cuña pulmonar son malos predictores de respuesta a volumen en pacientes críticamente enfermos en muchos escenarios1.
Fundamentalmente, la única razón para administrar líquidos es incrementar el volumen sistólico (VS) y el gasto cardíaco (GC); si el paciente responde, se califica como «respondedor a volumen o dependiente de precarga»; es decir, se encuentra en la porción ascendente de la curva de Frank-Starling. Si el aporte de volumen no incrementa estos parámetros en más de un 15% del basal, será «no respondedor a volumen»; es decir, se encuentra en la porción plana de la curva de función ventricular y la terapia puede ser perjudicial1-3.
En pacientes hipovolémicos el aumento del volumen sanguíneo circulante, después de la infusión intravena de fluidos, estimula cambios adaptativos cardiovasculares para incrementar el retorno venoso y el GC, según la ley de Frank-Starling. Este incremento del GC activa mecanismos cardiovasculares de regulación que implican modificaciones en los parámetros hemodinámicos, donde la infusión de volumen causa un descenso de la frecuencia cardíaca, e incrementos de la PA y la PVC3,4.
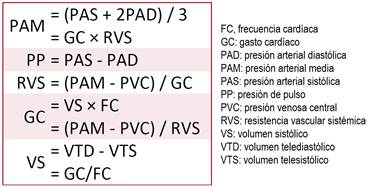
Un objetivo terapéutico esencial en los pacientes que requieren fluidos endovenosos es conseguir una perfusión tisular aceptable. Como la PA media es un indicador de la presión de perfusión tisular, que garantiza el flujo de sangre, y la PP se relaciona con el VS, ambos parámetros -que son medidas indirectas del flujo de sangre y la perfusión tisular- se relacionan directamente con el GC (Figura 2), por lo que son esenciales en la evaluación hemodinámica de los pacientes hipovolémicos3.
La PA media, por su parte, es compatible con el concepto de presión de perfusión de los sistemas orgánicos y, mediante ella se pueden obtener medidas más exactas de la verdadera PP de estos sistemas: la presión de perfusión cerebral es la resultante de la PA media menos la presión intracraneal, y la de los órganos del abdomen resulta de la resta de la PA media y la presión intraabdominal5.
En la actualidad se ha desarrollado una nueva tecnología capaz de proporcionar mediciones latido a latido del VS del ventrículo izquierdo, mediante la medición invasiva de la PP arterial a través del uso de algoritmos y del análisis del contorno del pulso que muestra las variaciones en el volumen latido (en porcentaje) como el rango de diferencia entre la presión sistólica máxima y mínima, comparada con la presión sistólica promedio en una ventana de tiempo de 30 segundos6.
El monitoreo actual parte de la premisa que si el ventrículo derecho responde a la precarga, entonces resultarán grandes variaciones en el GC derecho y, en consecuencia, del izquierdo tras la administración de volumen. Pero a medida que las dimensiones diastólicas ventriculares aumentan, el corazón responde menos a la precarga; dicho de otra forma, al dilatarse progresivamente los ventrículos, menor será la respuesta que tienen al volumen, a pesar de la hipovolemia. Otro error en relación a la presión de la aurícula derecha es asumir que la PVC refleja el volumen telediastólico del ventrículo derecho7.
Hoy en día, por su precisión diagnóstica, los parámetros funcionales o dinámicos son considerados el estándar en la valoración de respuesta al volumen y para guiar el uso racional de los líquidos en cuidados intensivos. Dentro de estos tenemos: variabilidad de la PP y del VS, prueba de oclusión tele-espiratoria, prueba de variación sistólica respiratoria -desafortunadamente pocos pacientes en estado crítico pueden realizar este tipo de esfuerzo respiratorio espontáneo8- y levantamiento pasivo de las piernas (LPP)9,10.
Adicional a las mediciones automatizadas de la variabilidad de la PP, los métodos de análisis del contorno del pulso para la determinación continua del GC han permitido la medición de la variabilidad del VS, que es el porcentaje de cambio entre el VS máximo y mínimo, dividido por su promedio durante un período de 30 segundos. Este parámetro funcional también es uno de los más estudiados que predice fuertemente la respuesta al volumen, su punto de corte aceptado es >10-12%9.
Consideraciones sobre la reserva de precarga en la ventilación pulmonar selectiva
Puesto que la variación respirofásica del VS y la PP es un fenómeno precarga-dependiente (si se asume que otros determinantes del rendimiento ventricular, como la contractilidad, permanecen invariables), cualquier alteración significativa debe recaer sobre la precarga ventricular (entendida, en este contexto, como la relación presión-volumen de fin de diástole) o, mejor dicho, en una limitación de la reserva de precarga, que es la capacidad de reclutamiento de volumen telediastólico con funcionamiento ventricular constante o no11. Existen tres factores que pueden alterar estas variables:
El cortocircuito (shunt): es conocido el efecto que la ventilación unipulmonar a presión positiva ejerce sobre la redistribución del flujo sanguíneo en ambos pulmones, influenciado por otros factores mecánicos como posición declive, parálisis muscular, desviación mediastínica y presión intraabdominal; así como la presencia previo de desviación o cortocircuito por la enfermedad preexistente. Sin embargo, la frase «este flujo de sangre no contribuye en la generación de la variación cíclica de la PP» es difícil de interpretar, en sí misma y en relación con la precarga ventricular11,12.
Disminución del volumen corriente y presiones transpulmonares: esta situación es probable siempre y cuando lo primero esté acompañado de una disminución proporcional de las presiones intratorácicas. Sin embargo, durante la ventilación unipulmonar las presiones circundantes podrían hallarse anormalmente aumentadas, por los efectos compresivos antes mencionados, lo que produce una disminución de la distensibilidad pulmonar11,12.
La transmisión de las presiones pleurales hacia la atmósfera: este tercer mecanismo propuesto requiere también una mayor aclaración, ya que en el caso de toracotomía con exposición de la cavidad pleural, la presión extrínseca (atmosférica) será menor que la que se genera durante la toracoscopia, donde tiene un efecto más limitante sobre la precarga11,12.
En definitiva, durante la ventilación a presión positiva y especialmente en la modalidad unipulmonar, el sistema cardiopulmonar se torna menos distensible, por lo que produce una disminución global de sus volúmenes y capacidades, entre ellas la reserva de precarga, reflejada en la disminución de las variabilidades del VS y la PP11-13. En este sentido, la primera y todos sus parámetros dinámicos subrogados, son marcadores de precarga en una visión tiempo-dependiente, no esencialmente diferentes de las variables hemodinámicas comúnmente llamadas «estáticas» (en el sentido de que estas últimas representan el valor instantáneo de su homólogo «dinámico»)6. Por ello, el empleo de la variabilidad de la PP debería, en principio, ser extendido a la interpretación y tratamiento de todos los determinantes de la precarga cardíaca, no solamente el volumen sanguíneo y la fluidoterapia11,12.
La técnica de expansión de volumen constituye la terapia de primera línea en contextos de inestabilidad hemodinámica por su contracción; pero solo un 50% de los pacientes responde al aporte de fluidos con un aumento del VS. Además, la expansión de la volemia puede producir efectos deletéreos pulmonares secundarios al aumento de agua extravascular, por lo que es importante la implementación de parámetros confiables que identifiquen a los pacientes respondedores al aporte de volumen14.
Por otra parte, también resulta fundamental el dominio de los conceptos fisiológicos relacionados con la precarga y su dependencia, así como los parámetros predictores, tanto en ventilación mecánica como en respiración espontánea, que pueden presentar las siguientes limitaciones14:
Necesidad de ventilación mecánica controlada, sin la presencia de actividad respiratoria espontánea en el paciente.
Arritmias cardíacas o extrasístoles frecuentes que interfieren en el cálculo y su análisis.
El paciente debe estar ventilado con volúmenes corrientes > 8 ml/kg de peso ideal, de lo contrario, la sensibilidad de estos parámetros sería menor de lo esperado.
Aunque un paciente responda adecuadamente al aporte de volumen, no significa que lo requiera.
MÉTODOS PARA EL MONITOREO HEMODINÁMICO
Se dividen en tres categorías según el estrés que ejercen sobre el organismo. Pueden ser invasivos o no, y mínimamente invasivos.
Catéter de arteria pulmonar (CAP) o de Swan-Ganz
Desde 1953 hay referencias sobre el uso de un catéter guiado con un balón distal para la cateterización cardíaca y pulmonar. Sin embargo, fueron los doctores Swan y Ganz los que, en 1970, introdujeron los catéteres de flotación pulmonar (balloon flotation catheters) para su uso a pie de cama. Desde entonces, la monitorización hemodinámica ha avanzado de gran manera, con el CAP como referente en todo momento, aunque con tendencia a la aparición de nuevos métodos de monitorización menos invasivos, que intentan obtener una información hemodinámica avanzada y reducir el riesgo de las técnicas invasivas como es la colocación del CAP15.
En la actualidad existen distintos tipos y modelos de este catéter, que han incorporado cada vez una tecnología más avanzada, lo cual permite obtener una información más precisa que ayuda al clínico a tomar las decisiones terapéuticas. El CAP nos proporciona una monitorización hemodinámica avanzada que incluye: función cardíaca (mide el GC), oximetría venosa mixta (saturación venosa de oxígeno) y presiones en distintos niveles (aurícula y ventrículo derechos, arteria pulmonar y presión de enclavamiento del capilar pulmonar), además de evaluar la respuesta ante actuaciones terapéuticas como la infusión de líquidos o la administración de fármacos16.
Con los nuevos modelos de CAP volumétricos y el monitor Vigilance II, se puede obtener información continua del GC, la fracción de eyección y el volumen telediastólico del ventrículo derecho, gracias al filamento térmico de 10 cm que genera pulsos de baja energía calórica que se transmiten a la sangre y producen cambios de temperatura, registrados por el termistor, que se encuentra localizado en la arteria pulmonar. La integración de todos estos parámetros hemodinámicos y oximétricos permite conocer de forma continua el equilibrio entre el aporte y el consumo de oxígeno16.
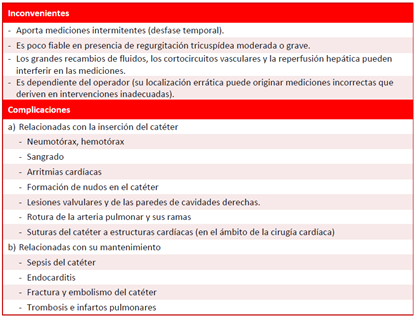
Aunque las complicaciones relacionadas con el CAP son infrecuentes, pueden ser potencialmente graves, lo que apoya aquellos estudios que afirman que la monitorización con CAP no se asocia a mejores resultados que cuando se prescinde del catéter. No obstante, según algunos autores17,18, continúa siendo el patrón de referencia de la monitorización hemodinámica; por el contrario, otros consideran16,19 que -debido a sus inconvenientes y complicaciones (Recuadro), aunque infrecuentes- su uso como «referencia» en la práctica clínica ha disminuido considerablemente. Probablemente su uso más extendido es la medición directa de las presiones arteriales pulmonares, sobre todo en pacientes con hipertensión pulmonar y porto-pulmonar18,20.
Según la experiencia de los autores, esta técnica puede quedar en desuso; sin embargo, su comprensión sienta las bases del conocimiento del monitoreo hemodinámico y permite apuntar a un futuro más eficiente.
Sistema PiCCO
El sistema PiCCO® (PiCCO System, PULSION Medical Systems AG, Munich, Alemania) es un monitor que utiliza la termodilución transpulmonar para medir el GC. Requiere únicamente una línea arterial y otra venosa, las cuales son necesarias en la mayoría de pacientes críticos. Proporciona información sobre flujos sanguíneos y volúmenes intravasculares.
Se conforma como una variante del principio de termodilución del CAP que se generalizó en la práctica clínica, como una evolución del doble marcador, a fines de la década de los noventa. Este procedimiento necesita de un catéter venoso central convencional al que se le conecta un sensor con capacidad de medir la temperatura de la solución inyectada, y un catéter arterial femoral o axilar que, además de facilitar la medición de la PA, está dotado de un sensor de temperatura en su extremo distal14.
La inyección venosa central de suero frío causa cambios de temperatura en la sangre, que son medidas por el termistor arterial, con lo que se obtiene el GC a través de una ecuación modificada de la de Stewart-Hamilton. La termodilución transpulmonar con el sistema PiCCO ha mostrado, desde su implementación en la práctica clínica, una positiva correlación con diversos sistemas de monitorización utilizados a la cabecera del paciente. Sus resultados resultan favorables al compararlos con los del CAP, incluso en contextos de cambios hemodinámicos rápidos14.
Sistema LiDCO plus
La técnica de obtención del GC mediante el uso de litiodilución transpulmonar fue detallada por Linton en el año de 1993. Mediante una mínima inyección de cloruro de litio en cualquier vena se produce una concentración plasmática de este marcador que será medida a través de un sensor selectivo instalado en la línea arterial que se escoja. El análisis de la curva de dilución brinda valores hemodinámicos que se utilizan para la calibración de un sistema de monitorización continua del GC, latido a latido, centrado en el análisis de la fuerza de pulso14.
La elección del litio como indicador se justifica en que este no se halla en el torrente sanguíneo (solo en individuos que se encuentren en tratamiento con sales de litio). Asimismo, mínimas cantidades de litio (0,002 a 0,004 mmol/kg) producen una señal que resulta suficiente al no presentarse el denominado «ruido» de base. Al ser pequeñas las cantidades de litio inyectadas en sangre, no existe la posibilidad de actividad terapéutica, como tampoco riesgo de naturaleza tóxica. La vertiginosa salida del compartimento central y la ausencia de alteraciones en la concentración a su paso por los vasos pulmonares, consuman el óptimo perfil del litio como marcador21.
Sistema FloTrac®/Vigileo®
Este sistema permite realizar el análisis de la onda de pulso, sin el empleo de termodilución transpulmonar. Una ventaja adicional de estos monitores es que aportan mediciones de variables dinámicas de respuesta a la fluidoterapia (variaciones del VS y la PP). Estos parámetros requieren que el paciente presente ritmo sinusal y unas condiciones ventilatorias determinadas (ausencia de esfuerzo inspiratorio)22.
FloTrac®/Vigileo® (Edwards LifeScinces) analiza el flujo arterial sin necesidad de calibración externa, reemplazada por factores de corrección que dependen de la PA media y de medidas antropométricas (edad, sexo, peso y altura). No precisa de canulación de una arteria de grueso calibre, sólo de la radial. Con la implantación de un catéter venoso central con fibra óptica, se monitoriza la saturación venosa de CO2 (SvCO2). La saturación de O2 a nivel de arteria pulmonar distal o saturación venosa mezclada, o mixta (SvO2), es un indicador aislado de la adecuación del transporte global de O2, pues representa la cantidad de O2 que queda en la circulación sistémica después de su paso por los tejidos22,23.
Aplicaciones clínicas
Respuesta a la terapia hídrica. Según el análisis del índice de VS, permite determinar la necesidad de administrar volumen o soluciones. La variabilidad del VS demuestra exactitud similar al sistema PiCCO, la terapia de fluidos es guiada por objetivos, con menos complicaciones y menos días de estancia hospitalaria22,24.
Pacientes en shock. En pacientes críticos con este diagnóstico, el monitoreo hemodinámico muestra una eficiencia marcada y se utiliza por tres razones principales: identificar el tipo de shock, seleccionar la intervención terapéutica y evaluar la respuesta del paciente al tratamiento22,24.
El porcentaje de error del FloTrac®/Vigileo® en pacientes obesos (índice de masa corporal > 30 kg/m2) es ligeramente más alto que en pacientes con peso normal, debido a la distensibilidad arterial. La medición de la variabilidad del VS se altera con las arritmias graves, respiración espontánea y tórax abierto. Para una mejor lectura e interpretación, se recomienda que la frecuencia cardíaca debe ser inferior a 150 latidos por minuto y la respiratoria, menor de 35 respiraciones por minuto.
Está contraindicado en pacientes con insuficiencia ventricular derecha, y hay deficiencia en la medición del GC en el corazón artificial y en pacientes con dispositivos de asistencia ventricular, balón de contrapulsación aórtico, arritmias graves y persistentes, empleo de solución vasopléjica, vasoconstricción intensa y en pacientes pediátricos22,23.
Sistema Volume View (Edwards LifeScience)
Este método calcula el GC mediante la técnica de la termodilución transpulmonar, mediante la ecuación de Stewar-Hamilton. Además del cálculo del GC se obtienen otros valores, similares a los obtenidos por el sistema PiCCO: VS y su variabilidad, resistencia vascular sistémica y parámetros volumétricos que permiten cuantificar el edema pulmonar22.
Sistema Mostcare (Vyetech Health, Padua, Italia)
Es sistema cuantifica el GC al analizar, latido a latido, la morfología de los componentes de la onda de pulso con el uso del método analítico de registro de presión (PRAM, pressure recording analytical method). Solo requiere de la canalización de una línea arterial, que puede ser la radial, y no necesita de calibración manual25.
Sistema Modelflow-Nexfin
Este sistema analiza de forma no invasiva la PP mediante pletismografía fotoeléctrica, en combinación con su manguito inflable en el dedo. Además de obtener el GC mediante el análisis de la onda, calcula el VS, la resistencia vascular sistémica y el índice de contractilidad del ventrículo izquierdo; cuyos resultados se correlacionan con los obtenidos en la termodilución25.
Método de análisis de la curva de presión arterial
Se centra en la definición de que el contorno de la onda de PA es proporcional al VS. A través del análisis algorítmico de la onda de pulso, latido a latido, se transforma la señal de PA en volumen. Al tener en cuenta que la PP resulta proporcional al VS y a la elasticidad aórtica, el sistema correlaciona las variaciones de la PA con transformaciones en el volumen de sangre (volumen de eyección), siempre que la resistencia aórtica se mantenga constante; por lo que dicho análisis está influenciado por la impedancia aórtica.
El nacimiento de este método, según Domínguez, et al.14, se relaciona con el modelo clásico Windkessel detallado por Otto Frank en 1899, que representa el árbol arterial a través de dos factores: la distensibilidad arterial y la resistencia vascular periférica. Años más tarde, nació el modelo modificado de tres elementos, al ampliarse la impedancia aórtica a los dos anteriores. Modelos más desarrollados reparan en la velocidad de la onda de pulso y en los fenómenos de reflexión en el árbol vascular. El VS puede ser estimado a partir de la porción sistólica de la onda de pulso o la diferencia entre sistólica y diastólica (potencia o PP)14.
Aunque los 4 sistemas de monitorización de contorno de pulso comercialmente disponibles usan diferentes algoritmos de conversión presión-volumen, todos ellos usan este mismo principio básico. Estos sistemas pueden ser divididos hacia 3 categorías9:
Análisis de contorno de pulso que requiere calibración externa mediante técnica de dilución de un indicador para medir el GC, y así calibrar el contorno del pulso (sistemas LiDCO y PiCCO).
Análisis de contorno de pulso que requieren características físicas y demográficas de los pacientes para estimación de la impedancia arterial (sistema FloTrac®).
Análisis de contorno de pulso que no requiere calibración externa o datos de precarga (sistema Mostcare.
Adicional a la medición del VS, estos sistemas también determinan su variabilidad y la de la PP, que son parámetros dinámicos útiles en la predicción de respuesta a líquidos e identifican pacientes dependientes de la precarga26.
Sistema NICOM® de biorreactancia eléctrica torácica
La biorreactancia es el método utilizado por el sistema NICOM, que analiza los cambios de la amplitud y frecuencia de los impulsos eléctricos a medida que pasan por el tórax. Este método mide GC, VS y la contractilidad cardíaca a partir de los cambios de la impedancia torácica causada por la fluctuación del volumen sanguíneo a través del ciclo cardíaco26,27. Entre las desventajas del método se encuentra que el área bajo la onda de pulso de flujo es proporcional al producto del flujo y tiempo de eyección del ventrículo.
Ecografía clínica
La ecografía clínica, también conocida como POCUS (Point of Care Ultrasound), ecografía al lado del paciente, ecoscopia, sonoscopia, sonografía y estetoscopio del siglo XXI, es la exploración mediante ultrasonidos que realiza el médico de asistencia al paciente para precisar diagnósticos o información que no han podido ser totalmente esclarecidos mediante el uso del método clínico. La ecografía clínica es considerada una extensión de la exploración del paciente, no un examen complementario, y se realiza para dar respuestas a preguntas concretas28-30.
En la actualidad no se puede evaluar correctamente la disfunción cardiocirculatoria sin el empleo de la ecografía clínica. Por ejemplo, en el shock hipovolémico hemorrágico por rotura/fisura de órganos intraabdominales, sobre todo hígado y bazo, con el resultante hemoperitoneo, son detectables por la presencia de líquido libre en el espacio hepatorrenal o esplenorrenal, respectivamente28-31. De igual manera, es muy útil la medición del diámetro espiratorio de la vena cava inferior (VCI) y sus índices de colapso inspiratorio y de variabilidad respiratoria, pues -además de permitir el diagnóstico del estado de hipovolemia- es una herramienta de monitoreo cada vez más necesaria para el seguimiento de la respuesta terapéutica a la reposición de fluidos28-31.
La ecografía permite calcular el VS mediante el uso de la técnica de Doppler pulsado que establece la velocidad de la sangre en un punto concreto del sistema cardiovascular. Si se aplica esta técnica a nivel del tracto de salida del ventrículo izquierdo (TSVI) se obtendrá una imagen más o menos triangular que representa el espectro de la velocidad del flujo que pasan por ese punto durante un latido28,30,31. Al trazar la superficie de la imagen de la curva Doppler se obtendrán diversos valores, entre ellos la integral velocidad-tiempo que, al multiplicarla por el área de sección transversal del TSVI, se obtiene el cálculo del VS; pues se tiene en cuenta que el TSVI es una estructura circular que no cambia significativamente su forma durante el ciclo cardíaco29,31-33.
El principal problema de dicha medición consiste en que la integral velocidad-tiempo es una medida reproducible intra e interobservador, pero no lo es el diámetro del TSVI28,30,31. Como consecuencia, al interpretar la evolución del GC no se sabrá si sus modificaciones son consecuencia de las maniobras terapéuticas o de diferencias en la medición del diámetro del TSVI. Para soslayar dicha situación en algunos servicios se ha optado por convertir este diámetro en una constante, puesto que en el fondo es un valor que no cambia y, a su vez, es proporcional a la superficie corporal29,31,32.
Dicha simplificación permite asumir que el VS es igual a la integral velocidad-tiempo y, por tanto, que los cambios en esta última reflejan cambios en el VS. De esta manera es posible hacer una estimación del VS al realizar una normalización a la media y asumir que todos los pacientes tienen un diámetro del TSVI de 2 cm, lo cual corresponde a la media poblacional24,32,33.
Según la experiencia de los investigadores, en el entorno cubano, no se dispone de métodos sofisticados de monitorización hemodinámica, por lo cual el uso de la ecografía constituye un elemento de gran valor.
Diámetro de la vena cava inferior
La medición del diámetro de la VCI y sus cambios con la respiración son muy útiles para evaluar la precarga, al estimar la presión de la aurícula derecha, de manera indirecta y no invasiva, en los pacientes que respiran espontáneamente, o la respuesta a la administración de líquidos en los pacientes que se encuentran con ventilación mecánica34-37. El procedimiento es sencillo, con muy baja variabilidad interobservador, y se realiza a través de la vista subcostal, en decúbito supino o lateral izquierdo, en ejes corto y largo. Se ha establecido que el diámetro normal de la VCI es de 16±2 mm34-37.
Esta medición debe efectuarse en la unión cavodiafragmática derecha, donde la medida resulte mayor, preferentemente en eje corto, ya que el haz de ultrasonido es perpendicular al eje de la cava, sin angulación, y el diámetro máximo es el correcto. Su índice de colapso inspiratorio se calcula mediante la siguiente fórmula: [(diámetro máximo - diámetro mínimo)/diámetro máximo] x 10034-37.
Se ha estimado que existe buena correlación (80-90% de precisión) entre el diámetro de la VCI y su índice de colapso inspiratorio (Figura 3) con la presión de la aurícula derecha (que es equivalente a la PVC): diámetro ≤21 mm con colapso inspiratorio >50% estiman una presión normal de la aurícula derecha (0-5 mmHg), mientras que será ≥15 mmHg si la VCI >21 mm y no colapsa o lo hace poco (< 50%) durante la inspiración34-37.
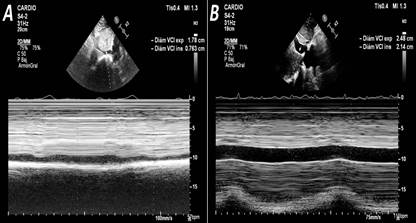
Figura 3 Medición del diámetro y el índice de colapso de la vena cava inferior (VCI) durante la inspiración. A. Valores normales. B. VCI dilatada (24,8 mm) con colapso inspiratorio de 14%. Imágenes ecocardiográficas cortesía del Dr. Francisco L. Moreno-Martínez.
Uno de los criterios de hipovolemia es una VCI colapsada, junto con otros parámetros como la reducción del diámetro del ventrículo izquierdo; pero las interacciones normales entre corazón y pulmón con la hemodinámica están alteradas en los pacientes con ventilación mecánica, por lo que no se recomienda el uso de estas medidas de la VCI, sino sus índices de distensibilidad y variabilidad34-37. Un índice de distensibilidad >18% tiene 90% de sensibilidad y especificidad para predecir que el paciente responderá adecuadamente al aporte de líquidos, al igual que un índice de variabilidad >12% (valor predictivo positivo >90%)34-37.
Durante la inspiración sostenida, la sangre retorna al tórax por aumento de la presión negativa, lo que causa colapso de la VCI; pues es alto el flujo, pero con presión baja. Durante la expiración y la apnea espiratoria sucede lo contrario, que produce aumento del diámetro debido al llenado de la VCI. Con la maniobra de Valsalva se suma otro factor: la presión abdominal. En la mayoría de los individuos la presión abdominal es lo suficientemente alta como para forzar el flujo sanguíneo a través de la VCI hacia el tórax, lo que produce colapso de la VCI; contrario al efecto de esta misma maniobra en las venas yugulares, las cuales se distienden.
La mayoría los pacientes con ventilación mecánica van a tener una VCI dilatada, pero durante la ventilación espontánea su análisis sí es útil. La dilatación y la ausencia de cambios del diámetro y la distensibilidad de la VCI, con la inspiración y expiración, indican que el volumen plasmático está elevado o que existe aumento de las presiones del ventrículo derecho por insuficiencia o hipertensión pulmonar34-37.
Existen otras situaciones en las cuales el análisis de estos parámetros de la VCI pierde utilidad: derrame pleural derecho, intubación endotraqueal, apnea del sueño, insuficiencia diafragmática e hipertensión arterial pulmonar grave34-37.
En síntesis, un sistema de monitorización ideal debe reunir las siguientes características26:
CONCLUSIONES
El monitoreo hemodinámico resulta una herramienta indispensable para determinar el estado del medio interno, así como la necesidad de administrar fluidos y su respuesta terapéutica; donde la curva de Frank-Starling representa el sustento fisiológico. Se logra mediante la determinación de parámetros estáticos y dinámicos, que analizan el gasto cardíaco y la presión de pulso, medidos mediante métodos invasivos, mínimamente invasivos y no invasivos. La variabilidad de la presión de pulso y del volumen sistólico constituyen nuevas variables útiles en el proceso. El estudio de la vena cava inferior mediante ecocardiografía juega un importante papel en el monitoreo hemodinámico.