Introducción
Las actividades agrícolas, ganaderas y agroindustriales producen constantemente grandes cantidades de residuos que contaminan y afectan al medio ambiente cuando no son desechadas adecuadamente, tales desechos pueden dañar irremediablemente los ecosistemas. Debido a su alto potencial energético y sus características nutricionales muchos de estos desechos agroindustriales se utilizan como un suplemento del ganado, principalmente en rumiantes, desempeñando un valor clave en la mejora nutricional del pienso animal (Quintanilla-Medina, et al., 2018). El uso de fuentes fibrosas en la alimentación de especies monogástricas constituye, en la actualidad, una estrategia apropiada para lograr sistemas de producción socialmente deseables y económicamente viables. Sin embargo, uno de los inconvenientes del uso de estos desechos agroindustriales es la presencia de compuestos que por su estructura química actúan como antinutrientes (Fibra, polifenoles, flavonoides) cuando están presentes en grandes cantidades (Savón et al., 2005).
La fermentación en estado sólido es un método confiable que permite reducir los factores antinutricionales presentes en estos compuestos (Valiño, et al., 2015), no obstante existen factores externos que afectan de manera significativa el proceso de fermentación y que deben ser conocidos para poder mejorarlo y obtener una mayor reducción de los factores (Li, et al., 2016).
La humedad es una de las variables más importantes a ser controladas durante un proceso de fermentación en estado sólido, dependiendo del sustrato a fermentar, el microorganismo usado y el objetivo planteado, esta debe estar entre el 30 y el 80% (Oriol et al., 1988). Una humedad muy baja o un exceso generará afectaciones que van desde la contaminación bacteriana del cultivo hasta una baja estabilidad en los metabolitos que se desea obtener en El pH es otro de los factores que afectan la fermentación sólida, su control suele ser complicado en este tipo de proceso y varía a lo largo del mismo por múltiples razones, ya sea por la formación de ácidos orgánicos o por el metabolismo de la fuente de nitrógeno que se utiliza, algunos investigadores han podido formular medios de cultivo cuyo pH se mantiene durante todo el procesoz (Raimbault, 1998; Carrasco et al., 2003).
El pH es otra de las variables que afectan la fermentación sólida, su control suele ser complicado en este tipo de proceso y varía a lo largo del mismo por múltiples razones, ya sea por la formación de ácidos orgánicos o por el metabolismo de la fuente de nitrógeno que se utiliza, algunos investigadores han podido formular medios de cultivo cuyo pH se mantiene durante todo el proceso (Raimbault, 1998).
La temperatura se considera la variable más crítica en los procesos de fermentación sólida y esto es debido a la alta concentración de sustrato por unidad de volumen y a la baja conductividad térmica del sistema, lo cual favorece la acumulación del calor (Gurubel et al., 2017). El incremento en la temperatura puede afectar a la actividad microbiana, deshidratar el medio sólido o desviar el metabolismo generando compuestos indeseables (Adnan, et al., 2017). El control de la temperatura es uno de los principales retos de la fermentación sólida.
El tamaño de partícula se encuentra muy ligado a la transferencia de masa en la fermentación sólida (Liu et al., 2012), afecta tanto a nivel intrapartícula como interpartícula.
El objetivo de este trabajo es determinar las mejores condiciones de humedad, temperatura, pH y tamaño de partícula para que las cepas de A. niger J1 y T. viride M5-2 logren la mayor reducción de los factores antinutricionales en la harina de L. mutabilis Sweet sometida a un proceso de fermentación en estado sólido.
Materiales y métodos
Microorganismos. Se utilizaron dos cepas de hongos con características lignocelulolíticas, Aspergillus niger J1 (KY486928) aislado a partir de bagazo de caña en la Facultad de Ingeniería Química de la Universidad Tecnológica de La Habana “José Antonio Echeverría”, CUJAE, identificada en el Instituto de Ciencia Animal (ICA) y Trichoderma viride M5-2 (KY977981) perteneciente al banco de cepas del Instituto de Ciencia Animal. Se conoce que estas cepas poseen actividad hidrolítica y secretan enzimas celulasas en sustratos altamente fibrosos, ambas han sido evaluadas mediante fermentación en estado sólido (Valiño et al., 2004).
Sustrato para la fermentación. El sustrato vegetal consistió en plantas de Lupinus mutabilis Sweet post cosecha, de la hacienda “Lupita” del cantón Riobamba de la provincia de Chimborazo. En el Centro de Investigaciones Biotecnológicas del Ecuador (CIBE) se procedió a secarlo en una estufa HAFO SERIES 1600 a temperatura de 65°C por 48 horas y posteriormente se procedió a su molienda con un molino manual marca CORONA. A este sustrato se le realizó un análisis de humedad por el método gravimétrico con un resultado final de 5% y un tamaño de partícula que variaba entre 4 y 0,25 mm debido a las características del molino. Para el segundo diseño experimental se separó el sustrato acorde al tamaño de partícula, donde el código 01 se corresponde con las partículas que se encuentran entre 0,71 y 0,25 mm y el código 02 al sustrato sin clasificación de tamaño. La composición bromatológica del sustrato se muestra en la tabla 1.
Tabla 1 - Composición de la harina de follaje de L. mutabilis Sweet
| Composición bromatológica de la harina de L. mutabilis Sweet (100 g de producto seco) | |
| Componente | |
| FND (%) | 71,05 |
| FAD (%) | 53,84 |
| Lignina (%) | 13,28 |
| Celulosa (%) | 40,56 |
| Hemicelulosa (%) | 17,21 |
| Flavonoides (mg de catequinas/100 g de MS) | 55,53 |
| Polifenoles (mg de ac. gálico/100 g de MS) | 9,78 |
Proceso de fermentación.
Se utilizaron frascos de 250 mL con 10 g del sustrato seco, en un primer experimento se realizó un diseño 22 con dos variables (humedad y pH) y dos niveles para cada factor 60 y 70 % para humedad y 4 y 6 para pH, posteriormente se le enriqueció con urea 2.5%, fosfato de potasio (KH2PO4) 5% y sulfato de amonio ((NH4)2SO4) 10% (Roussos et al., 1991), estos porcentajes se calcularon sobre la base de los 10 g de sustrato seco. El sustrato húmedo fue esterilizado en autoclave por 20 min a 121oC. Para el inóculo se utilizaron soluciones de esporas, A. niger J1 se inoculó con 106 esporas/g de sustrato seco (Torres-León et al., 2019) y T. viride M5-2 se inoculó con 107 esporas/g de sustrato seco (Valiño et al., 2004). Los frascos inoculados y sus contenidos homogenizados fueron colocados en incubadora a 30oC durante 144 h. Al finalizar el tiempo se tomó el sustrato y se le realizaron los análisis respectivos para determinar cuáles fueron los mejores parámetros en virtud de la mayor reducción de los factores antinutricionales (FAD, FND, polifenoles y flavonoides) y con estos parámetros estudió un nuevo diseño 22, donde las variables fueron temperatura y diámetro de partícula y los niveles 30 y 35ºC para la temperatura con A. niger J1 y 28 y 32ºC con T. viride M5-2 y los diámetros de partícula fueron entre 0.71 y 0.25 mm y entre 4 y 0.25 mm. Luego fue esterilizado el medio de fermentación e inoculado del mismo modo que en el primer diseño y se fermentó durante 144 h. Al finalizar el tiempo se volvieron a realizar los análisis químicos para determinar la de los factores antinutricionales.
Análisis bromatológico. Los indicadores bromatológicos que se estudiaron fueron Fibra Neutro Detergente (FND) y Fibra Ácido Detergente (FAD), lignina (LIG) por el método ANSI/ASTM D1106-56 y celulosa (CEL) por el método ANSI/ASTM D1103-60 1977. También se analizó el contenido de polifenoles (mg de ac. gálico/100 g de sustrato seco) de acuerdo al método de folin ciocalteu (Cabrera-Carrión et al., 2017) y el contenido de flavonoides (mg de catequinas / 100 g de sustrato seco).
Análisis estadístico. Se utilizó un diseño completamente aleatorizado, con tres repeticiones y dos inóculos (A. niger J1 y T. viride M5-2). Cada frasco constituyó una unidad experimental. Para la realización de los análisis se utilizó el programa STATGRAPHICS XV CENTURION
Resultados y discusión
La tabla 2 muestra los efectos de las diferentes condiciones planificadas en el primer diseño experimental y su relación entre los diferentes factores antinutricionales manteniendo la temperatura del experimento constante (30oC) y sin hacer discriminación del tamaño de partícula. Tanto el pH como la humedad influyen en el modo en que las cepas transforman los factores antinutricionales, a pH 4 A. niger J1 reduce significativamente los polifenoles, los flavonoides y los FAD en comparación con el pH 6 y esta reducción es mayor cuando la humedad del sustrato se incrementa de 60 a 70%, lo mismo se observa en el caso de T. viride M5-2 en donde a pH 4 y humedad de 70% se obtiene los valores más bajos de los factores antinutricionales. Luego del análisis estadístico se determina que para las cepas A. niger J1 y T. viride M5-2 las condiciones de pH 4 y humedad 70% son con las que se reducen más los factores antinutricionales en comparación con las otras condiciones. Estas fueron las condiciones que se usaron en el segundo experimento, se sabe que el pH bajo favorece la producción de diferentes enzimas lo cual podría ser un factor determinante para la reducción de los factores antinutricionales estudiados (Sohail et al., 2009). Por otro lado una humedad de 70% garantiza condiciones favorables para el crecimiento de los microorganismos en el sustrato durante una fermentación sólida (Liang et al., 2020).
Tabla 2 - Efecto del proceso de fermentación sobre los factores antinutricionales con el primer diseño pH 4 y 6, Humedad 60% y 70%, temperatura 30oC y sin discriminación del tamaño de partícula.
|
| ||||
| Condición | FND (g/100 g MS) | FAD (g/100 g MS) | Polifenoles (mg/100 g MS) | Flavonoides (mg/100 g MS) |
| pH 4 - H 60% | 73,72b ±0,08 | 54,19c ±0,09 | 1,89b ±0,10 | 36,62b ±0,89 |
| pH 4 - H 70% | 59,01a ±0,06 | 42,77a ±0,08 | 1,58a ±0,16 | 27,48a ±0,63 |
| pH 6 - H 60% | 61,33a ±0,07 | 47,93b ±0,06 | 2,72c ±0,09 | 50,10d ±0,24 |
| pH 6 - H 70% | 60,10a ±0,08 | 47,03b ±0,08 | 1,72ab ±0,20 | 39,56c ±1,41 |
|
| ||||
| Condición | FND (g/100 g MS) | FAD (g/100 g MS) | Polifenoles (mg/100 g MS) | Flavonoides (mg/100 g MS) |
| pH 4 - H 60% | 65,57d ±0,11 | 47,72b ±0,15 | 8,43b ±0,09 | 46,18b ±0,88 |
| pH 4 - H 70% | 58,94a ±0,11 | 44,18a ±0,14 | 8,06a ±0,08 | 39,85a ±0,78 |
| pH 6 - H 60% | 60,18b ±0,13 | 47,98b ±0,16 | 9,23c ±0,17 | 74,95d ±0,48 |
| pH 6 - H 70% | 61,94c ±0,12 | 48,55b ±0,15 | 9,03c ±0,10 | 57,89c ±0,63 |
a,b,c,d Letras distintas indican diferencias significativas P<0.05, según Duncan (1955)
Para hacer la selección de los mejores parámetros que permitieran a los microorganismos utilizados la mayor reducción de los factores antinutricionales se analizaron los resultados obtenidos con el programa STATGRAPHICS XV CENTURION y se obtuvo la superficie respuesta para cada uno de los factores antinutricionales analizados (fig 1), observando que para el primer diseño con pH de 4 y 6 y humedad de 60 y 70 % se obtenían diferencias significativas entre todos los tratamientos pero las mejores reducciones de estos factores se lograban a un pH de 4 y una humedad de 70% para ambas cepas. Por lo tanto, para proceder a realizar el segundo diseño de experimento se establecen los parámetros de pH y humedad de 4 y 70% respectivamente para todas las unidades experimentales.
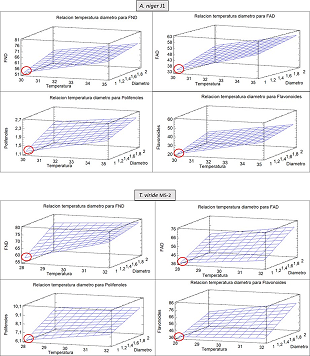
En la tabla 3 se observa que la temperatura y el diámetro de partícula también son variables que influyen en la reducción de los factores antinutricionales. Las temperaturas de 30oC y 28oC para A. niger J1 y T. viride M5-2 respectivamente fueron las que registraron los valores más bajos para los factores antinutricionales, mientras que al discriminar el tamaño de partícula se observa que cuando este es más pequeño se ve favorecida la reducción de los factores. Para la cepa A. niger J1 las condiciones que más contribuyen con la reducción de los factores antinutricionales se encuentra a 30oC y con el tamaño de partícula 01 (0,71 - 0,25 mm), mientras que para T. viride M5-2 estas se encontraban a 28oC y con el tamaño de partícula 01 (0,71 - 0,25 mm). Estas condiciones de temperaturas se corresponden con las óptimas de temperaturas de crecimiento de los géneros Aspergillus y Trichoderma en condiciones experimentales (Kalsoom et al., 2019). Por otro lado, un tamaño de partícula pequeño favorece la colonización del sustrato por parte de las cepas (Fitzpatrick et al., 2010), por esta razón en el experimento ambas cepas se ven favorecidas por el tamaño de partícula más pequeño
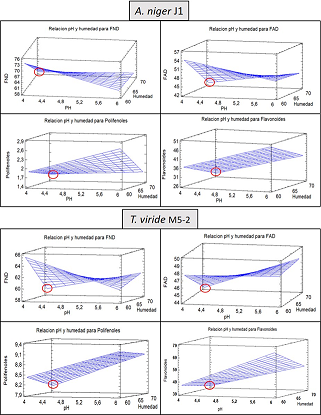
Fig. 1 - Superficie respuesta del primer diseño para los factores antinutricionales temperatura 30oC sin discriminar el tamaño de partícula.
Tabla 3 - Efecto del proceso de fermentación sobre los factores antinutricionales con el segundo diseño pH 4, humedad 70%, temperatura 30oC y 35oC para A. niger y 28oC y 32oC para T. viride.
|
| ||||
| Condición | FND (g/100 g MS) | FAD (g/100 g MS) | Polifenoles (mg/100 gr MS) | Flavonoides (mg/100 gr MS) |
| T 30oC - D 01 | 52,87a ±0,05 | 34,90a ±0,07 | 1,23a ±0,17 | 20,71a ±0,51 |
| T 30oC - D 02 | 61,08b ±0,08 | 46,90b ±0,08 | 2,07b ±0,46 | 31,78b ±4,76 |
| T 35oC - D 01 | 65,80b ±0,08 | 52,03b ±0,07 | 1,93b ±0,04 | 38,47bc ±0,62 |
| T 35oC - D 02 | 70,90c ±0,12 | 60,87c ±0,02 | 2,44b ±0,30 | 45,11c ±7,79 |
|
| ||||
| Condición | FND (g/100 g MS) | FAD (g/100 g MS) | Polifenoles (mg/100 gr MS) | Flavonoides (mg/100 gr MS) |
| T 28oC - D 01 | 58,27a ±0,08 | 37,17a ±0,11 | 6,24a ±0,17 | 37,05a ±0,81 |
| T 28oC - D 02 | 74,83b ±0,07 | 56,80c ±0,05 | 8,61c ±0,14 | 56,23c ±1,05 |
| T 32oC - D 01 | 72,37b ±0,08 | 44,60b ±0,11 | 7,34b ±0,27 | 41,11b ±1,02 |
| T 32oC - D 02 | 77,37b ±0,16 | 69,77d ±0,02 | 9,07d ±0,14 | 75,00d ±1,64 |
a,b,c,d Letras distintas indican diferencias significativas P<0.05, según Duncan
La fig 2 muestra las superficies de respuesta del segundo diseño de experimento, se observa una relación directa entre los parámetros temperatura y tamaño de partícula (diámetro), ambos influyen significativamente y de manera positiva en los factores antinutricionales, a medida que aumentan la temperatura y el tamaño de partícula aumentan también los factores antinutricionales, el objetivo del experimento es la reducción de estos factores antinutricionales, por ende los mejores valores estarán localizados para A. niger J1 en 30oC y tamaño de partícula entre 0.71 y 0.25 mm y para T. viride M5-2 serían 28oC y tamaño de partícula entre 0.71 y 0.25 mm.
La tabla 4 muestra la comparación entre los valores iniciales de la harina de follaje de L. mutabilis Sweet con los obtenidos de los experimentos realizados con los mejores parámetros obtenidos, que para A. niger J1 fueron pH 4, humedad 70%, temperatura 30oC y tamaño de partícula entre 0.71 y 0.25 mm y para T. viride M5-2 fue pH 4, humedad 70%, temperatura 28oC y tamaño de partícula entre 0.71 y 0.25 mm.
Tabla 4 - Comparación entre los valores iniciales y los finales de los factores antinutricionales
| FACTOR | INICIO |
|
|
Valores aceptados |
| FND (g/100 g MS) | 71,05b | 52,9ª ±0,05 | 58,3ª ±0,08 | 65,01 |
| FAD (g/100 g MS) | 53,84b | 34,9ª ±0,07 | 37,2ª ±0,11 | 45,01 |
| Polifenoles (mg/100 gr) | 9,78c | 1,23ª ±0,17 | 6,24b ±0,17 | 8,02 |
| Flavonoides (mg/100 gr) | 55,53c | 20,72ª ±0,51 | 37,05b ±0,81 | N.D |
a,b,c Letras distintas indican diferencias significativas P<0.05, según Duncan (1955)
* Mejores condiciones del experimento para ambas cepas
Conclusiones
Se definió que para la cepa A. niger J1 el tratamiento seleccionado reduce los polifenoles de 9,78 mg/100 gr hasta 1,23 mg/100 gr, lo que equivale a una reducción del 87% de los polifenoles presentes en la muestra antes de la fermentación, y en el caso de los flavonoides los reduce de 55,53 mg/100 gr hasta 20,72 mg/100 gr lo que equivale a una reducción del 62.6%, en comparación con la cepa T. viride M5-2 que con el mejor tratamiento reduce solo el 36% de los polifenoles y el 33.3 % de los flavonoides.
Por otro lado, los valores de reducción de FND y FAD no muestran diferencias entre ambas cepas al finalizar el experimento
La cepa A. niger con los parámetros establecidos como mejores logra la mayor reducción de los factores antinutricionales, mejorando el valor nutritivo de la harina de follaje de L. mutabilis Sweet, se recomienda realizar un escalado del proceso para verificar los datos obtenidos.
Se concluye qué si es posible reducir los factores antinutricionales de la harina integral de Lupinus mutabilis Sweet, es factible realizar un proceso de fermentación en estado sólido rústico, controlando parámetros de manera sencilla, lo cual puede ser realizado en las mismas fincas en donde se cosecha el grano, logrando así utilizar un producto que era desechado.