Introducción
En la actualidad, el mundo produce alrededor de 200 mil toneladas de materiales de celulosa microcristalina por año, a partir de algodón, madera y sulfato de celulosa para procesamiento químico con un alto contenido de alfa celulosa y un bajo contenido de lignina y hemicelulosas, aproximadamente el 70% de celulosa microcristalina se utiliza en las industrias alimentarias y farmacéuticas (Cordero et al., 2013).
El mercado mundial de celulosa microcristalina en 2017 ascendió a unos 900 millones de dólares, para 2025 se pretende que alcance los 1.451 millones de dólares, con un aumento del 5,5% de 2018 al 2025 (Market, Microcrystalline Cellulose (MCC) 2018). América del Norte es el mayor consumidor de este producto (> 45%), seguida de Asia y Europa. La región de Asia y el Pacífico muestra un consumo acelerado de celulosa microcristalina, mientras que América del Norte y Europa está creciendo a un ritmo más modesto (Market, Cellulose Powder 2018). De acuerdo con el análisis presentado por Global de Celulosa Microcristalina 2017-2025, uno de los principales factores que inciden en el mercado de celulosa microcristalina es la creciente demanda de su uso en las industrias alimentaria y farmacéutica por sus características y excelentes propiedades.
La madera es principalmente el material lignocelulósico empleado en la fabricación de diversos polímeros, muebles, pasta papelera entre otros. El 19% de la madera extraída mundialmente se destina para usos energéticos y el 42% se emplea en la fabricación de pastas de celulosa y subproductos. El incremento en la demanda de esta clase de materias primas ocasiona problemas tantos económicos como medioambientales (Locane, 2016; Rodríguez, 2011), entre las áreas más importantes de uso y aplicación se destacan:
Obtención de productos que sustituyan la utilización parcial o total de reservas fósiles a partir de fuentes renovables.
Obtención de polímeros y derivados químicos a partir de materiales residuales de bosques, cultivos o industria maderera.
Durante los últimos años la ecología y el ambiente se encuentran presentes en todos los ámbitos, el desarrollo sustentable involucra disposiciones orientadas a la administración eficiente y responsable de los recursos naturales para la preservación de estos. En este sentido, una de las fuentes prometedoras de materias primas puede ser la biomasa lignocelulósica presente en pastos y forrajes que son muy poco valorados presentando un gran porcentaje de fibra vegetal (Ortiz, 2011).
Los forrajes y pastos constituyen el alimento básico de consumo en el sector agropecuario, su material lignocelulósico presenta un gran potencial debido a su composición química, esta biomasa lignocelulósica presente en hojas y tallos pueden utilizarse como materia prima para la producción de celulosa microcristalina, pero hasta ahora se ha prestado poca atención a esta trayectoria de recuperación en forrajes.
El pasto elefante (Pennisetum purpureum) es una planta perenne del trópico con una gran producción de biomasa que se adapta a diferentes condiciones edafoclimáticas, esto se debe a la estabilidad en el rendimiento de los genotipos en ambientes diferentes (Schneider et al., 2016). Tiene productividad, tanto como alimento para el ganado como para su uso para la obtención de biocombustible, su producción de materia seca por hectárea año, alrededor de 40 - 50 toneladas (Cardona et al., 2012).
Los pocos datos disponibles en la literatura muestran el aislamiento del bagazo de caña de azúcar (Cordero et al., 2013), en Desechos Agrícolas del Cambur (Romero et al., 2014) fibra de estopa de coco (Pineda & Navarrete, 2017), en pseudotallo de banano (Aroca & Estrada, 2015), en madera y algodón (Maurat, 2014), entre otros, pero no se encuentra referencia bibliográfica de la obtención a partir del pasto de la especie Pennisetum Purpureum.
El aislamiento de la celulosa a partir de materiales naturales se basa en la acción de reactivos que disuelven o destruyen los componentes no celulósicos contenidos en los tejidos vegetales (proteínas, grasas, ceras, resinas, lignina y polisacáridos). Los métodos de aislamiento dependen del tipo de material vegetal, los principales son:
Hidrolisis ácida - Las zonas amorfas de la celulosa son más susceptibles a la hidrólisis ácida, de manera que facilita la ruptura de los enlaces o-glucosídicos, liberando los cristales individuales. Frecuentemente son utilizados los ácidos sulfúrico y clorhídrico, las suspensiones coloidales producidas por hidrólisis con ácido sulfúrico son más estables (Maurat, 2014).
Hidrolisis alcalina - Actúa igual que la hidrolisis ácida, provocando disminución en el grado de polimerización de la celulosa. Ocurre a altas temperaturas y con álcalis fuertes o si la celulosa presenta grupos oxidados (Odor, 2008). El tratamiento con solución de hidróxido de sodio (NaOH) produce un hinchamiento de la biomasa, aumentando el área superficial interna, un descenso de la cristalinidad, lo que ocasiona la separación de las uniones entre la lignina y los carbohidratos y una rotura de la estructura de la lignina (Rodríguez, 2016).
En este sentido, esta investigación pretende obtener celulosa blanqueada partir del pasto elefante (Pennisetum Purpureum), mediante la combinación de métodos de hidrólisis (ácida y alcalina) para lograr la fracción cristalina de la celulosa.
Desarrollo
La celulosa es la molécula biológica más abundante, y constituye el mayor porcentaje de los biopolímeros en la tierra, su principal fuente es de origen vegetal, formando parte de la pared celular en plantas. La celulosa puede ser sintetizada por diferentes sistemas biológicos, como hongos, algunos representantes del phyllum Chordata (o tunicados), que son un tipo de animales marinos y bacterias del género Agrobacterium, Rhizobium, Sarcina y Acetobacter, donde los productores más eficientes son las bacterias Gram-Negativas del género Acetobacter; la más importante de ellas Acetobacter xylinum (reclasificada como Gluconoacetobacter xylinus) se ha utilizado como microorganismo modelo en los estudios básicos y aplicados sobre este producto (Jaramillo et al., 2014).
La celulosa de origen bacteriano es de gran interés debido a sus propiedades mecánicas, su alto grado de cristalinidad, pureza y polimerización. Además, resulta ser de gran importancia industrial, pues a diferencia de las celulosas vegetales se encuentra libre de hemicelulosa y lignina, características que la hacen industrialmente conveniente. Por otro lado, esta forma de obtener celulosa a partir de bacterias resulta ser una alternativa ante la celulosa de origen vegetal, debido a que puede solucionar problemas de impacto ambiental tales como la pérdida de grandes cantidades de bosque, el debilitamiento del suelo, la extinción de fauna y flora nativa y el aumento del calentamiento global (Jaramillo et al., 2014).
En la producción de celulosa bacteriana por el método estático, el factor de rendimiento Yp/s es afectado por la concentración de glucosa inicial y el tiempo de fermentación. Bajas concentraciones dan valores altos de Yp/s al inicio de la fermentación, mientras que altas concentraciones requieren tiempos largos para lograr valores comparables. El área superficial aumenta la producción de celulosa, pero existe una relación (área interfacial/volumen de medio) límite a partir de la cual la celulosa producida por unidad de área comienza a descender. Existe una relación lineal entre el espesor relativo de película, definido como (altura de película húmeda/altura de líquido), y el área por unidad de volumen de medio. El espesor relativo límite (altura de película = altura de líquido) se encontraría para una relación área- volumen teórica de 1,1 cm', pero en la práctica se determinó que este valor es de 0,8 cm' para no afectar el rendimiento de celulosa (Caicedo et al., 2011).
Materiales y métodos
La materia vegetal utilizada fue recolectada en los predios de la Asociación Agropecuaria “Maconta Arriba”, Portoviejo - Ecuador, dado área posee alrededor de 2500 especies de tipo Pennisetum Purpureum, debido a esto, se realizó un muestreo al azar en forma sistemática y estratificada (la pastura es dividida en áreas con similares características) con una madurez de 70 días, según la técnica de muestreo y parámetros de calidad de pastos y forrajes (Bruno et al., 1995). Posterior, los tallos fueron limpiados, lavados y troceados. Antes de realizar algún tratamiento químico al material vegetal este pasó por una etapa de pretratamiento que consistió en la clasificación y lavado más profundo con agua destilada, el material fue secado al sol para eliminar el exceso de humedad por el lavado, luego se secó hasta peso constante en un horno a 100 °C aproximadamente de 2 a 3 horas y se almacenaron en fundas herméticas.
Caracterización de la materia prima
La caracterización de la materia prima se realizó mediante análisis físico-químicos según las normas ANSI (American Society for Testing and Materials) y las normas TAPPI (Technical Association for the Pulp and Paper Industries) con adaptaciones, las normas utilizadas se presentan a continuación (tabla 1):
N° de repeticiones = 3, N° de tratamientos = 18, con un nivel de significancia (5 %).
Tabla 1 - Esquema del experimento
| Tratamiento | Muestra | Concentración de H2SO4 (%) | Concentración de NaOH (%) | Concentración de NaClO (%) |
|---|---|---|---|---|
| t = 60 min; T = 60°C | t = 120 min; T = 60°C | t = 300 min; T = 25°C | ||
| T1 | 1 | 0.4 | 10 | 5 |
| 2 | 0.4 | 10 | 5 | |
| 3 | 0.4 | 10 | 5 | |
| T2 | 1 | 0.4 | 20 | 5 |
| 2 | 0.4 | 20 | 5 | |
| 3 | 0.4 | 20 | 5 | |
| T3 | 1 | 0.4 | 30 | 5 |
| 2 | 0.4 | 30 | 5 | |
| 3 | 0.4 | 30 | 5 | |
| T4 | 1 | 0.4 | 10 | 2 |
| 2 | 0.4 | 10 | 2 | |
| 3 | 0.4 | 10 | 2 | |
| T5 | 1 | 0.4 | 20 | 2 |
| 2 | 0.4 | 20 | 2 | |
| 3 | 0.4 | 20 | 2 | |
| T6 | 1 | 0.4 | 30 | 2 |
| 2 | 0.4 | 30 | 2 | |
| 3 | 0.4 | 30 | 2 |
Fuente: elaboración propia.
La obtención se realizó bajo las siguientes etapas:
Extraíbles en agua caliente. Se colocó el material vegetal en un baño de agua destilada a 80°C por una hora, posteriormente se filtró el material y se llevó a secar hasta peso constante.
Hidrolisis acida. Consistió en una maceración acida del material vegetal obtenido luego de la técnica de extraíbles en agua caliente. Se tomó como referencia en método mejorado y aplicado según Pineda & Navarrete (2017) el cual se fundamenta del método de (Aroca & Estrada, 2015) donde se trabajó con una concentración suave de ácido sulfúrico de 0.4% por 60 minutos a una temperatura de 60°C, se filtra y se lava el material hasta un pH neutral y se lleva a secar hasta un peso constante.
Hidrolisis alcalina. En esta etapa del proceso se hizo reaccionar 20 gramos de muestra seca obtenida de la etapa de hidrolisis acida, con concentraciones diferentes de hidróxido de sodio dependiendo el tratamiento, calentándolo hasta los 60 °C por 120 min. Cumplido el tiempo requerido se lavó hasta pH neutral y se secó hasta peso constante.
Blanqueamiento. El blanqueamiento con NaClO se realizó a concentraciones diferentes según el tratamiento a una temperatura de 25°C por un tiempo de 300 minutos sin agitación. Cumplido el tiempo requerido se lavó hasta pH neutral y se secó hasta peso constante.
Molienda y tamizado. Para reducir el tamaño de partícula del material seco se utilizó un mortero y se molió en forma manual, luego, se clasificó el tamaño del material pulverizado mediante tamices de mallas 80, 100, 120 y 140.
Para la determinación de propiedades de la celulosa microcristalina obtenida, los análisis físico químicos se realizaron de acuerdo a las normas INEN (Instituto Ecuatoriano de Normalización) para la identificación cualitativa de celulosa y en combinación con las normas ANSI (American Society for Testing and Materials) y TAPPI (Technical Association for the Pulp and Paper Industries), se compararon con las especificaciones establecidas por el Reglamento (CE) n°1333/2008 del Parlamento Europeo y del Consejo, de 16 de diciembre de 2008, con respecto a la celulosa microcristalina, las normas se detallan a continuación:
INEN 2527 (Determinación cualitativa de celulosa)
INEN 2527 (Determinación de solubilidad)
NTE INEN 0384:1978 (Determinación de pH)
TAPPI T-211 (Determinación de cenizas)
TAPPI T-236 y TAPPI 236 cm-85 (Determinación del grado de des lignificación)
ASTM D4442-92 (Determinación de humedad)
Método de Kurschner y Hoffer (Determinación de celulosa)
La descripción estadística se realizó aplicando paquetes informáticos estadísticos de carácter gratuito (Excel y RStudio), los cuales permitieron realizar el análisis de la varianza y partiendo de este se aplicó la prueba Tukey HSD, para las tabulaciones de: rendimiento y porcentaje de pureza.
Resultados
El pasto elefante utilizado presentó las siguientes características físico-químicas según los análisis realizados: humedad 79.2%, ceniza 13.30%, hemicelulosa 29.75%, lignina 9.53%, celulosa 37.26% y sustancias extraíbles 20.61% en porcentaje de peso, los resultados fueron comparados con investigación de (Segura et al., 2008; Cleef et al., 2012; Cazco, 2017) estos se encuentran dentro de los márgenes del tipo de material vegetal, por el contenido de material lignocelulósico y aspectos biológicos de la especie, como la rápida madurez que alcanza la fibra vegetal en tiempo es considerado como una fuente para la extracción de pulpa de celulosa.
La obtención de celulosa microcristalina se llevó a cabo bajo diferentes tratamientos y muestras, los cuales se encuentran contemplados en la tabla 2, de cada tratamiento se evaluó la pureza y el rendimiento del producto final obtenido.
Tabla 2 - Resultado de rendimiento y pureza después de cada tratamiento
| Tratamiento | Muestra | Peso de muestra seca (gr) | Concentración de H2SO4 (%) | Concentración de NaOH (%) | Concentración de NaClO (%) | Peso de producto final (gr) | Rendimiento (%) | Pureza (%) |
|---|---|---|---|---|---|---|---|---|
| t = 60 min; T = 60°C | t = 120 min; T = 60°C | t = 300 min; T = 25°C | ||||||
| T1 | 1 | 10 | 0.4 | 10 | 5 | 3.33 | 33.3 | 54.7 |
| 2 | 10 | 0.4 | 10 | 5 | 3.454 | 34.54 | 52.37 | |
| 3 | 10 | 0.4 | 10 | 5 | 3.516 | 35.16 | 51.35 | |
| T2 | 1 | 10 | 0.4 | 20 | 5 | 3.754 | 37.54 | 74.34 |
| 2 | 10 | 0.4 | 20 | 5 | 3.946 | 39.46 | 75.63 | |
| 3 | 10 | 0.4 | 20 | 5 | 3.685 | 36.85 | 74.27 | |
| T3 | 1 | 10 | 0.4 | 30 | 5 | 2.254 | 22.54 | 72.23 |
| 2 | 10 | 0.4 | 30 | 5 | 2.06 | 20.6 | 67.79 | |
| 3 | 10 | 0.4 | 30 | 5 | 2.485 | 24.85 | 70.74 | |
| T4 | 1 | 10 | 0.4 | 10 | 2 | 3.624 | 36.24 | 42.15 |
| 2 | 10 | 0.4 | 10 | 2 | 3.243 | 32.43 | 45.78 | |
| 3 | 10 | 0.4 | 10 | 2 | 3.678 | 36.78 | 43.18 | |
| T5 | 1 | 10 | 0.4 | 20 | 2 | 3.734 | 37.34 | 67.67 |
| 2 | 10 | 0.4 | 20 | 2 | 3.593 | 35.93 | 70.37 | |
| 3 | 10 | 0.4 | 20 | 2 | 3.945 | 39.45 | 69.23 | |
| T6 | 1 | 10 | 0.4 | 30 | 2 | 2.967 | 29.67 | 62.57 |
| 2 | 10 | 0.4 | 30 | 2 | 3.084 | 30.84 | 68.47 | |
| 3 | 10 | 0.4 | 30 | 2 | 2.775 | 27.75 | 65.24 |
Fuente: elaboración propia.
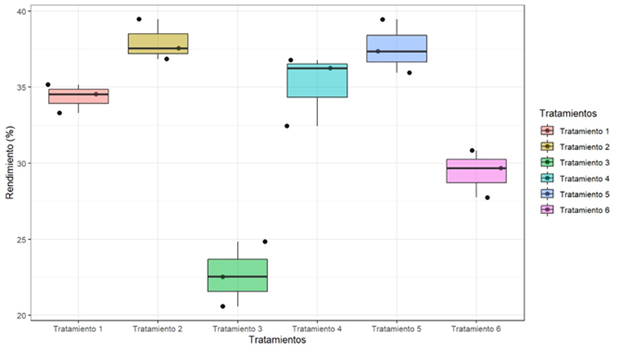
Respecto a los rendimientos de los tratamientos, las tablas 3 y 4 muestran los resultados obtenidos en cada tratamiento, donde se observa que el tratamiento 2 arroja un 37.95% de rendimiento y el tratamiento 5 un 37.57 % en el producto final, ambos tratamientos presentan una media de sus promedios casi similares como se observa en el gráfico 1.
El análisis de varianza realizado, permitió la interacción de los diferentes rendimientos obtenidos en los tratamientos, en la tabla 4 se detallan los estadísticos el cual reporta diferencias estadísticas significativas (P<0.05**) y que las medias de las repeticiones para cada tratamiento son diferentes.
Tabla 3 - Análisis de varianza del rendimiento obtenido al final de los tratamientos
| Origen de las variaciones | Suma de cuadrados | Grados de libertad | Promedio de los cuadrados | F | Probabilidad | Valor crítico para F |
|---|---|---|---|---|---|---|
| Entre grupos | 514.02965 | 5 | 102.80593 | 33.4380 | 1.2104E-06 | 3.10587524 |
| Dentro de los grupos | 36.8942 | 12 | 3.074516667 | |||
| Total | 550.92385 | 17 |
Fuente: elaboración propia.
Para determinar estadísticamente la diferencia de los rendimientos se aplicó la prueba de Tukey, los resultados de la tabla 4 muestran las diferencias de las medias para cada tratamiento con su intervalo respectivo y los valores para cada contraste con respecto al porcentaje de rendimiento obtenido, tomando en consideración los tratamientos con mayor rendimiento se contempla el T2 y T5, los cuales presentan un nivel de significancia menor al p-value y como se observa en la tabla, sus medias promedio son estadísticamente similares, por tal razón se pone en consideración estos dos tratamientos como los más eficientes.
Tabla 4 - Resultados de la prueba de Tukey aplicado al rendimiento obtenido al final de los tratamientos
| Tratamientos | Diferencias de las medias | Intervalo 1 | Intervalo 2 | P valor |
|---|---|---|---|---|
| T2 - T1 | 3.6166667 | -1.192198 | 8.4255315 | 0.1908364 |
| T3 - T1 | -11.6700000 | -16.478865 | -6.8611352 | 0.0000358 |
| T4 - T1 | 0.8166667 | -3.992198 | 5.6255315 | 0.9912473 |
| T5 - T1 | 3.2400000 | -1.568865 | 8.0488648 | 0.2794780 |
| T6 - T1 | -4.9133333 | -9.722198 | -0.1044685 | 0.0442398 |
| T3 - T2 | -15.2866667 | -20.095531 | -10.4778018 | 0.0000021 |
| T4 - T2 | -2.8000000 | -7.608865 | 2.0088648 | 0.4175583 |
| T5 - T2 | -0.3766667 | -5.185531 | 4.4321982 | 0.9997782 |
| T6 - T2 | -8.5300000 | -13.338865 | -3.7211352 | 0.0007258 |
| T4 - T3 | 12.4866667 | 7.677802 | 17.2955315 | 0.0000178 |
| T5 - T3 | 14.9100000 | 10.101135 | 19.7188648 | 0.0000027 |
| T6 - T3 | 6.7566667 | 1.947802 | 11.5655315 | 0.0051076 |
| T5 - T4 | 2.4233333 | -2.385531 | 7.2321982 | 0.5603277 |
| T6 - T4 | -5.7300000 | -10.538865 | -0.9211352 | 0.0168895 |
| T6 - T5 | -8.1533333 | -12.962198 | -3.3444685 | 0.0010825 |
Fuente: elaboración propia.
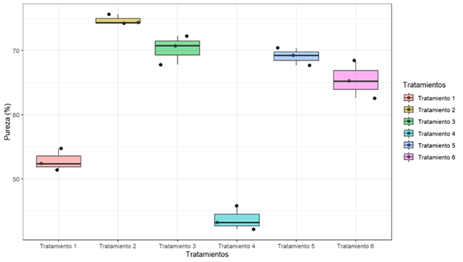
Relacionado con el porcentaje de pureza de celulosa obtenida, los tratamientos presentan una pureza de celulosa superior al 50%, siendo el tratamiento 2 el de mayor con un 74.74 % y el 4 de menor según sus medias.
El análisis de varianza realizado, permitió la interacción de los datos obtenidos en los tratamientos con respecto a la pureza de la celulosa, en la tabla 5 se detallan los estadísticos el cual reporta diferencias estadísticas significativas (P<0.05**) y que las medias de las repeticiones para cada tratamiento son diferentes. En figura 2 se muestra el reporte de estas diferencias.
Tabla 5 Análisis de varianza del porcentaje de pureza de celulosa obtenido al final de los tratamientos
| Origen de las variaciones | Suma de cuadrados | Grados de libertad | Promedio de los cuadrados | F | Probabilidad | Valor crítico para F |
|---|---|---|---|---|---|---|
| Entre grupos | 1922.753267 | 5 | 384.5506533 | 8.7117197 | 0.001095492 | 3.10587524 |
| Dentro de los grupos | 529.7011333 | 12 | 44.14176111 | |||
| Total | 2452.4544 | 17 |
Fuente: elaboración propia.
 Fuente: elaboración propia.
Fuente: elaboración propia.Fig. 2 - Gráfico comparativo del porcentaje de pureza de cada tratamiento
El método de comparaciones múltiples (Tukey) aplicado para los resultados del % de pureza de celulosa de cada tratamiento se observa en la tabla 6, permite crear intervalos de confianza para todas las diferencias en parejas entre las medias de cada intervalo, donde se observa un valor significativo del tratamiento T2 con el resto, siendo este en el que se obtiene mayor pureza de celulosa.
Tabla 6 - Resultados de la prueba de Tukey aplicado al del porcentaje de pureza de celulosa obtenido al final de los tratamientos
| Tratamientos | Diferencias de las medias | Intervalo 1 | Intervalo 2 | P valor |
|---|---|---|---|---|
| T2 - T1 | 21.940000 | 16.604756 | 27.2752436 | 0.0000001 |
| T3 - T1 | 17.446667 | 12.111423 | 22.7819103 | 0.0000015 |
| T4 - T1 | -9.103333 | -14.438577 | -3.7680897 | 0.0010240 |
| T5 - T1 | 16.283333 | 10.948090 | 21.6185769 | 0.0000032 |
| T6 - T1 | 12.620000 | 7.284756 | 17.9552436 | 0.0000463 |
| T3 - T2 | -4.493333 | -9.828577 | 0.8419103 | 0.1193178 |
| T4 - T2 | -31.043333 | -36.378577 | -25.7080897 | 0.0000000 |
| T5 - T2 | -5.656667 | -10.991910 | -0.3214231 | 0.0355803 |
| T6 - T2 | -9.320000 | -14.655244 | -3.9847564 | 0.0008320 |
| T4 - T3 | -26.550000 | -31.885244 | -21.2147564 | 0.0000000 |
| T5 - T3 | -1.163333 | -6.498577 | 4.1719103 | 0.9737846 |
| T6 - T3 | -4.826667 | -10.161910 | 0.5085769 | 0.0850050 |
| T5 - T4 | 25.386667 | 20.051423 | 30.7219103 | 0.0000000 |
| T6 - T4 | 21.723333 | 16.388090 | 27.0585769 | 0.0000001 |
| T6 - T5 | -3.663333 | -8.998577 | 1.6719103 | 0.2630432 |
Fuente: elaboración propia.
Luego de la valoración experimental de los tratamientos según su rendimiento y porcentaje de pureza se considera el tratamiento 2 como el más eficiente.
Las propiedades del producto se determinaron de acuerdo a las normas INEN (Instituto Ecuatoriano de Normalización) y en combinación con las normas ANSI (American Society for Testing and Materials) y TAPPI (Technical Association for the Pulp and Paper Industries), cuyas características son: ceniza 1.8%, pureza de celulosa 74.74%, humedad 4.3%, pH 6.8, insolubilidad en CH₃COOH 20%, NaClO 5%, H2SO4 15%, HCl 10%, etanol 98% y agua.
El tamaño de partícula es de aproximadamente 0.1050 mm al pasar más del 50% por una malla de 140, según (Cordero et al., 2013; Pineda & Navarrete, 2017) el tamaño de la celulosa microcristalina (Figura 3) para el comercio debe de tener las siguientes especificaciones: +60 malla < 1.0 % y en malla + 200 < 30 %, estando dentro del rango el producto obtenido en la investigación.
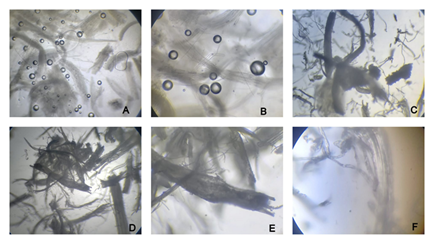 Nota: A = 4x, B=10x, C y D =40x, E= 80x, F= 100xFuente: elaboración propia.
Nota: A = 4x, B=10x, C y D =40x, E= 80x, F= 100xFuente: elaboración propia.Fig. 3 - Vista de la celulosa microcristalina desde el microscopio
La comparación se llevó a cabo bajo las especificaciones establecidas por el Reglamento (CE) n°1333/2008 del Parlamento Europeo y del Consejo, de 16 de diciembre de 2008, sobre aditivos alimentarios, con respecto a la celulosa microcristalina, esta cumple con parámetros de pH, humedad y solubilidad, lo contrario para los parámetros de pureza y % de cenizas para poder ser grado alimenticio o farmacéutico según las características estipuladas por (Europea, 2008). Dado producto se deja abierto a la posibilidad de estudio en campos industriales diferentes a los ya mencionados.
Discusión
Los resultados obtenidos se corresponden con los que exponen Jaramillo et al. (2014). Según estos autores, la melaza obtenida de la hidrólisis de la sacarosa y el consumo de glucosa y fructosa, muestran un comportamiento importante, que se evidencia en el declive de los monosacáridos durante la producción de la celulosa. Entre el principio y el final del experimento, el consumo de fructosa para la concentración de 13,3 % se encontró desde 20,59 % hasta concentraciones mínimas de 3,7 % mostrando un máximo descenso entre los 0 y 3 días, y una estabilidad entre los días 7 y 14; no obstante, la concentración de 26,6 % para el tiempo inicial, constaba de 22,39 % de fructosa y el consumo final corresponde a una cantidad de 6,89 %.
El consumo de glucosa fue disminuyendo a medida que transcurrían los tiempos de incubación, comportamiento similar al de fructosa; el mayor descenso se observó en los primeros días de producción, 0 a 3 días, para ambas concentraciones. Para el primer y último día de síntesis con respecto a 13,3 % los valores se encontraron en un rango de 19,23 % a 0,21 %; para 26,6 % los valores de estos mismos días se encontraron entre 20,43 % y 4,32 %. De acuerdo a esto se puede decir que el consumo de glucosa al final del proceso disminuyó en un 90 % con respecto a su concentración inicial.
Del mismo modo el estudio es compatible con el aporte de Caicedo et al. (2011) quienes obtienen que, para alturas superiores de líquido, existirá un volumen no aprovechado, posiblemente limitado por la transferencia de masa, y para inferiores, se reduciría la producción de celulosa por ocupar todo el volumen líquido disponible. Lo anterior se corroboró graficando el espesor relativo de la película húmeda, definido como la relación entre el espesor de la película húmeda y la altura del líquido, contra la relación área/volumen del líquido. Para un valor límite de espesor relativo de película húmeda de 1, donde la altura de la película es igual a la altura del líquido, el área por unidad de volumen es 1,1 cm', pero el límite práctico obtenido que no afecta el rendimiento de celulosa por unidad de área es de 0,8 crn', aproximadamente.
Conclusiones
El experimento formativo es entendido como aquel experimento que permite someter la propuesta, integralmente, a validación en la práctica formativa. En la investigación realizada se somete a valoración científica la obtención de celulosa microcristalina mediante la citada forma de experimentación.
La caracterización del pasto elefante (Pennisetum Purpureum) se realizó mediante métodos físicos-químicos de acuerdo a las normas del Technical Association of Pulp and Paper Industry (TAPPI), con resultados de: humedad 79.2%, ceniza 13.30%, hemicelulosa 29.75%, lignina 9.53%, celulosa 37.26% y sustancias extraíbles 20.61% en porcentaje de peso, estos se encuentran dentro de los márgenes del tipo de material vegetal, por el contenido de material lignocelulósico y aspectos biológicos de la especie, como la rápida madurez que alcanza la fibra vegetal en tiempo, es considerado como una fuente para la extracción de pulpa de celulosa.
Las variables y parámetros identificados en la obtención de la celulosa microcristalina en el laboratorio que permitieron un rendimiento del 37.95%, fueron la utilización de hidróxido de sodio al 20%, temperatura de 60°C, tiempo 120 minutos en la hidrolisis alcalina y en el blanqueo de la pulpa, hipoclorito de sodio al 5%, temperatura 25°C por 300 minutos, parámetros controlados para evitar irregularidades en el proceso y producto final.
La celulosa microcristalina obtenida a partir del Pennisetum Purpureum, cumple con parámetros de pH, humedad y solubilidad, lo contrario para los parámetros de pureza y % de cenizas para poder ser grado alimenticio o farmacéutico, pero se deja abierta la posibilidad de estudio en campos industriales diferentes a los ya mencionados.