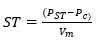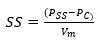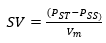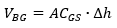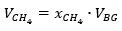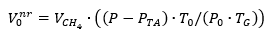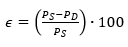Introducción
La creciente demanda de energía por parte de la sociedad genera la necesidad de contar con un suministro constante y abundante de recursos energéticos. No obstante, esta creciente demanda no es acompañada por una oferta suficiente de estos recursos, ya que son explotados de manera masiva para cubrir las necesidades humanas (Feng & Zheng, 2022). El uso de fuentes convencionales de energía como el carbón, el petróleo y el gas natural son limitadas y perjudiciales para el medio ambiente (Adams et al., 2020). En cambio, la energía sostenible, proveniente de fuentes naturales renovables como la solar, viento, agua o biomasa, está siempre disponible y su explotación resulta amigable con el medio ambiente (Adams et al., 2018).
En tal escenario, destaca el uso del biogás, el cual ofrece diversos beneficios, incluyendo la reducción de las emisiones de gases de efecto invernadero como el CO2, CH4 y compuestos orgánicos volátiles, así como la prevención de la generación de lluvia ácida al disminuir la emisión de óxidos de azufre (SOx) y óxidos de nitrógeno (NOx) a la atmósfera. Además, la digestión de la materia orgánica produce subproductos, que pueden ser aprovechados como fertilizantes naturales, reduciendo la necesidad de fertilizantes químicos y evitando la acumulación de metales pesados en las aguas subterráneas y la calidad del suelo. El biogás también tiene aplicaciones potenciales en la generación de calor, electricidad o combustible para vehículos (Grima-Olmedo et al., 2014).
Otra de las bondades del uso del biogás, radica en que este combustible se obtiene a partir del procesamiento de residuos orgánicos (RO), los cuales constituyen productos de procesos de producción o consumo que ya no serán utilizados por parte de quien los genera. El adecuado tratamiento de los RO contribuye también a la protección de la salud humana, el medio ambiente y la conservación de los recursos.
Por tanto, la producción de biogás se presenta como uno de los métodos recomendados para la gestión y eliminación de residuos orgánicos. Dado que estos residuos son biodegradables, por lo que pueden descomponerse en moléculas simples que las plantas pueden utilizar. La descomposición ocurre debido a la acción de bacterias y otros microorganismos a partir de procesos de digestión aeróbica (en presencia de oxígeno) o anaeróbica (ausencia de oxígeno), de este último se obtiene un biogás rico en metano (Falcone et al., 2020). Al final del proceso de DA de los RO, se obtiene un fertilizante de alto valor agregado (digestato).
La digestión anaeróbica es un proceso biológico complejo durante el cual, la materia orgánica se descompone por la actividad de microorganismos llamados bacterias metano, en un medio libre de oxígeno. El proceso lleva a cabo en artefactos denominados biodigestores, y se divide básicamente en cuatro etapas diferentes: hidrólisis, acidogénesis, acetogénesis y metanogénesis (Falconer et al., 2020; Kumar & Samadder., 2020).
La hidrólisis es la primera y la más lenta etapa del proceso, en la que la materia orgánica compleja se descompone en moléculas orgánicas solubles (monómeros disueltos), como azúcar, aminoácidos o ácidos grasos. Durante la acidogénesis, también llamada fermentación, los productos de la etapa anterior se convierten en una variedad de pequeños compuestos orgánicos principalmente ácidos grasos de cadena corta (AGCC), como acetato, alcoholes, ácidos orgánicos, además de H2, CO2 y NH3. Mediante la acetogénesis, los AGCC se convierten en ácidos acéticos, CO2 y H2 por la actividad de las acetobacterias. Por último, durante la metanogénesis, se obtiene el biogás a partir del ácido acético, debido a la intervención bacterial.
Cada una de las cuatro etapas de la digestión anaerobia tiene una velocidad diferente en función de las condiciones de funcionamiento y de la concentración de sustrato. Además, están influenciadas por diferentes factores, como temperatura, pH, demanda biológica de oxígeno (DBO), demanda química de oxígeno (DQO), contenido de nitrógeno (TKN), inóculo y sustrato, que requieren un control definido para que los microorganismos implicados no se vean perjudicados.
Cuando estos factores son monitoreados y controlados adecuadamente pueden contribuir a la optimización de la actividad de los microorganismos, aumentando así la producción de metano. El funcionamiento adecuado de la fermentación anaerobia requiere un equilibrio entre la población de microorganismos, el suministro de sustrato y el control de la temperatura y el pH (Kuczman et al. 2018).
A partir de la consulta de los referentes, se pudo constatar que son diversos los estudios respecto a la producción de biogás mediante DA, sin embargo, sus mayores aplicaciones se observan a partir del uso de residuos orgánicos ganaderos en Ecuador, mientras que su articulación con la gastronomía y el uso de la fracción orgánica de residuos urbanos (FORU), es limitada (Falconer et al., 2020
A pesar de la necesidad demostrada y las bondades del uso de energías renovables como el biogás, la dependencia excesiva de energías fósiles es un problema para satisfacer las necesidades energéticas nacionales en la República de Ecuador. Esto representa a la vez que una amenaza, un desafío, ya que el incremento de las capacidades de generación no es proporcional a la creciente demanda energética del país.
Otro factor desestimulante del uso del biogás y otras fuentes renovables de energía en Ecuador, radica en el subsidio al gas GLP. Una familia promedio gasta alrededor de 20 USD al año en GLP, lo que disminuye el atractivo del biogás generado por los biodigestores como sustituto. En este sentido, en la República de Ecuador se debe promover el uso del biogás no solo como sustituto del GLP en la cocina, sino también para otros fines productivos, como accionar maquinarias o generar electricidad para consumo propio (Herrero et al., 2017).
Según Pino Peralta (2019), Ecuador ocupa el primer lugar como el principal productor a nivel mundial de cacao fino y de aroma, representando el 61% de la oferta global. En la región Sierra, se concentran las mayores plantaciones del cultivo, siendo el cantón de Maná, representativo del cultivo de diversas variedades de cacao en la región. Según Carreño Vesga (2023), la cáscara de cacao se ha investigado como una materia prima potencial para la producción de energía renovable. Se han realizado varios experimentos para explorar su reutilización y se ha demostrado que puede ser una biomasa viable para ese propósito.
De ahí que, la DA se considere como una opción para gestionar los residuos orgánicos de cosechas agrícolas (ROC), en fincas cacaoteras, del cantón la Maná. El presente estudio tiene como objetivo evaluar la eficiencia energética del biogás obtenido a partir de la digestión anaerobia de la cáscara de cacao, mediante la evaluación de los parámetros físico-químicos del proceso y del contenido de metano (CH4) en el producto final.
Se pretende así incentivar el uso de las energías renovables en Ecuador, fomentar la instalación plantas de biogás en fincas de cacao, como fuentes de energías renovables y para la gestión eficiente de la fracción orgánica de los residuos urbanos.
Materiales y métodos
El estudio realizado es de tipo cuasi-experimental, el cual consistió en evaluar, a nivel de laboratorio, la producción de biogás y metano (CH4) de tres combinaciones diferentes de sustratos elaborados a partir de residuos de cosechas de cacao (cáscara del fruto), en una finca cacaotera del cantón La Maná. En la figura 1 se muestra una porción del material acumulado en la finca.
El sustrato está compuesto, en mayor medida, por cáscaras, mazorcas y semillas desechados por mala calidad. Se utilizaron como reactores experimentales, 3 botellas plásticas construidas de Polietileno Tereftalato (PET, reciclaje de envases de agua natural comercial).
En cada reactor, se añadieron 3 L de agua y se colocó una mezcla diferente de residuos de la cosecha, en las proporciones que se muestran en la tabla 1. Se utilizó estiércol bovino seco como inóculo para el proceso de DA en cada reactor, en una cantidad equivalente al 10% del RO total utilizado. Con esta proporción, de Oliveira (2017) obtuvo los mejores resultados en su investigación. El inóculo se introdujo en la primera carga de los digestores, posteriormente solo se añadieron residuos de la cosecha. Los reactores se colocaron en el laboratorio a temperatura ambiente, por lo que funcionaron en un rango mesófilo durante el periodo de evaluación (23ºC -27ºC).
Tabla 1 - Contenido de RO en cada reactor
| Reactor 1 | Reactor 2 | Reactor 3 | ||||
|---|---|---|---|---|---|---|
| Tipo de RO | ROC | Inóculo | ROC | Inóculo | ROC | Inóculo |
| Cantidad | 900g | 100g | 800g | 200g | 700g | 300g |
Fuente: Elaboración propia
Tras la clasificación y mezcla, el material se diluyó en una proporción de 1 kg de RO crudo (incluido el inóculo) por cada 3 L de agua (1:3) como se aprecia en la tabla 1. El RO se trituró en una máquina industrial, hasta alcanzar un tamaño de partícula inferior a 8 mm (Agyeman & Tao, 2014). El pH del sustrato se ajustó en el caso de mediciones iniciales inferiores a 6; este proceso se inició a partir del quinto día, con una solución de hidróxido de sodio (NaOH).
A continuación, se suministró el sustrato a cada biodigestor, y se operó en un sistema semicontinuo en dos periodos de tiempo de retención hidráulica (TRH), 30 y 60 días. El TRH de 30 días (aclimatación), se operó hasta la quinta semana; el TRH de 60 días (estabilización), comenzó después de la sexta semana, al inicio del cual se añadieron 2kg de RO, en proporciones equivalentes a las iniciales. Estos dos TRH se adoptaron inicialmente para facilitar la puesta en marcha del biodigestor y la adaptación de los microorganismos al medio.
Para medir los principales parámetros físico-químicos que caracterizan la digestión anaerobia, se aplicaron los métodos normalizados para el análisis del agua y de las aguas residuales (Ding, 2023). En la Tabla 2 se presentan los métodos normalizados de caracterización utilizados en la evaluación del proceso de biodigestión.
Tabla 2 - Parámetros físico-químicos evaluados en la operación de digestión anaerobia de los residuos.
| Fracción | Variable | Dimensionalidad | Método | Frecuencia |
|---|---|---|---|---|
| Gas | Producción de biogás | L | Instrumental | Diaria |
| Semi sólida | pH | mgL-1 | Potenciométrico | Semanal |
| DQO | mgL-1 | Reflujo cerrado | Semanal | |
| DBO | mgL-1 | Manométrico | Semanal | |
| ST | mgL-1 | Gravimétrico | Semanal | |
| SV | mgL-1 | Gravimétrico | Semanal | |
| SS | mgL-1 | Gravimétrico | Semanal | |
| TKN | mgL-1 | Digestión Nessler | Semanal | |
| Volumen de digestato | L | Instrumental | Semanal |
Fuente: Elaboración propia
Las variables estudiadas son Nitrógeno Kjeldahl Total (TKN), Demanda Química de Oxígeno (DQO), Demanda Bioquímica de Oxígeno (DBO), Sólidos Totales (ST), Sólidos Volátiles (SV) y Sólidos Sedimentables (SS). Se realizó además un seguimiento diario a la temperatura y el pH del sistema.
Principales dispositivos utilizados para realizar las mediciones y sus bondades
Para realizar las mediciones, se utilizaron los siguientes dispositivos:
Balanza de precisión CAS CBL. La balanza de precisión CAS CBL ofrece una alta precisión en la medición de peso; permite obtener resultados exactos y confiables. Además, cuenta con una capacidad de carga adecuada para diversos usos, lo que la hace versátil y funcional para su utilización en el pesaje de RO.
Frasco Wynkler DBO de 300 ml, de vidrio de borocilicato, Marca Wheaton. Se recomiendan botellas de 300 ml para la prueba de DBO a la que se hace referencia en Standard Methods for the Examination of Water and Wastewater, 18ª edición (Ding, 2023). Estos frascos presentan boca ensanchada, así forman un sello de agua alrededor de los tapones y evitan que el aire se introduzca durante la incubación. Los tapones de vidrio de borosilicato intercambiables tienen bases cónicas que previenen la retención de aire. La junta del tapón se adapta a las sondas de los principales medidores de DBO y oxígeno disuelto.
Tester de pH HI981004, de Hanna Instruments, resulta adecuado para medir el pH y la temperatura de soluciones acuosas, por lo que puede ser utilizado para evaluar el pH y la temperatura del sustrato de un digestor o del digestato.
Fotómetro HI83325, Marca HANNA. Este fotómetro compacto multiparamétrico es ideal tanto para laboratorios como para uso en el campo. Utiliza un detector de referencia y una lente de enfoque que le permiten eliminar errores ocasionados por cambios en la fuente de luz y las imperfecciones de la celda de vidrio, garantizando resultados precisos y confiables. Su portabilidad y diseño compacto lo convierten en una herramienta versátil y conveniente para las mediciones realizadas en la presente investigación.
Estufa digital marca Memmert, modelo universal. Las estufas de esta marca son reconocidas por su calidad y confiabilidad en el ámbito de la investigación científica. Ofrecen un control preciso de la temperatura y una distribución uniforme del calor, lo que garantiza un secado eficiente y preciso. Además, su diseño robusto y seguro proporciona un entorno adecuado para el tratamiento térmico de los materiales orgánicos en el laboratorio.
Cromatógrafo de gases Agilent 7890A, adecuado para evaluar el contenido de metano (CH4) y dióxido de carbono (CO2) en biogás debido a sus características sobresalientes. Ofrece una excelente sensibilidad y precisión en la detección de ambos componentes, lo que permite mediciones precisas y confiables. Además, su capacidad de respuesta rápida y su amplio rango de detección aseguran una evaluación eficiente del biogás. La interfaz de usuario intuitiva y el software de control fácil de usar simplifican su operación.
Métodos de medición y cálculo aplicados
La DQO se determinó con el Fotómetro HI83325, mediante el método del dicromato de potasio (K2Cr2O7). Este método se basa en la oxidación de la materia orgánica presente en la muestra de agua utilizando el dicromato de potasio como agente oxidante. Se prepararon muestras de 100 ml, a las que se agregó dicromato de potasio para oxidar la materia orgánica. Luego, se utilizó el fotómetro para medir la absorbancia de la muestra a una longitud de onda específica y se relacionó con la concentración de oxígeno presente. Los análisis de DBO se realizaron según el método SMEWW 5210 B. En esta investigación se usó también el Fotómetro HI83325 para medir la DBO, pero siguiendo el método mencionado, las muestras se almacenaron en frascos Wynkler de 300 ml, después de la dilución y se incubaron durante cinco días en un frigorífico a 20 °C.
El contenido de nitrógeno total Kjeldahl (TKN) en el rango de 0 a 1500 mg/L se analizó utilizando el método de digestión de Nessler adaptado para agua, lodos y aguas residuales. La digestión de las muestras se llevó a cabo utilizando un digestor modelo Digesdahl de Hach. Posteriormente, se realizó la lectura de las muestras utilizando un colorímetro Hach DR/890.
El análisis de ST se realizó mediante el método gravimétrico, que consiste en secar las muestras en la estufa a 103 °C - 105 °C hasta peso constante. Los ST se calculan mediante la ecuación 1:
(1)
Donde ST es la concentración total de sólidos (mg∙L-1 ); Pc es el peso del crisol (mg), PST es el peso del crisol que contiene la muestra seca (mg), y Vm es el volumen de la muestra (L). La determinación del SS se basó en la sedimentación de residuos sólidos en suspensión en un cono Imhoff de 1 L. Las muestras se dejaron reposar durante 1 h para la sedimentación de los sólidos, y la lectura se realizó en la escala graduada de la pared del cono.
Tras la separación, el sólido se calcinó a 550 ºC, en la estufa durante 1 hora. La masa de sólido seco obtenida en la estufa, se pesó usando la balanza electrónica. Para calcular la concentración de SS se aplicó la ecuación 2.
(2)
Donde SS es la concentración de los sólidos sedimentables (mg∙L-1 ) y PSS es el peso del crisol con la muestra calcinada (mg).
Para calcular los SV, se restó a la masa de sólidos totales la masa de los sólidos sedimentables, como se indica en la ecuación 3. La diferencia entre los sólidos totales y los sólidos sedimentables determina la concentración de sólidos volátiles.
(3)
Donde SV es la concentración de sólidos volátiles.
Para medir la producción diaria de biogás, se utilizó un gasómetro de desplazamiento de agua, de 10 L de capacidad. El volumen del gas puede medirse como equivalente al desplazamiento del gasómetro, por lo que se calculó mediante la ecuación 4.
(4)
Donde VBG es el volumen de biogás (cm3), ACGS es el área de la sección circular del gasómetro (cm2), y ∆h el nivel (distancia) del desplazamiento del agua del gasómetro, causado por el biogás (cm).
Para la caracterización del biogás en cuanto a su composición de CH4 y CO2, se aplicó la cromatografía de gases, inyectando muestras de biogás en el cromatógrafo de gases Agilent 7890A. El volumen de metano se calculó mediante la Ecuación 5.
(5)
Donde V CH 4 es el volumen de metano (cm3), 𝑥 𝐶𝐻 4 la concentración de metano en el biogás, y 𝑉 𝐵𝐺 es el volumen de biogás o el volumen del gasómetro (cm).
El volumen final normalizado de biogás y producción de metano se ajustó teniendo en cuenta la temperatura y presión estándar mediante la ecuación 6.
(6)
Donde V0 dr es el volumen de gas normalizado en condiciones estándar (cm3), V es el volumen de gas medido (cm3), P es la presión en fase gaseosa en la medición (hPa), PTA es la presión de vapor de agua en función de la temperatura ambiente (hPa), T0 es la temperatura estándar (K), P0 es la presión estándar (hPa) y T es la temperatura del gas (K).
La eficiencia media de eliminación "Ԑ" (%) de los factores más relevantes del proceso (DQO, DBO, ST, SV y SS) al final del proceso de DA, se calculó mediante la Ecuación 7.
(7)
El potencial energético del biogás producido en la DA, se calculó energéticamente considerando la producción de energía eléctrica en un sistema de motor de combustión interna (MCI) y la sustitución del Gas Licuado de Petróleo (GLP). Según plantean Lusiana et al., (2021), el valor calorífico de 1,0 m3 de biogás equivale a 6 kWh de energía eléctrica y a 0,46 kg de GLP.
Se utilizó una hoja de cálculo de Microsoft Excel, para el procesamiento estadístico descriptivo de las muestras, así como para determinar la correlación entre la concentración de metano y los parámetros de composición del sustrato según la proporción de cada RO, así como respecto a DQO, DBO, y TKN. A continuación, se muestran los principales resultados del estudio realizado.
Resultados y discusión
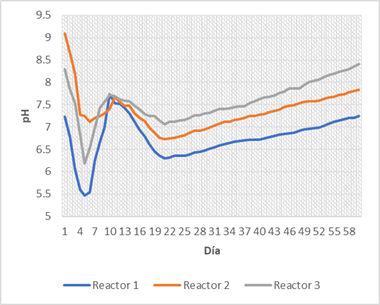
Los resultados mostrados solo incluyen la segunda fase del experimento, en la que se asume un comportamiento regular y estable de los digestores al recibir el sustrato. A partir del análisis de la figura 2, se puede observar el comportamiento del pH de los tres reactores.
Todos los reactores verificaron una caída del pH hasta el 5to día. El reactor 3 presentó el mayor descenso, con una disminución de 2,11 puntos de pH. Este descenso se explica por la degradación de la materia orgánica y la formación de ácidos orgánicos y ácidos grasos volátiles en los primeros días del proceso. Para evitar la afectación del medio ácido al correcto desarrollo de los sistemas, se realizó un ajuste del pH mediante adición de hidróxido de sodio en los siguientes cinco días. Se produce luego una nueva caída de los valores debido a la detención del proceso de ajuste.
Hasta el día 20 se observa que la disminución ocurre a un ritmo más lento y en rango menor que el experimentado en los primeros 5 días de funcionamiento. El mayor descenso se registra en el reactor 1, con una variación de 1,37 puntos de pH. Después de este tiempo, se aprecia un autoajuste del pH, debido al agotamiento de los ácidos formados en las primeras etapas.
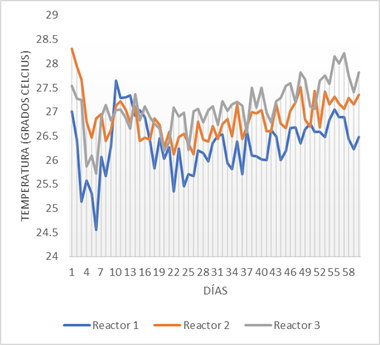
El control de temperatura permitió verificar la intensificación de la actividad bacteriana, estimulada por los ambientes neutros y básicos verificados anteriormente. En la figura 3 se puede observar los movimientos térmicos de cada reactor.
Nótese que los incrementos de temperatura ocurren a partir de los procesos de ajuste y autoajuste de la basicidad de los sistemas (día 6 y 21). El tercer reactor, que verificó el mayor aumento de pH en los últimos días, muestra igualmente un mayor incremento de la temperatura, lo cual indica una mayor ocurrencia de reacciones exotérmicas provocadas por la acción degradativa de las bacterias y, por ende, una mayor actividad y calidad de estas (Kumar & Samadder, 2020). El resto de los parámetros se midieron en intervalos semanales.
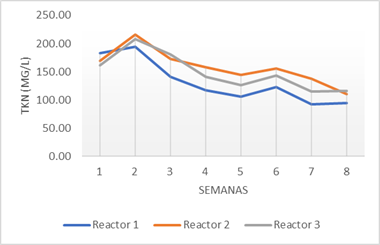
Los niveles de nitrógeno total en el digestato comenzaron a aumentar durante la primera semana de la estabilización. Esta acumulación de TKN puede estar relacionada con la introducción de un nuevo residuo rico en proteínas. En general, los residuos alimentarios son abundantes en nitrógeno, principalmente debido a la presencia de proteínas (Prandi et al., 2019). En la figura 4 se muestran las mediciones semanales de TKN registradas.
La gráfica muestra una disminución final de los niveles de nitrógeno para todos los reactores. Aunque se espera que este sea el resultado óptimo, algunos investigadores como Morales-Polo et al., (2019), registraron incrementos de los niveles de nitrógeno, aunque no se vio afectada la producción de metano. Esto se debe a la presencia de microorganismos resistentes al amoníaco en el sustrato, con alta permeabilidad en la membrana celular bacteriana. Estos microorganismos toleran altas concentraciones de amoníaco, por lo que contribuyen la degradación del sustrato y la producción de biogás aún en condiciones de alta presencia de nitrógeno.
El proceso de digestión anaerobia fue altamente eficiente en la reducción de la carga orgánica, tanto para DQO como para DBO. La degradación de la materia orgánica por parte de los microorganismos, se evidenció en el comportamiento similar observado entre DQO y DBO a lo largo del proceso. En la tabla 3 se muestran los diferentes valores para cada sustrato, así como la reducción porcentual alcanzada.
Tabla 3 - Reducción de la carga orgánica mediante la digestión
| Semana | DQO | DBO | ||||
| Reactor 1 | Reactor 2 | Reactor 3 | Reactor 1 | Reactor 2 | Reactor 3 | |
| 1 | 25307,03 | 28509,88 | 26267,97 | 26466,2227 | 25569,97 | 27053,0335 |
| 2 | 20773,90 | 24304,86 | 21880,25 | 22547,5601 | 20438,2629 | 21372,4653 |
| 3 | 14841,12 | 19095,23 | 17781,54 | 16579,7984 | 16226,7801 | 15825,4804 |
| 4 | 10281,87 | 14053,86 | 11969,14 | 12431,8152 | 10668,344 | 10176,1714 |
| 5 | 8503,92 | 12503,30 | 10190,88 | 10788,4295 | 9598,15143 | 8726,72168 |
| 6 | 6942,84 | 10882,05 | 8401,50 | 8419,00394 | 7917,28469 | 7423,03223 |
| 7 | 5292,55 | 8952,30 | 7214,37 | 7191,86317 | 6557,99661 | 6211,03657 |
| 8 | 4256,27 | 7381,73 | 5637,72 | 5655,85203 | 5211,49503 | 4348,05745 |
| Reducción (%) | 83,18% | 74,11% | 78,54% | 78,63% | 79,62% | 83,93% |
Fuente: Elaboración propia
Se observan valores relativos de eliminación superiores al 74%, con cerca de un 84% de eliminación por actividad biológica en el caso del reactor 3. La DBO presentó un comportamiento similar a la DQO, como se muestra en la tabla 3, lo cual indica que hubo una gran degradación de la materia orgánica del sustrato por parte de los microorganismos. Estos resultados demuestran la efectividad del AD en la degradación de sustratos orgánicos provenientes del restaurante estudiado.
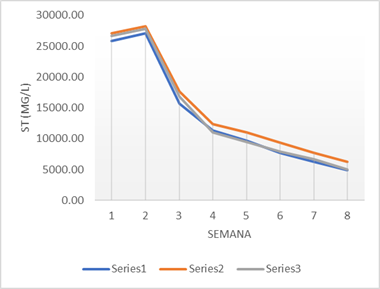
También se puede verificar la eficiencia de los reactores en la degradación de la materia orgánica, mediante el cálculo de ST y SV, como se muestra en las figuras 5 y 6 respectivamente. Los resultados revelan una considerable presencia de materia orgánica en el proceso, con una degradación continua, debido a la actividad constante de los microorganismos. A medida que avanza la digestión anaerobia, se observa una mayor adaptación de los microorganismos, lo que conduce a una mayor capacidad de degradación del sustrato, incluso ante cambios en su composición (Grima-Olmedo et al., 2014; Kumar & Samadder, 2020).
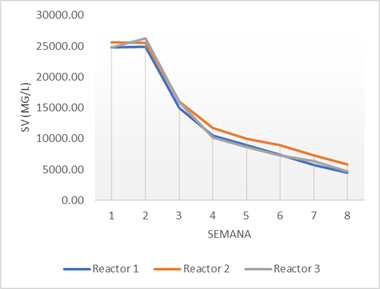
Fig. 6 - Sólidos medidos en el sustrato durante el proceso de digestión anaerobia. Sólidos volátiles
Como se puede apreciar, los sólidos volátiles replican el comportamiento de los sólidos totales. Esto se debe a que, como promedio, los SV representaron el 94% de los ST. La eliminación promedio resultó del 79,61 % y del 80,02% respectivamente para los ST y los SV. Un resultado similar obtuvo Esta diferencia en la eliminación de ST puede atribuirse a una evaluación de AD más prolongada y a la inclusión de alimentos cocinados y ricos en lípidos.
El análisis de la composición química proporciona una visión precisa de la calidad del biogás producido, destacando su potencial como fuente de energía renovable y su contribución al manejo sostenible de los residuos orgánicos.
Durante el proceso de digestión anaeróbica, se registró una producción significativa de biogás, con un volumen promedio diario de 1,63L y valores extremos entre 1 y 4 litros por día. La relación entre el volumen de biogás total promedio generado por reactor (118,52 L) y la cantidad de residuos promedio tratada por reactor (3kg), arroja una productividad unitaria media de 39,5 L biogás kg-1 de sustrato. Este resultado resulta inferior al obtenido por Acosta et al. (2021), los cuales alcanzaron niveles superiores (116 L biogás kg-1). Esta diferencia puede deberse la inclusión de más del 50% de inóculo de estiércol de cerdo, así como la utilización de un biodigestor profesional con agitación y el hecho de operar a una temperatura superior, cercana a los 30oC.
A continuación, en la tabla 4 se exponen los valores observados de la producción de biogás respecto a su composición química, específicamente los niveles de metano (CH4) y dióxido de carbono (CO2).
Tabla 4 - Composición química del biogás obtenido (%)
| Semana | CH4 -R-1 | CO2 R- 1 | CH4 R-2 | CO2 R-2 | CH4 R-3 | CO2 R-3 |
|---|---|---|---|---|---|---|
| 1 | 24,30 | 70,34 | 22,57 | 71,85 | 24,46 | 69,73 |
| 2 | 45,71 | 49,72 | 42,55 | 51,64 | 45,55 | 49,70 |
| 3 | 55,66 | 39,70 | 53,18 | 40,84 | 55,29 | 39,51 |
| 4 | 64,99 | 29,44 | 64,30 | 29,96 | 65,79 | 29,21 |
| 5 | 75,62 | 18,82 | 75,34 | 19,17 | 76,44 | 18,70 |
| 6 | 65,61 | 29,73 | 65,22 | 29,34 | 65,96 | 29,01 |
| 7 | 74,68 | 19,47 | 76,08 | 19,04 | 76,70 | 18,70 |
| 8 | 64,96 | 29,84 | 64,48 | 29,72 | 65,06 | 29,14 |
| Máximo | 75,62 | 76,08 | 76,70 | |||
| Promedio | 58,94 | 57,97 | 59,40 |
Fuente: Elaboración propia
El contenido de metano promedio, durante la etapa de estabilización, muestra un valor promedio general de 58,77%. El máximo valor registrado se observó en el tercer reactor, durante la penúltima semana, con un contenido del 76,70% de CH4.
A partir de los datos de este estudio es posible indicar la productividad de metano a partir de 1,0 kg de residuos alimentarios. Teniendo en cuenta la productividad de 39,5 L biogás kg-1 de ROC (de cáscara de cacao en la finca seleccionada) y un contenido de metano promedio de 58,77%, se obtiene una producción equivalente de CH4, 23,21L CH4 kg-1 de ROC.
Aplicando los valores de conversión energética, se puede deducir que se requieren aproximadamente 94 kg de residuos de la cosecha de cacao para reemplazar 1 kg de GLP. La producción anual estimada de la finca, dado su rendimiento promedio de 12,4 quintales de cacao seco y fermentado por hectárea, y su extensión de 1,8 hectáreas, se estima que alcance los 22,32 quintales anuales. Al muestrear más de 100 frutos, se determinó que la cascara constituye como promedio, el 70,31% del fruto, con una desviación estándar del 7,25%, como se muestra en la tabla 5. Un resultado similar obtuvo Acosta (2021) y Carreño Vesga (2023).
Tabla 5 - Peso de la cáscara de cacao
| Peso de la mazorca | Peso de la cáscara | Relación | |
| media | 652,57 | 460,16 | 70,31% |
| desvest | 102,11 | 96,48 | 7,25% |
La finca presenta además un índice promedio de 18 mazorcas por kilogramos de cacao seco y fermentado. Por lo tanto 22,32 qq anuales de cacao seco y fermentado, equivalen a aproximadamente 401760 mazorcas anuales, para un total 262176,52 kilogramos de mazorcas. Luego, se estima que se generen 184336,31 kilogramos de cáscara de cacao. Con esta cifra, se estima que, aproximadamente, se pueden sustituir anualmente 1968 kg de GLP, equivalente a 131 cilindros de 15 kilogramos. En cuanto a la electricidad, se pueden generar y 25,67 MWh de energía eléctrica, al año.
Conclusiones
Los biodigestores en Ecuador se utilizan principalmente en el medio rural para tratar los excrementos animales y los residuos de las cosechas. Con esta investigación se presenta el estudio de la posible aplicación de la digestión anaerobia en el tratamiento específico de los desechos de cosechas de cacao en el cantón La Maná. El estudio se desarrolló a nivel de laboratorio, para evaluar el potencial energético de estos residuos y su posible uso como sustrato para la producción de biogás.
El biogás producido reveló características similares a otros estudios reportados en la literatura, incluso en casos desarrollados en condiciones más favorables que las alcanzadas en el presente estudio. La producción del biogás registró una razón de 39,5 L biogás kg-1 de RO, y la concentración promedio de metano en el biogás resultó de 58,77%, para una producción equivalente de CH4, de 23,21L CH4 kg-1 de RO. Características que denotan la obtención de un biogás adecuado para su uso como combustible.
Los cálculos de energía equivalente mostraron que el biogás producido anualmente puede sustituir 131 cilindros de 15 kilogramos de GLP o 25,67 MWh de energía eléctrica. Estos resultados indican la viabilidad del uso de los residuos orgánicos de la cosecha de cacao, como sustrato para la digestión anaerobia, la cual se presenta como alternativa para el uso de fuentes renovables de energía en las fincas cacaoteras y la correcta gestión de los residuos orgánicos generados por esta actividad agrícola.