Introducción
Los ovinos de pelo tienen la capacidad para crecer y reproducirse en ambientes de altas temperaturas y baja disponibilidad de nutrientes. La adaptación que presentan al estrés calórico está dada por la interacción entre los mecanismos de termorregulación y la presencia de factores genéticos, eso les confiere una capacidad fisiológica para tolerar climas calientes, así como, fríos sin afectar la productividad. (Vicente et al., 2020)
La crianza y producción de ovinos en zonas rurales están adaptados a espacios pequeños, una limitada movilidad, la excesiva carga animal en las pasturas y el constante aumento en las exigencias productivas genera mayor carga de parásitos (Puicón et al., 2018).
El problema radica cuando los ovinos están en pastoreo, el clima y las condiciones ambientales son propicias para la proliferación de los parásitos gastrointestinales (Martínez-Martínez et al., 2022).
Los ovinos transforman los forrajes de baja calidad en productos como la lana, carne y otros subproductos, son propensos a infecciones parasitarias comunes, debido a que su reproducción y cría se realiza de forma colectiva con la liberación de huevos al medio a través de heces, estos se dispersan por las praderas, los alimentos se contaminan y se genera el ciclo biológico (Herrera et al., 2013). Las enfermedades parasitarias gastrointestinales es una de las problemáticas en los ovinos, así como, con repercusión en la salud animal y también económica para los productores de ovinos (Herrera-Demares et al., 2020).
A nivel del mundo, las parasitosis ovinas representan uno de los problemas más frecuentes que afectan la productividad y la economía, son producidas por helmintos (nematodos, trematodos, cestodos y protozoarios) dentro del grupo de nematodos que causan un gran impacto en ovinos se encuentran, Haemonchus sp., Trichostrongylus sp., Cooperia sp y Oesophagostonum sp.; también se hallan los protozoos del género Eimeria, todos estos provocan síntomas como diarrea, pérdida de peso, anemia, edema submandibular, problemas respiratorios y reproductivos (Bassi, 2013).
El parasitismo gastrointestinal se encuentra distribuido a nivel mundial afectando la economía de los ganaderos y de las familias campesinas (Ninamancco et al., 2021).
La importancia de las zoonosis parasitarias varía entre los países, de acuerdo con las tasas de prevalencia, así como, la posibilidad de controlarlas o erradicarlas, sin descartar que los parásitos pueden llegar a tener incidencia en humanos de manera accidental. De aquí que, es de interés en la salud pública, sobre todo en el personal que maneja a diario a los ovinos (Naquira, 2010) (Bejarano et al., 2021).
La presentación de parásitos internos es una de las causas de anemia en ovinos en condiciones de pastoreo en países templados y del trópico, particularmente el nematodo gástrico Haemonchus contortus, se aloja en el abomaso y es hematófago (Benavides et al., 2010).
La inspección mediante el método de FAMACHA es la revisión de la membrana ocular, surge en Sudáfrica, en los años 90, (FAfa MAlan CHArt, nombrado en honor a su creador Francois “Fafa” Malan),relaciona la coloración de la conjuntiva palpebral con la severidad de la anemia ocasionada por Haemonchus contortus, es útil, sencillo y económico para categorizar a los animales a través de una tabla gráfica con imágenes y grados de coloración (de 1 a 5) (Arece et al., 2015)(Mondragón-Ancelmo et al., 2019).
Una de las principales limitaciones en la producción de los ovinos son las enfermedades parasitarias, ya que pueden causar alta mortalidad, los fármacos antihelmínticos han perdido su eficacia y ello ha provocado un fenómeno conocido como resistencia antihelmíntica, en el que los parásitos adquirieron la capacidad de tolerar los tratamientos que normalmente les causaran la muerte (Medina et al., 2018).
La disminución de la eficacia de los antihelmínticos provoca la supervivencia de los parásitos, los cuales se reproducen y forman poblaciones resistentes (González et al., 2012).
En la actualidad se ha registrado un grado de resistencia de los helmintos gastrointestinales a el efecto de algunos antihelmínticos comerciales, entendiéndose que la resistencia antihelmíntica y la adquisición de antiparasitarios de costo elevado (Purroy et al., 2020).
Materiales y métodos
La presente investigación se realizó en la Provincia de Cotopaxi, Cantón Pujilí. Parroquia Guangaje, en las comunidades Tigua Ugsha Loma y Guayrapungo, que se encuentran ubicadas: Norte con las parroquias Chugchilán, Insiliví pertenecientes al cantón Sigchos y la parroquia Cochapamba perteneciente al cantón Saquisilí.
Por su ubicación geográfica la parroquia Guangaje presenta temperaturas promedias que oscilan de 9,5 °C en la zona alta y de 7 °C para la zona baja, su altitud oscila entre 3178 a 3935 m.s.n.m, y se encuentran localizadas en las siguientes coordenadas geográficas: Guayrapungo E741932, N9901711 Tigua Ugsha Loma E741519, N9898941.
En la presente investigación se aplicó una investigación descriptiva, con un enfoque cuali-cuantitativo, el diseño de la investigación fue no experimental para lo cual se calculó promedios, porcentajes, valores máximos y mínimos, los cuales se expresan en gráficos. Se muestreó 205 animales, de los cuales se recolectó las heces directamente del ano del animal para evitar la contaminación, se utilizó guantes quirúrgicos, fundas plásticas ziploc, marcadores y etiquetas, la cantidad recolectada fue de 10 g por animal, las muestras se transportaron en cooler expandido con hielo para su conservación durante su traslado y posterior análisis se lo realizó en el Laboratorio de Parasitología de la Carrera de Medicina Veterinaria de la Universidad Técnica de Cotopaxi.
Con la toma de muestras se procedió a aplicar el método FAMACHA el cuál consistió en realizar una observación directa y juiciosa sobre la coloración de las membranas de la conjuntiva del ojo, relacionado con el grado de anemia clínico debido a la infección de huevos de parásitos Haemonchus el cual dio valores numéricos de 1 a 5.
Para el análisis coproparasitario se realizó el siguiente procedimiento:
Se elaboró la solución sobresaturada de azúcar (1.280 gr. en 1 litro de agua hervida) dejando reposar y enfriar. De cada una de las muestras fecales recolectadas, siguiendo un orden sistemático se pesó cada una con ayuda de la balanza digital 5 g de heces. Luego se adicionó 30 ml de solución sobresaturada de azúcar, y se mezcló con una varilla de vidrio, hasta obtener una muestra homogénea, se colocó sobre un tamiz para filtrar las partículas de fibra y materia orgánica que se encontraban en las heces. La solución se colocó en un tubo de ensayo de 15 ml y se llevó a centrifugar a 2.500 rpm, por un lapso de 10 minutos.
Para la identificación y cuantificación de huevos de parásitos se tomó una gota del sobrenadante y se añadió al porta objetos evitando la formación de burbujas con el cubre objetos, la muestra se llevó al microscopio y se observó a 10x y 40x. En el campo visual se procedió a observar los huevos de parásitos desde el extremo superior al extremo inferior, en línea recta para desplazar la imagen ligeramente al lado izquierdo y comenzar el extremo inferior al superior, igualmente en línea recta, volviendo a repetir. Se realizó el contaje de huevos por gramo de heces de cada una de las muestras obtenidas. Se calculó la prevalencia se empleando la fórmula que se utiliza en epidemiología.
Resultados
La prevalencia de parásitos gastrointestinales fue de 82,44%, se tomaron 205 muestras, como se puede apreciar en el Gráfico 1. Prevalencia de Parásitos gastrointestinales en ovinos en la parroquia Guangaje cantón Pujilí-Ecuador.
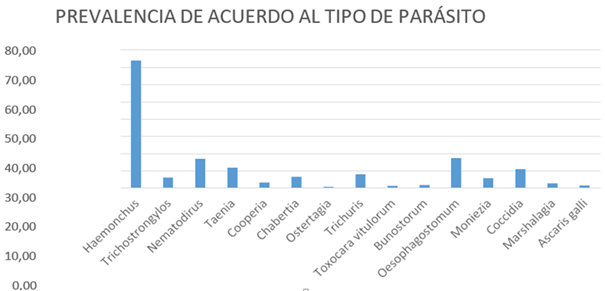
El parásito que presenta una mayor prevalencia es Haemonchus con el 73,66%, seguido por oesophagostomun con el 17,07% y nematodirus con el 16,59%. Con menor prevalencia se encontraron ostertagia 0,49% y Toxocara vitolorum con 0.98%, como se puede apreciar en el Gráfico 2. Parásito de mayor prevalencia.
Discusión
La prevalencia de parásitos gastrointestinales (Gráf. 1) fue de 82,44%, se tomaron 205 muestras, el parásito que presenta una mayor prevalencia (Gráf. 2)es Haemonchus con el 73,66%, seguido por oesophagostomun con el 17,07% y nematodirus con el 16,59%. Con menor prevalencia se encontraron ostertagia 0,49% y Toxocara vitolorum con 0.98%, datos que contratan con una investigación realizada en tres distritos de la Región Ancash, Perú (2013) donde la frecuencia de infección fue 86.6% y los nemátodos con mayor prevalencia fueron Haemonchus contortus (66.3%), Oesophagostomum spp., (38.9%), Trichostrongylus spp., (34.7%) y Ostertagia spp., (24.2%). Otra investigación realizada en la misma región en el (2021) resalta un 79.1% de los ovinos evaluados en los tres distritos de Áncash resultaron positivos a una o más especies de nematodos (Herrera et al., 2013) (Ninamancco et al., 2021)
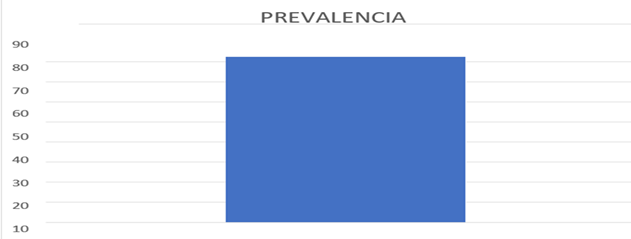
Gráf. 1 Prevalencia de Parásitos gastrointestinales en ovinos en la parroquia Guangaje cantón Pujilí-Ecuador.
La prevalencia de parásitos gastrointestinales en ovinos sacrificados en un rastro de Tabasco, México (2011) de una muestra total de 242 animales sacrificados a los que se les realizó la necropsia para el seguimiento de parásitos gastrointestinales, el 57,4% incluye las clases Nematoda, Trematoda o Cestoda. Las principales especies identificadas correspondieron a Haemonchus contortus en el abomaso. Cooperia curticei, Trichostongylus colubriformis, Strongyloides papillosus y Bunostomum trigonocephalum se encontraron en el intestino delgado y Oesophagostomum columbianum, y Trichuris ovis en el intestino grueso y otros, se concluye que la especie Haemonchus contortus es la mayor presencia y que valida la investigación realizada (González-Garduño et al., 2011)
En Tolima, Colombia (2017) de 385 muestras en 38 predios distribuidos en 14 municipios entre los meses de agosto y septiembre de 2016, las prevalencias fueron: en cuanto a nematodos de familia Tricostrongilidae (92,5 %), familia Strongylidae (48,3%), familia Toxocaridae (12%), familia Trichuridae (11%) y Ancylostomidae (10%) datos que no contrastan con la presente investigación (Schaeffer, 2017).
En Boyacá, Colombia se recolectaron 637 muestras de materia fecal de ovinos criollos en pastoreo. Estas se procesaron por la técnica Ritchie modificada y se analizaron mediante observación al microscopio. Se encuentra que el 89.4 % de ovinos estaba parasitado; la mayor prevalencia fue para la familia Eimeriidae con 63%, datos que de igual manera no contratan en la investigación realizada, se presume que puede ser por la región (Díaz-Anaya et al., 2017).
En dos unidades productivas en Rio de Janeiro, Brasil (2015), se concluye que existe una relación directa entre el parasitismo, principalmente Haemonchus contortus, y el grado de anemia con consecuencias sobre la serie roja sangre (Arece et al., 2015).
En cuanto al método FAMACHA y la condición corporal, así como, la identificación problemas sanitarios o nutricionales que permitan realizar intervenciones sanitarias, nutricionales y de manejo a lo largo del ciclo productivo/reproductivo, es un requisito indispensable para mejorar la eficiencia productiva, para la salud pública (Arece et al., 2015) (Carrillo et al., 2022).
Conclusiones
La prevalencia de parásitos gastrointestinales fue de 82,44%, se tomaron 205 muestras, la cual se debe a diferentes causas, entre las que se encuentran una alta ingestión de ooquistes debido a una contaminación en el entorno, la aplicación de programas de desparasitación inadecuados, corrales contaminados con baja higiene y alta humedad, alta sobrepoblación en áreas reducidas.
El parásito que presenta una mayor prevalencia es Haemonchus con el 73,66% lo cual se debe a un sistema de pastoreo donde no existe rotación de potreros, sobrepoblación en pequeñas áreas no existe división de grupos etarios
La técnica de FAMACHA es un eficiente método determinante del grado anémico en ovinos por lo que animales que obtuvieron una puntuación de 2 y 3 en la cartilla FAMACHA presentaron cargas de parásitos hematófagos como Haemonchus contortus.