Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Finlay
versión On-line ISSN 2221-2434
Rev. Finlay vol.7 no.3 Cienfuegos set. 2017
ARTÍCULO ORIGINAL
Evaluación electrofisiológica en pacientes diabéticos
Electrophisiological Assessment of Diabetic Patients
Didiesdle Herrera Alonso , Ada Sánchez Lozano , María Rodríguez Roque , Joan Rojas Fuentes , Ricardo Verdecia Fraga , Julio López Arguelles
Hospital General Universitario Dr. Gustavo Aldereguía Lima, Cienfuegos, Cienfuegos, Cuba, CP: 55100
RESUMEN
Fundamento: la polineuropatía diabética es la complicación más frecuente de la diabetes mellitus. Sin embargo, en la actualidad no se ha definido su verdadera incidencia y prevalencia.
Objetivo: determinar los hallazgos neurofisiológicos y las características clínicas de la polineuropatía diabética.
Métodos: se realizó un estudio descriptivo, prospectivo, y transversal, realizado en el laboratorio de neurofisiología del Hospital Pediátrico Paquito González Cueto de Cienfuegos, durante los meses de marzo a junio de 2016. El universo lo constituyeron los 57 pacientes diabéticos que acudieron al laboratorio en ese periodo de tiempo con el objetivo de realizarse estudios de conducción nerviosa. Se incluyeron pacientes mayores de 18 años de ambos sexos. Las variables demográficas analizadas fueron: edad, sexo, así como los relacionados a la diabetes mellitus (tiempo de evolución). Asimismo, se determinó la presencia de sintomatología sensitiva, como dolor, parestesias, disestesias, entre otras. Se calculó el porcentaje de pacientes con polineuropatía diabética y se determinó su relación con la edad, sexo, tiempo de evolución de la diabetes y sintomatología sensitiva. Todas las operaciones estadísticas fueron realizadas con el programa informático para análisis de datos SPSS 15,0 para Windows.
Resultados: el 94,7 % de pacientes presentó compromiso motor, con criterios de polineuropatía diabética, la edad osciló entre 36 y 55 años, 43 fueron mujeres (75,4 %), el tiempo de enfermedad promedio fue de 10 años y el 80,7 % refirió síntomas sensitivos.
Conclusiones: la exhaustiva anamnesis a pacientes diabéticos encontró sintomatología sugestiva de polineuropatía diabética, además presentaron hallazgos neurofisiológicos compatibles con dicha patología.
Palabras clave: diabetes mellitus, fenómenos electrofisiológicos, neuropatias diabéticas, conducción nerviosa, medicina interna.
ABSTRACT
Foundation: diabetic polineropathy is the most frequent complication of diabetes mellitus. Currently however, it has not been defined it actual incidence and prevalence.
Objective: to determine the neurophysiologic findings and the clinical characteristics of diabetic polineuropathy.
Methods: a descriptive, prospective and cross study was realized in the neurophysiology laboratory of the Paquito Gonzalez Cueto Pediatric Hospital, Cienfuegos, from March to June 2016. The universe was constituted by the 57 diabetic patients who had nerve conduction studies in that period. Patients older than 18 years of both sexes were included. The demographic variables analyzed were: age, sex, as well as those related to diabetes mellitus (evolution time). Likewise, the presence of sensory symptoms, such as pain, paresthesia, dysesthesia, among others, was determined. The percentage of patients with diabetic polyneuropathy was calculated and their relationship with age, sex, time of evolution of diabetes and sensory symptoms were determined. All statistical operations were performed with the SPSS 15.0 data analysis software for Windows.
Results: 94.7 % of patients presented motor involment, with criteria of diabetic polyneuropathy, the age ranged from 36 to 55 years, 43 were women (75.4 %), mean illness time was 10 years and 80.7 % reported sensitive symptoms.
Conclusiones: the exhaustive anamnesis to diabetic patients found symptoms suggestive of diabetic polyneuropathy, which also presented neurophysiological findings compatible with this pathology.
Key words: diabetic mellitus, electrophysiological phenomena, diabetic neuropathies, neural conduction, internal medicine.
INTRODUCCIÓN
Según el Hormone Health Network (Programa de intercambio internacional que establece relaciones de colaboración entre los principales centros médicos de los Estados Unidos y los centros médicos internacionales), la neuropatía diabética, es el daño a los nervios debido a un alto nivel de glucosa (azúcar) en la sangre en personas con diabetes. Los tipos más comunes de neuropatía diabética son los que afectan los órganos y músculos internos. El primer tipo (llamado polineuropatía distal) causa pérdida de sensación en los pies, piernas, manos y brazos. También puede afectar el movimiento de las extremidades. Los síntomas de incluyen: El segundo tipo (llamado neuropatía autonómica) afecta el tracto urinario, sistema digestivo, órganos sexuales, glándulas de sudor, ojos y corazón. Los síntomas de la neuropatía autonómica incluyen: La polineuropatía diabética (PND) es la complicación más frecuente de la diabetes mellitus (DM). Sin embargo, en la actualidad no se ha definido su verdadera incidencia y prevalencia, debido a la falta de consenso para emplear una metodología estandarizada para su diagnóstico, las diversas formas de presentación clínica de la entidad y los diferentes criterios para seleccionar muestras.1 Si se consideran estas limitaciones, los diversos estudios clínicos y epidemiológicos realizados señalan una prevalencia de PND que oscila entre el 5 y el 80 % de los pacientes examinados.2,3 La patogénesis de la neuropatía diabética permanece sin resolverse, las hipótesis concernientes a su etiología han mencionado daño metabólico directo a las fibras nerviosas, consecuencias indirectas de insuficiencia neurovascular, apoyo neurotrófico alterado y daño autoinmune. La hiperglucemia y el aumento de la concentración de glucosa intracelular y parecen tener un impacto negativo en el flujo sanguíneo del nervio.4,5 Un 20 % de los pacientes con diabetes mellitus presentan un síntoma de la polineuropatía crónica, y esta asociada a un número de factores de riesgo, ya sean modificables o no modificables.6 El dolor afecta más comúnmente los pies y tobillos, y en menor grado las extremidades inferiores por encima de la rodilla y las extremidades superiores.6 La presentación y el carácter del dolor en la PND pueden ser muy diversas, y típicamente empeora por la noche. Los pacientes pueden describir su dolor como ardoroso, punzante, con parestesias y disestesias, sensación de frío o alodinia.5,6 La electroneuromiografía desempeña un papel importante en la evaluación del paciente con neuropatía dudosa o establecida.7 El objetivo de esta investigación es determinar los hallazgos neurofisiológicos y las características clínicas de la polineuropatía diabética.
MÉTODOS
Se realizó un estudio descriptivo, prospectivo, y transversal, realizado en el laboratorio de neurofisiología del Hospital Pediátrico Paquito González Cueto de Cienfuegos, durante los meses de marzo a junio de 2016. El universo lo constituyeron los 57 pacientes diabéticos que acudieron al laboratorio en ese periodo de tiempo con el objetivo de realizarse estudios de conducción nerviosa, remitidos de la consulta de seguimiento de la clínica del diabético. Se incluyeron pacientes diabéticos, mayores de 18 años de edad de ambos sexos. Se llenó una ficha para recolección de los datos que consideró las variables demográficas: edad (en años), sexo, así como los relacionados a la DM (tiempo de evolución). Asimismo, se determinó la presencia de sintomatología sensitiva, como dolor, parestesias, disestesias, entre otras, para lo que se realizó un interrogatorio a los pacientes, efectuándoles preguntas directas e individualizadas. Posteriormente se les realizó neuroconducción sensorial y motora en los siguientes nervios: mediano, cubital, peroneo y sural derechos e izquierdos en cada uno de los pacientes, completando 456 nervios individuales. Para la determinación de las latencias y velocidad de conducción nerviosa motora y sensitiva, se emplearon las técnicas tipo, de acuerdo al nervio estudiado. Se determinó como anormal en el estudio de conducción nerviosa tanto motora como sensitiva a cualquier nervio con valor fuera del máximo para las latencias, y mínimo para las amplitudes y velocidad de neuroconducción, o bien que no se hubiera obtenido respuesta. Se tomaron como valores de normalidad los de referencia del propio laboratorio. Todos los estudios se realizaron en un Neurocid, utilizando electrodos de superficie. La temperatura ambiente fue monitoreada durante cada estudio. Se realizó el análisis de los datos y se confeccionaron tablas de frecuencias y gráficos. Se calculó el porcentaje de pacientes con PND y se determinó su relación con la edad, sexo, tiempo de evolución de la DM y sintomatología sensitiva. Todas las operaciones estadísticas fueron realizadas con el programa informático para análisis de datos SPSS 15,0 para Windows.
RESULTADOS
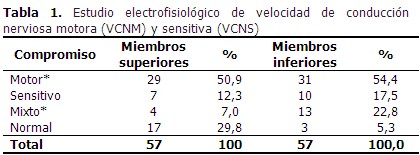
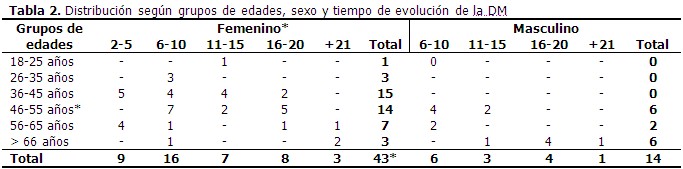
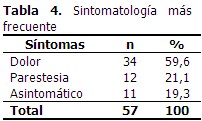
Predominó el compromiso motor, seguido del mixto (motor y sensitivo), en ambos casos el compromiso fue más frecuente en miembros inferiores. (Tabla 1). A continuación se describe la distribución de los pacientes según grupos de edad, sexo y tiempo de evolución de la enfermedad. La mayoría de los pacientes se encontraban en el grupo de 46-55 años y pertenecían al sexo femenino con un 75,4 %. El tiempo de evolución de la enfermedad que predominó en ambos sexos fue el de 6-10 años. (Tabla 2). De acuerdo a la definición de PND, 54 pacientes (94,7 %) presentaron compromiso de 2 o más nervios estudiados y cumplieron los criterios neurofisiológicos de PND, solo 3 pacientes (5,3 %) no presentaron alteración neurofisiológica. (Tabla 3). En cuanto a la sintomatología clínica de los pacientes estudiados, existió un predominio del dolor estando presente en 34 pacientes representando un 59,6 %. (Tabla 4). A continuación se representa que el tipo de lesión más frecuente resultó ser la mixta (axonomielínica) tanto en miembros superiores como en miembros inferiores con 20 y 29 pacientes respectivamente. (Gráfico 1).
DISCUSIÓN
En una prevalencia relativamente reciente Papanas y cols. estiman que la neuropatía en la diabetes tipo 2 basada en hallazgos electrofisiológicos es de 40 % después de 10 años de evolución de la enfermedad.8 El estudio electrofisiológico de los nervios estudiados evidencia alteración en la VCNM y VCNS en el 94,7 % de los pacientes, llegando a cumplir los criterios de PND, cifra superior a la reportada en otras series que muestran valores de hasta 80 %.9 Este estudio encontró un mayor compromiso motor de los nervios de las extremidades inferiores en relación a las extremidades superiores que contrasta con estudios similares que reportan una mayor afectación de las extremidades superiores en estos pacientes como es el trabajo publicado por Portillo y cols.10 Se menciona que la PND es una axonopatía de distal a proximal con mayor afectación de las fibras sensoriales, sin embargo, en este estudio se encontró una mayor afectación de fibras motoras, predominantemente las de nervio peroneo. Esto coincide con los resultados descritos por Escobar.11 El tiempo de evolución de la enfermedad que predominó en los pacientes de la muestra estudiada fue el de 6 a 10 años. Existen estudios que reportan similares resultados encontrando una relación directa entre la prevalencia de PND, el descontrol metabólico y el tiempo de evolución de la DM.12 Es interesante notar que solo 3 pacientes (5,3 %) no presentaron alteración en los estudios neurofisiológicos realizados, lo que demuestra la alta prevalencia de la PND en los pacientes diabéticos, presenten o no síntomas sugestivos de padecer esta complicación crónica, resultado similar al reportado por Partida Castillo hallazgos que se correlacionan directamente con el compromiso neuropatológico descrito en otras investigaciones.13 Esto evidencia su importancia como la más frecuente complicación crónica en los pacientes con DM, con el incremento en los gastos de medicamentos, atención médica especializada y la discapacidad a largo plazo que conlleva; ya que muchas veces la DM es diagnosticada años después de haberse iniciado, debido a que estos pacientes presentan síntomas escasos o nulos.13 El síntoma que con mayor frecuencia aparece en esta investigación es el dolor. Existen datos en la literatura que sugieren un efecto acumulativo de factores neuropáticos con el tiempo y han encontrado que bajas concentraciones séricas de insulina han sido asociadas con el desarrollo de polineuropatía, independientemente de la cifra de glucosa. Esto demuestra que la insulina tiene un efecto directo sobre el metabolismo o función nerviosa.12 Existe evidencia creciente de que el dolor neuropático persistente originado en la PND es resultado de daño nervioso inicial, con cambios morfológicos adaptativos subsecuentes ya sea a nivel central y/o en el sistema nervioso periférico, fenómeno conocido como neuroplasticidad.14 Además la hiperglucemia mantenida favorece la degeneración axonal y la desmielinización segmentaria. La lesión axonomielínica prevaleció en este estudio tanto en miembros inferiores como en miembros superiores, siendo esto similar a los resultados encontrados por Callaghan y cols.15 Un gran número de pacientes diabéticos presenta hallazgos neurofisiológicos compatibles con PND. Por lo que se considera importante la realización de exámenes periódicos para la detección temprana de pacientes con DM, para evitar el desarrollo de complicaciones crónicas como la PND, las cuales una vez instaladas se tornan irreversibles.
REFERENCIAS BIBLIOGRÁFICAS
1. American Diabetes Association. Diagnosis and classification of diabetes mellitus. Diabetes Care. 2013;36 Suppl 1:S67-74
2. Singleton JR, Smith AG. The diabetic neuropathies: practical and rational therapy. Semin Neurol. 2012;32(3):196-203
3. Ticse R, Pimentel R, Mazzeti P, Villena J. Elevada frecuencia de neuropatía periférica en pacientes con diabetes mellitus tipo 2 de un hospital general de Lima-Perú. Rev Med Hered. 2013;24(2):114-21
4. Schoenaker DA, Toeller M, Chaturvedi N, Fuller JH, Soedamah-Muthu SS; EURODIAB Prospective Complications Study Group. Dietary saturated fat and fibre and risk of cardiovascular disease and all-cause mortality among type 1 diabetic patients: the EURODIAB Prospective Complications Study. Diabetologia. 2012;55(8):2132-41
5. Mixcoatl T, Jolivalt CG. A spinal mechanism of action for duloxetine in a rat model of painful diabetic neuropathy. Br J Pharmacol. 2011;164(1):159-69
6. Mixcoatl T, Calcutt NA. Biology and pathophysiology of painful diabetic neuropathy. Springer Science. 2013;15(2):13-26
7. England JD, Gronseth GS, Franklin G, Miller RG, Asbury AK, Carter GT, et al. Distal symmetric polyneuropathy: a definition for clinical research: report of the American Academy of Neurology, the American Association of Electrodiagnostic Medicine, and the American Academy of Physical Medicine and Rehabilitation. Neurology. 2005;64(2):199-207
8. Papanas N, Ziegler D. Prediabetic neuropathy: does it exist?. Curr Diab Rep. 2012;12(4):376-83
9. Bril V, England J, Franklin GM, Backonja M, Cohen J, Del Toro D, et al. Evidence-based guideline. Treatment of painful diabetic neuropathy: report of the American Academy of Neurology, the American Association of Neuromuscular and Electrodiagnostic Medicine and the American Academy of Physical Medicine and Rehabilitation. Neurology. 2011;77(6):603
10. Portillo R, Lira D, Quiñónez M. Evaluación neurofisiológica y clínica en pacientes con diabetes mellitus. An Fac Med Lima. 2005;66(1):1-10
11. Escobar DA, Rivera DB, Juárez MJ, González B. Utilidad de la electroneuromiografía para evaluar neuropatía en pacientes diabéticos. Rev Med Inst Mex Seguro Soc. 2006;44(1):27-34
12. Suárez S, Jiménez G, Ramírez ML, Juárez IE, Cuauhtémoc J. Neuropatía: Una complicación dolorosa de la diabetes. Horizonte sanitario. 2013;12(3):12-24
13. Partida ZT, Rinza M, Támez E, Hernández M. Cambios electrofisiológicos en el paciente diabético. Rev Mex Med Fis y Rehabil. 2006;18(1):49-54
14. Vinik AI, Casellini CM. Guidelines in the management of diabetic nerve pain: clinical utility of pregabalin. Diabetes Metab Syndr Obes. 2013;6(1):57-78
15. Callaghan BC, Cheng HT, Stables CL, Smith AL, Feldman EL. Diabetic neuropathy: clinical manifestations and current treatments. Lancet Neurol. 2012;11(6):521-34
Recibido: 08 de mayo de 2017.
Aprobado: 04 de julio de 2017.
Didiesdle Herrera Alonso. Especialista de I Grado en Neurofisiología Clínica. MSc. en Longevidad Satisfactoria. Profesor Asistente.Hospital General Universitario Dr. Gustavo Aldereguía Lima. Cienfuegos. Correo electrónico: didiesdle.herrera@gal.sld.cu