Introducción
Las enfermedades cardiovasculares son la principal causa de mortalidad en los países del primer mundo, y dentro de ellas, la cardiopatía isquémica ocupa el lugar cimero. La mortalidad intrahospitalaria por infarto agudo de miocardio varía de un 4-12 % y al año alcanza el 10 % según datos de la Unión Europea.1
El 80 % de las muertes por infarto de miocardio se producen en los países de ingresos medios y bajos.2 La tasa de mortalidad en Cuba por enfermedades del corazón alcanzó la cifra de 241,6 por cada 100 000 habitantes en el año 2017. Específicamente, por cardiopatía isquémica la tasa fue 156,7 si se incluye la mortalidad tanto en el contexto agudo como en el crónico. En relación con el infarto agudo de miocardio la tasa de mortalidad fue de 71 por cada 100 000 habitantes. La provincia Sancti Spíritus no está exenta de esta problemática, porque ostenta una tasa bruta de mortalidad por enfermedades del corazón de 231 por cada 100 000 habitantes y ajustada por edad de 100,8 por cada 100 000 habitantes.3
El pronóstico tras un infarto agudo de miocardio con elevación del segmento ST (IAMCEST) está en relación con la probabilidad de desarrollar algún evento adverso y responde a múltiples causas.1,2 Según las guías internacionales de tratamiento del infarto, las condiciones asociadas con una peor evolución son la edad avanzada, la clase Killip Kimbal, la función ventricular disminuida, la diabetes mellitus, la estrategia de tratamiento utilizada y el tipo de hospital en que es atendido el paciente.1,4
La base del desarrollo de las enfermedades cardiovasculares es la aterosclerosis. La inflamación desempeña un papel crucial en el proceso de aterosclerosis coronaria.5 En el curso de un infarto agudo de miocardio se producen múltiples alteraciones del tejido que afectan a las placas ateroscleróticas preexistentes, las células endoteliales, la musculatura lisa vascular y los elementos formes de la sangre como plaquetas, neutrófilos y leucocitos.6 En los últimos años se han estudiado múltiples marcadores de riesgo que permiten estratificar a los pacientes tras un síndrome coronario agudo (SCA), entre ellos la proteína C reactiva, las troponinas y el péptido natriuretico tipo B, muchos de los cuales no están disponibles de manera universal.6,7
El recuento leucocitario se ha empleado como marcador inflamatorio y es aceptado como factor pronóstico tras un SCA.5,8 La hiperglucemia también ha demostrado ser un elemento de mal pronóstico tras un evento coronario agudo, tanto en pacientes diabéticos como en no diabéticos.9,10 Se sabe que la hiperglucemia puede mediar procesos como la apoptosis, la lesión celular, el metabolismo del miocardio isquémico y la función endiotelial.11 En los últimos años se ha hecho referencia al valor combinado de ambos marcadores como índice leuco-glucémico (ILG), el cual ofrece un valor predictivo de complicaciones y mortalidad que permite estratificar a los pacientes de manera sencilla tras el ingreso hospitalario.7,12,13
Por la importancia y trascendencia de esta problemática se realiza esta investigación que propone como objetivo: evaluar la utilidad del índice leuco-glucémico en la estratificación del riesgo de muerte intrahospitalaria tras un IAMCEST.
Métodos
Se realizó un estudio observacional prospectivo que incluyó todos los pacientes con IAMCEST ingresados consecutivamente en la unidad de cuidados coronarios del Hospital General Docente Camilo Cienfuegos de Sancti Spíritus, en el período comprendido del 1 de enero de 2012 al 30 de junio de 2015.
El diagnóstico de IAMCEST se definió por dolor típico de insuficiencia coronaria con nueva elevación del segmento ST > 0,2mV medida desde el punto J en dos o más derivaciones precordiales o 0,1mV en dos o más derivaciones estándar o nueva aparición de bloqueo de rama izquierda.1,13 (Figura 1).
La recogida de los datos se realizó por medio de formatos de registro que incluyeron datos demográficos, clínicos, de laboratorio, ecocardiográficos y electrocardiográficos.
Las variables estudiadas fueron: demográficas (edad, sexo y color de la piel); historial médico y factores de riesgo cardiovasculares: hipertensión arterial (HTA), cardiopatía isquémica previa, dislipidemia, tabaquismo, diabetes mellitus y obesidad (tomándose como tal aquellos pacientes con un índice de masa corporal superior a 30 Kg/m2); datos clínicos como la tensión arterial sistólica y diastólica además de la frecuencia cardiaca al ingreso. La trombolisis se realizó con estreptoquinasa recombinante y la topografía del infarto se determinó por el electrocardiograma del ingreso y se clasificó según los criterios de Bayés de Luna.14
Parámetros de laboratorio
Las muestras de sangre venosa se tomaron en las primeras 4 horas de ingreso del paciente. Los exámenes realizados fueron hemoglobina, glucemia, recuento leucocitario y creatinina. La analítica sanguínea se procesó en un analizador automático Cobas c311.
El filtrado glomerular renal (FGR) se calculó por la fórmula de MDRD-4.15 Para el cálculo del índice leuco glucémico se tuvo en cuenta la glucemia y el recuento leucocitario. Para calcular el ILG se utilizó la siguiente fórmula7,12:
ILG = (glucemia[mg/dl] ∗ leucocitos [106/l])/1.000
Una vez alcanzada la estabilidad hemodinámica se realizó ecocardiograma transtrorácico a la cabecera del paciente con equipo PHILIP EPIQ 5 y se determinó la fracción de eyección del ventrículo izquierdo (FEVI) por método Simpson biplano.
El seguimiento de los pacientes se realizó durante su estadía hospitalaria y el desenlace principal analizado fue la mortalidad durante el ingreso. La morbilidad también se estudió durante el seguimiento del paciente: clase de Killip Kimbal (KK) fibrilación auricular, bloqueo auriculoventricular, recurrencia del infarto miocárdico, parada cardiorrespiratoria y la presencia de taquicardia/fibrilación ventricular (TV/FV).
El protocolo del estudio está acorde con la declaración de Helsinki y fue aprobado por el comité de ética del hospital. No se publicaron datos identificativos de los pacientes, no obstante se respetó la confidencialidad durante su manejo.
Se utilizó una base de datos creada en el paquete estadístico SPSS v.17.0 para Windows.
Los datos continuos se presentaron en su media y desviación estándar y los datos categóricos como números y porcentajes.
La distribución normal de las variables se comprobó mediante la prueba de Kolmogorov Smirnov (p >0,05). La comparación de variables cuantitativas entre grupos, en caso de seguir una distribución normal, se realizó con el test de t de Student para muestras independientes; en caso de no seguir una distribución normal se empleó el test no paramétrico U de Mann-Whitney. Para comprobar la fortaleza de asociación entre variables cualitativas se empleó la prueba no paramétrica Ji Cuadrado de Pearson y ante situaciones en que más del 20 % de las frecuencias esperadas presentaron valores menores de 5 se utilizó la prueba exacta de Fisher.
Para la relación entre las variables continuas asociadas a la mortalidad intrahospitalaria se calculó su capacidad de discriminación mediante la construcción de curvas ROC y el cálculo del área bajo la curva (índice «c»). La validación estadística de los resultados de la investigación adoptó un nivel de significación del 95 % (p < 0,05) para los grados de libertad previamente fijados en cada una de las circunstancias presentadas.
Resultados
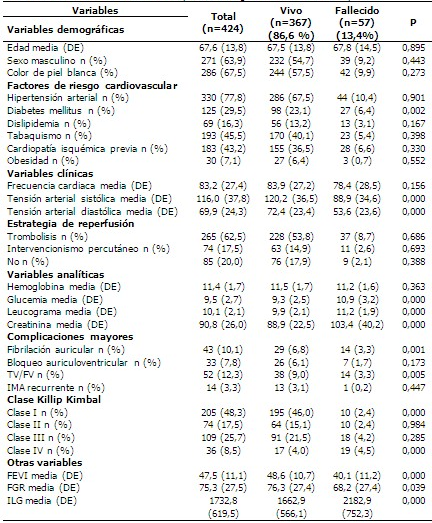
Se estudiaron un total de 424 pacientes de los cuales 57 (13,4 %) fallecieron. Los pacientes fallecidos fueron con mayor frecuencia hombres con una media de edad de 67,8 ± 14,5. No existieron diferencias respecto al antecedente de HTA, dislipidemias, tabaquismo, cardiopatía isquémica previa y obesidad. La diabetes mellitus resultó un factor de riesgo de mortalidad (p=0,002). Las estrategias de reperfusión empleadas fueron similares en ambos grupos. Las medias de tensión arterial fueron inferiores en los pacientes fallecidos. La creatinina, la glucemia y el leucograma mostraron medias superiores en los pacientes fallecidos (103,4 ± 40,2 vs 88,9 ± 22,5) (10,9 ± 3,2 vs 9,3 ± 2,5) (11,2 ± 1,9 vs 9,9 ± 2,1) respectivamente. El índice leuco-glucémico mostró medias superiores en los pacientes fallecidos (2182,9 ± 752,3 vs 1662,9 ± 566,1), por encima del percentil 75 (ILG=2122). Las características basales de la población se muestran a continuación. (Tabla 1).
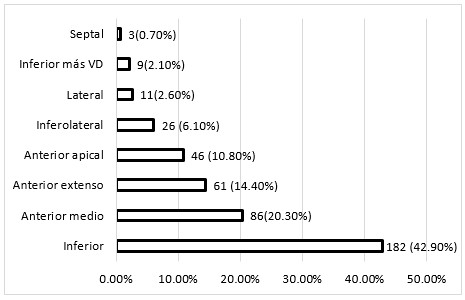
A continuación se muestra el predominio de pacientes con SCACEST de topografía inferior (42,9 %) y anterior medio (20,3 %). (Figura 2).
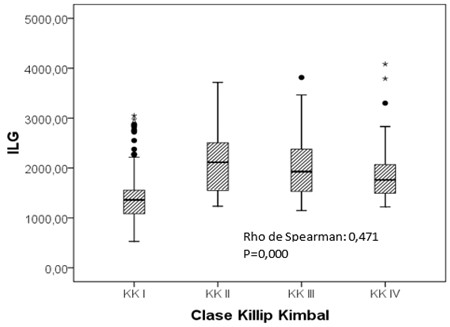
Existió una correlación positiva entre el grado de insuficiencia cardiaca (Clase Killip Kimbal) y el aumento del índice leuco-glucémico (Rho de Spearman 0,471 p<0,001). (Figura 3).
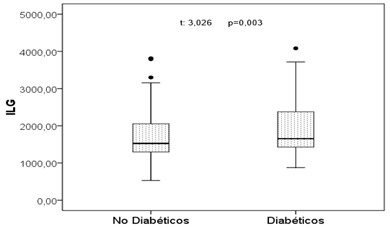
Se muestra la diferencia de medias del ILG entre los pacientes diabéticos y no diabéticos con diferencias significativas (p=0,003). (Figura 4).
El ILG resultó un predictor de mortalidad tanto en los pacientes diabéticos como en los no diabéticos como muestra el área bajo la curva con c= 0,673 y c=0,707 respectivamente. (Figura 5).
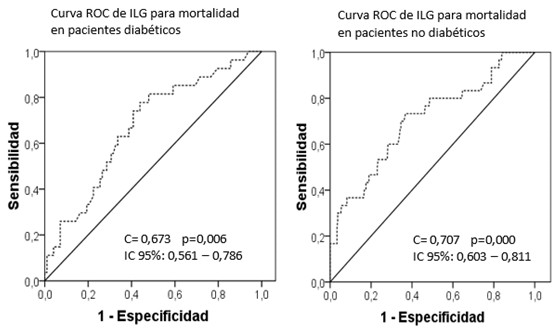
Fig. 5 Curvas ROC para pronosticar la mortalidad intrahospitalaria por el ILG en pacientes diabéticos y no diabéticos
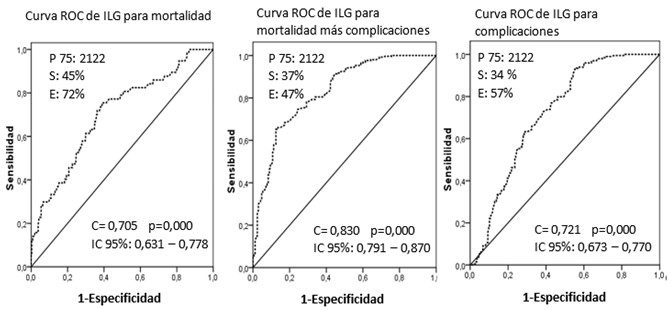
El pronóstico de mortalidad intrahospitalaria resultó significativamente peor en los pacientes con ILG elevado. El percentil 75 mostró una aceptable sensibilidad y buena especificidad como predictor de complicaciones y mortalidad tras un IAMCEST. (Figura 6).
Discusión
Los resultados encontrados en este trabajo reflejan la asociación del ILG a un mayor número de complicaciones y mortalidad intrahospitalaria. La población estudiada mostró características basales similares, no obstante, los pacientes fallecidos mostraron medias superiores de glucemia, recuento leucocitario y creatinina, así como una media inferior de FEVI, FGR y tensión arterial. La FEVI en el contexto de un síndrome coronario agudo es un predictor de riesgo independiente.1 Bedetti G y cols. encontraron una relación inversa de la mortalidad y la FEVI inferior al 40 %.16 Relacionado con los valores de glucemia, los resultados de este estudio coinciden con Angeli y cols.17 en un meta análisis que incluyó 24 estudios; la hiperglicemia al ingreso aumentó de 3 a 4 veces el riesgo de muerte intrahospitalaria (OR = 3,62 con una muestra de 10673 pacientes en 15 estudios), además el riesgo de muerte en los primeros 30 días a más de 4 veces (OR = 4,81 con una muestra de 101447 pacientes en 4 estudios). En el estudio de Monteiro y cols.18 que incluyó a 1149 pacientes con SCA, diabéticos o no, la hiperglicemia al ingreso se asoció a un peor perfil de riesgo cardiovascular, niveles más altos de biomarcadores de necrosis y de inflamación y una función del ventrículo izquierdo más deprimida. Después del análisis multivariado, la glucemia mayor de 5,77 mmol/L, la edad mayor de 72 años, la clase Killip superior a 1 y la troponina I mayor a 6,0 ng/ml, fueron predictores independientes de mortalidad intrahospitalaria, sin incluir el antecedente de diabetes mellitus. García Cairo y cols19 también encontraron en un estudio prospectivo la presencia de hiperglucemia al ingreso como un factor pronóstico negativo en la evolución de los pacientes con SCA, independiente de otros factores de riesgo y de la existencia de un diagnóstico previo de diabetes mellitus. Un estudio reciente de Lee T y cols.20 no encontró relación entre el valor de glucemia basal y las complicaciones tras un evento coronario agudo, en contraste, la hiperglucemia de estrés se asoció a un mayor número de complicaciones (OR 1,22 por 0,1 incremento de la hiperglucemia de estrés (IC 95 % 1,06-1,42) y de manera individual incrementó el riesgo de muerte (OR 1,55; IC 95 % 1,14-2,11), de insuficiencia cardiaca (OR 1,27; IC 95 % 1,05-1,54) y arritmias (OR 1,31; IC 95 % 1,12-1,54).
Los pacientes fallecidos también mostraron medias superiores de recuento leucocitario, lo cual evidencia un mayor grado de inflamación en los pacientes que se complican tras un evento coronario agudo.
La leucocitosis juega un papel importante en el inicio y progresión de un infarto del miocardio. Recientemente Liang y cols.21 publicaron un artículo donde se estudiaron 815 pacientes con intervencionismo coronario percutáneo tras un síndrome coronario agudo. El grado de leucocitosis se asoció en mayor medida a la carga trombótica y a la oclusión total de la arteria. (9,55 vs 10.70 ×109/L, p = .005).
La evaluación conjunta de la glucemia y el leucograma como ILG podría resultar de utilidad como herramienta en la estratificación de riesgo. En esta investigación un ILG elevado se asoció a una mayor mortalidad independiente del diagnóstico de diabetes mellitus, así como a un mayor grado de insuficiencia cardiaca expresado por la clase Killip. Los resultados de esta investigación coinciden con los de Quiroga y cols.12 quienes encontraron una asociación entre un ILG > 1600 y la aparición de complicaciones (OR 6,2; IC95 % 2,65-15,55). León Aliz y col.7 por su parte, hallaron que un ILG mayor a 1,158 se relacionó con un peor pronóstico y una mayor ocurrencia de complicaciones intrahospitalarias, así como con el fallo de la trombolisis. La combinación de la glucemia y la respuesta inflamatoria en pacientes con síndrome coronario agudo muestran una acción sinérgica evidenciada por Ray y cols.22 incluso después del ajuste por diabetes mellitus.
Los resultados de este estudio sugieren la importancia de evaluar de manera sinérgica la hiperglucemia y el leucograma como ILG, ya que se asocia a un mayor número de complicaciones y mortalidad intrahospitalaria.
El ILG en el curso de un IAMCEST puede asociarse a una mayor mortalidad intrahospitalaria y complicaciones. Sería razonable la evaluación de este parámetro en la emergencia, lo cual resultaría de utilidad en la estratificación de riesgo y la toma de decisiones terapéuticas en el curso de un SCA.