INTRODUCCIÓN
La aciduria metilmalónica (AM) es una de las acidurias orgánicas más frecuentes, caracterizadas por aumento de la excreción de ácido metilmalónico (AMM) en orina. Este grupo de enfermedades puede estar dado por mutaciones de la metilmalonil CoA mutasa o alteraciones en la síntesis de la cobalamina. Las AMs se clasifican en aisladas o combinadas, en estas últimas se observa un incremento de los niveles de homocisteína (Hcy) en el plasma. 1,2
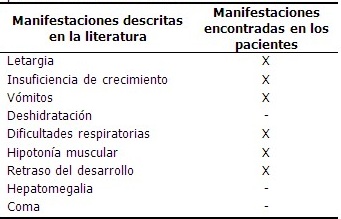
Dentro de los síntomas más frecuentes observados se encuentran la letargia, la insuficiencia de crecimiento, vómitos recurrentes, deshidratación, dificultades respiratorias e hipotonía muscular. Otros signos son el retraso del desarrollo, hepatomegalia y el coma. 3 El tratamiento de los pacientes con AM se basa en la administración de L-carnitina y vitamina B12. Los pacientes pueden ser respondedores o no respondedores al tratamiento con vitaminas. Por lo que requieren de controles bioquímicos y clínicos durante la primera fase de tratamiento. 4,5
El diagnóstico diferencial de los casos con AM requiere de la aplicación de algoritmos complejos, donde la evaluación de los niveles de AMM y Hcy constituye el primer paso. El análisis cualitativo del perfil de ácidos orgánicos es suficiente para detectar la AM. La evaluación simultánea de los niveles de Hcy permite detectar las variantes combinadas o aisladas de la AM, obteniendo así un diagnóstico más específico.
En Cuba, se realiza el análisis cualitativo de ácidos orgánicos en la pesquisa selectiva de poblaciones de riesgo. Actualmente la AM constituye una de las acidurias orgánicas que con más frecuencia se ha observado. 6 La introducción de la cuantificación de la Hcy nos ha permitido realizar un diagnóstico lo más específico posible y dar seguimiento a los casos identificados con elevaciones del AMM.
El objetivo de este trabajo es describir la implementación de una metodología de laboratorio que combina el AMM y la Hcy en el diagnóstico diferencial y seguimiento de la AM en el periodo de 2013 a 2018.
MÉTODOS
El perfil de ácidos orgánicos se obtuvo a solicitud de los especialistas de todo el país, en pacientes con hallazgos clínicos sugestivos de una aciduria orgánica. En aquellos casos donde se observó un aumento de AMM, se cuantificó la homocisteína en orina o en plasma.
Se utilizaron muestras de orina de la primera micción y muestras de plasma con anticoagulante etilendia- minotetra-acético (EDTA), ambas recolectadas con ayuno superior a 6 horas.
El AMM se detectó en orina, por un método de cromatografía gaseosa acoplada a espectrometría de masas descrito por Camayd y cols. 6 La verificación de la autenticidad de los espectros de masas obtenidos se realizó mediante la comparación de los espectros procedentes de los registros de la base de datos del Instituto Nacional de Estándares de los Estados Unidos (NIST versión 2011) y la base de datos MassBank. 7 Los niveles de AMM se estimaron semi-cuantitativamente usando controles de AMM en agua a 10, 25, 50 y 100 μM. Se consideraron positivas las muestras, donde el área del AMM en el cromatograma es superior a la del control de 10 μM.
La cuantificación de Hcy en plasma y orina, por cromatografía líquida de alta resolución se realizó a las muestras de los pacientes diagnosticados con AM, utilizando el método descrito por Concepción y col. 8 La cuantificación de la Hcy se realizó sustituyendo el área de este aminoácido en la ecuación de la curva de calibración. Se consideró como valores de referencia los descritos en la base de datos Human Metabolome Database (plasma: 5-15 μM y orina: <2 mmol/mol de creatinina). 9 La creatinina se cuantificó en muestras de orina, utilizando los juegos de reactivos comerciales (HELFA) en el analizador automático Elimat.
RESULTADOS
En el periodo de noviembre de 2013 a diciembre de 2018 se analizaron 450 muestras de pacientes de todo el país. De ellos, 7 presentaron niveles incrementados de AMM: 5 niveles moderados (entre 10 y 100 mmol/mol de creatinina) y 2 niveles superiores a 100 mmol/mol de creatinina.
Las principales manifestaciones clínicas presentadas por los pacientes con aumento de AMM se describen a continuación. (Tabla 1).
Tabla 1. Manifestaciones clínicas presentadas por los pacientes con aumento de ácido metilmalónico
La Hcy se cuantificó en los 7 pacientes con aumento de AMM. De estos pacientes 4 presentaron niveles alterados de Hcy. (Tabla 2).
Tabla 2. Valores de homocisteína en pacientes con aumento de ácido metilmalónico
DISCUSIÓN
En este estudio no fue posible cuantificar la Hcy siempre en el mismo tipo de fluido, debido a la disponibilidad de las muestras en cada caso, lo cual constituye una limitación, pues en general se prefiere el plasma para cuantificar este metabolito. 9 No obstante, en los pacientes 1 y 2 pudo demostrarse que tanto la Hcy como el AMM estaban elevados en orina, lo que se traduce en un aumento a nivel plasmático.
El aumento simultáneo del AMM y la Hcy en los pacientes 1, 2, 3 y 5, sugiere una AM combinada con homocistinuria, donde se podría inferir que el defecto se encuentra en el metabolismo intracelular de la cobalamina, específicamente en las variantes cblC, cblD, cblF o cblJ.10 Además, es posible descartar una encefalopatía mitocondrial con AMM elevado (asociado a los genes SUCLA2 y SUCLG1), ya que esta patología cursa con aumento de los niveles de ácido láctico en sangre y orina. 10,11 Los perfiles de ácidos orgánicos no mostraron una aciduria láctica; además, en ninguno de los casos se refieren cuantificaciones alteradas de lactato en sangre. Por otro lado, las variantes aisladas se caracterizan por episodios severos de acidosis, hiperamonemia o cetosis, no referidos en el resumen de historia clínica. Asimismo, el 3-hidroxibutirato y el acetoacetato (cuerpos cetónicos) son detectables en el perfil de ácidos orgánicos, pero no se identificaron en las muestras analizadas.
Una vez diagnosticados los pacientes con AM, solo se pudo evaluar en tres la respuesta al tratamiento con vitamina B12 y L-carnitina. El paciente 1 falleció antes del diagnóstico. En este caso solo pudo definirse una variante de AMM combinada con homocistinuria, sin definir la respuesta a tratamiento con vitamina B12. Los niveles de ambos marcadores sugieren alguna de las variantes cblC, cblD1, cblF o un defecto de malabsorción de vitamina B12.
El seguimiento de los pacientes 2, 3 y 5, después de iniciado el tratamiento con vitamina B12 y L-carnitina intramuscular evidenció una caída drástica en los niveles de AMM y una disminución de los niveles de Hcy (Paciente 2: 4,25 mmol/mol de creatinina, Paciente 3: 3,29 μmol/L, Paciente 5: 8,03 μmol/L), que se correspondió con una evolución satisfactoria. Este hecho sugiere una de las variantes de AM que responden a tratamiento con vitamina B12 (cblC, cblD1, cblF o un defecto de malabsorción de vitamina B12).
En los pacientes 4, 6 y 7 se sugirió una AM aislada, donde el defecto genético podría ser en el gen que codifica para la enzima metilmalonil-CoA mutasa, o en los cofactores de adenosilcobalamina, descritos como variantes aisladas de AM (cblA, cblB y cblD-2). 3,12 En este caso, el perfil de ácidos orgánicos durante la crisis, con aumento del AMM por debajo de 10000 mmol/mol de creatinina y sin aciduria láctica, es sugestivo de variantes donde están deficientes los cofactores de adenosilcobalamina. 12)
El análisis de ambos marcadores bioquímicos permitió realizar el diagnóstico diferencial de la aciduria metilmalónica, así como brindar seguimiento a los pacientes con niveles aumentados. La metodología implementada en nuestro laboratorio, con el análisis del AMM y la Hcy en el diagnóstico diferencial de la AM permite 1 definir la presencia de una AM aislada o combinada con Hcy, 2 seguir a los pacientes identificados y establecer si la AM responde o no al tratamiento con vitamina B12 y 3 proponer a partir de los datos clínicos y los resultados de laboratorio, las posibles variantes de AM.