Introducción
El cáncer es una enfermedad rara en niños y adolescentes, sin embargo, en los últimos años se viene presentando en aumento considerable. Según la Unión Internacional Contra el Cáncer (UICC), las estadísticas señalan que cada año más de 160 mil niños son diagnosticados con cáncer en el mundo, perteneciendo un 80 % de ellos a los países en vías de desarrollo. 1,2
Cada año se diagnostican en Cuba aproximadamente 300 casos nuevos de cáncer, cifras que han aumentado en las últimas décadas, los cuales son tratados en alguno de los 9 centros destinados a la atención oncohematológica existentes en el país. La tasa de supervivencia se mantiene en este decenio a pesar del aumento de la incidencia. 2
Actualmente los avances médicos incrementan la supervivencia de niños con cáncer, es por esto que cada vez son más complejos los problemas que enfrentan pacientes y familias, requiriendo nuevas estrategias. El dolor es un síntoma cardinal en estos pacientes y es experimentado, junto al miedo, al acudir a un centro sanitario o ser inducidos por pruebas diagnósticas o terapéuticas.
El dolor pediátrico es aún infratratado, debido a falsas creencias acerca de su percepción, todas ellas basadas en la inmadurez biológica de su sistema nervioso central, la pobre respuesta neuroendocrina, el escaso recuerdo de las experiencias negativas y la presencia de un umbral doloroso más alto, lo que le hace tolerar mejor que el adulto. Estas teorías erróneas llevan en la práctica a no tomarse la valoración y el tratamiento del síntoma dolor con la misma actitud que se hace en el adulto por lo que en décadas anteriores era difícil encontrarse en los textos capítulos específicos sobre este tema. 3-5
Lo cierto es que desde edades intrauterinas, los humanos experimentan dolor, siendo esto evidente a partir de la observación de las respuestas conductuales y fisiológicas frente a la estimulación nociceptiva, tanto a nivel prenatal como postnatal. Los componentes neuroanatómicos necesarios para la percepción del dolor ya están presentes desde la semana 25 de gestación. Más aún, el dolor en recién nacidos y prematuros puede verse exacerbado debido a que las vías inhibitorias descendentes que modulan la transmisión del dolor en el asta dorsal de la médula espinal no se encuentran completamente desarrolladas hasta el período de lactante mayor. Ello condicionaría una especie de amplificación de la sensación dolorosa. Por otra parte, las neuronas del asta dorsal en neonatos tienen un umbral excitatorio menor que en niños mayores y estímulos repetidos (como la toma de muestra mediante lanceta en el talón, accesos venosos u otros) reducen aún más este umbral. La descarga repetida de las fibras nociceptivasamielínicas tipo C producen sensibilización periférica, que se traduce en hiperalgesia (aumento de la sensación dolorosa frente a un estímulo nociceptivo) y alodinia (sensación dolorosa desencadenada por estímulos habitualmente no dolorosos que son transmitidos por fibras nociceptivas y percibidos como dolor). Por último, la estimulación repetida con impulsos nociceptivos de las neuronas del asta dorsal produce amplificación y mayor duración e intensidad del dolor, lo que se denomina sensibilización central. Todos los niños pequeños son capaces de generar una respuesta hormonal de estrés frente al dolor. 5,6
Casi todos los niños con cáncer padecen dolor en algún momento de su enfermedad por lo que el tratamiento adecuado debe comenzar cuando se diagnostica la enfermedad y debe proseguir durante todo su curso.
Por todo lo antes mencionado, este trabajo tiene como objetivo exponer las principales características del dolor en pacientes con cáncer en edad pediátrica, su evaluación y manejo, sobre la base de los conocimientos fisiopatológicos, teniendo en cuenta los aspectos referenciados en lo más actualizado de la literatura especializada.
Desarrollo
El manejo del dolor por cáncer es un gran reto para cualquier médico, pero al mismo tiempo una oportunidad de ejercer sus conocimientos y habilidades para ayudar a un niño que sufre, es imperativo para mejorar la comodidad del paciente, disminuir la respuesta ante el estrés y eventualmente disminuir la mortalidad.
Del mismo modo existen evidencias que resaltan que un inadecuado tratamiento del dolor tiene consecuencias biológicas y conductuales, pudiendo determinar respuestas inapropiadas ante posteriores eventos dolorosos. 6,7
El mecanismo fisiológico del dolor está conformado por cuatro fases. 8-10
Transducción: la información del sistema sensitivo general se inicia en la piel, los músculos, articulaciones y vísceras, donde es captada y convertida a potenciales de acción por diversos receptores o transductores, sensibles a estímulos que producen o amenazan con producir daño tisular y se activan a un alto umbral. Cuando se produce una lesión superficial en la piel, se perciben dos clases de dolores: uno inicial, rápido, de corta duración, bien localizado, llamado dolor primario y otro de aparición más tardía, lento, persistente y difuso, llamado dolor secundario.
Transmisión: al igual que todas las sensaciones generales, el dolor es transmitido desde la periferia hasta la corteza somato-sensorial por tres neuronas. La primera inicia en el receptor y llega hasta la médula espinal o al tallo cerebral. En el asta dorsal de la médula espinal se encuentran las que reciben las fibras del dolor. En el tálamo se inicia el análisis del dolor y de aquí parte la tercera neurona, que llega a la corteza somato-sensorial, donde se realiza la percepción sensorial.
El dolor se transmite por fibras delgadas Aδ y C. Las fibras Aδ poseen un diámetro de 2 a 5 mm y una velocidad de conducción de 12 a 30 m/seg. Las fibras C tienen un diámetro de 0,4 a1,2 mm y una velocidad de conducción de 0,5 a 2 m/seg. Cuando se produce una lesión tisular, se desencadena una cascada de liberación de sustancias inflamatorias sensibilizantes o excitadoras de los nociceptores. Entre ellas se encuentran iones potasio e hidrogeniones, serotonina, bradiquinina, histamina, prostaglandinas, leucotrienos, tromboxanos y sustancia P. Esta última es liberada por un reflejo axonal e induce vasodilatación y degranulación de mastocitos, lo que conduce a la liberación de histamina y serotonina. El conjunto de estas sustancias se denomina “sopa inflamatoria”.
En el asta dorsal de la médula espinal hay diferentes láminas entre las que se encuentran las que reciben las fibras del dolor, tales como la lámina I donde se proyectan las fibras Aδ y C, la lámina II donde se proyectan las fibras tipo C que hacen sinapsis con las interneuronasintralaminares (pre y post sinápticas) y las neuronas interlaminares (excitación postsináptica). Por otra parte, las fibras Aδ envían ramas colaterales a hacer sinapsis con las neuronas nociceptivas tipo 2 en láminas IV y VI. En el asta dorsal la primera neurona hace sinapsis con la segunda neurona, la cual cruza al lado contrario y llega hasta el tálamo, por el tracto espino-talámico. En el tálamo se inicia el análisis del dolor y de aquí parte la tercera neurona, que llega a la corteza somato-sensorial, donde se realiza la percepción sensorial mediante conexión con neuronas de cuarto orden y con otras partes del cerebro.
Modulación: (sensibilización): intervienen neuroquímicos excitatorios que facilitan la excitación de circuitos nerviosos. (Inhibición): mediada por los sistemas opioide y no opioide.
Percepción: proceso final mediante el cual los estímulos descritos activan la porción somatosensorial y asociativa de la corteza cerebral. El componente afectivo del dolor deriva entre corteza, sistema límbico y lóbulo frontal.
Clasificación:
Según mecanismos fisiopatológicos se distinguen dos tipos principales de dolor: 4,5,9
Nociceptivo (estimulación de receptores nociceptivos, puede ser somático o visceral). Este dolor responde a analgésicos primarios (antiinflamatorios no esteroideos y opioides).
Neuropático (compresión o destrucción nerviosa). Presenta signos como disminución de la sensibilidad, cambios vasomotores locales, hiperalgesia y cambios distróficos de piel y faneras. Puede ser desencadenado por estímulos habitualmente no dolorosos. Responde a drogas adyuvantes como los anticonvulsivantes, antidepresivos, antiarrítmicos, corticoides y parcialmente a analgésicos primarios.
En los pacientes con cáncer, es frecuente que ambos estén involucrados por lo que se considera un dolor mixto. Hacer la distinción clínica es sumamente útil, porque los abordajes terapéuticos son diferentes.
Dolor agudo: dolor que cesa si la causa resuelve, con una duración generalmente inferior a 30 días, aunque puede extenderse más allá siempre que la causa sea corregible, es de comienzo rápido, percibido inmediatamente después de una injuria, es severo en intensidad, pero habitualmente de corta duración. Termina con la cicatrización o con la resolución del proceso.
Dolor crónico: se perpetúa en el tiempo, generalmente más de 3 meses o cuando la causa no es corregible. Puede ser originado por la injuria, pero es perpetuado por otros factores. Impacta de manera negativa en los aspectos de la vida cotidiana: la actividad física, la asistencia a la escuela, los patrones del sueño y las relaciones sociales y puede llevar a que el niño sufra estrés, ansiedad, depresión, fatiga, pérdida del apetito, cambios en el humor.
Otras clasificaciones:
Dolor irruptivo: se caracteriza por un incremento temporal de la intensidad sobre un dolor de base ya existente. Es bastante típico en el cáncer.
Dolor incidental: puede ser inducido por los procedimientos diagnósticos y terapéuticos.
Dolor de fin de dosis: se presenta cuando el nivel plasmático de los analgésicos se encuentra por debajo del nivel mínimamente efectivo que coincide con el final del intervalo de dosis.
Según localización anatómica:
En este caso, solo se hace mención a la dimensión física, sin incluir el mecanismo subyacente. Esta clasificación puede ser útil para establecer diagnósticos diferenciales, pero no ofrece un marco apropiado para el manejo clínico del dolor.
La tipificación del dolor en el cáncer infantil puede llevarse a cabo usando una regla útil para sistematizar su causa. Consiste en preguntarse sobre las siguientes situaciones posibles:
¿El dolor es real o no?
¿El dolor se debe a la enfermedad de base?
¿El dolor se debe al tratamiento y los procedimientos?
¿El dolor está relacionado a la enfermedad?
¿Hay enfermedades concurrentes que estén provocando dolor? 4
Evaluación del dolor
La evaluación, como paso inicial para un manejo adecuado, requiere entrenamiento en el uso de escalas diseñadas y validadas para las distintas edades. En los niños es un todo un desafío por las características propias de su desarrollo neuropsíquico y por no poder expresarlo verbalmente en los primeros años de vida. Uno de los principales problemas que plantea el tratamiento del dolor en pediatría suele ser la dificultad para cuantificar la intensidad de las experiencias dolorosas.
Principales métodos utilizados para la evaluación del dolor en niños: 12)
Métodos conductuales: también denominados comportamentales, por estar basados en la observación de la variación de las respuestas del niño ante el dolor, en cuanto a su comportamiento. Son útiles en la etapa preverbal del niño, es decir, en los menores de 24 meses.
Métodos fisiológicos: alteraciones que el dolor puede producir en las diversas funciones del niño, que son más o menos medibles.
Métodos autoevaluativos: también descritos con los nombres de autovalorativos o de autoinforme, son los que más aceptación tienen y los más utilizados pero siempre a partir de los 4 años de edad.
Entrevistas estructuradas: estas entrevistas solo se pueden usar en niños ya mayores y en adolescentes, son muy sencillas de utilizar, se realizan en poco tiempo, no llega al cuarto de hora, sirven para conocer la información que sobre el dolor tiene el niño y para evaluar cómo se manifiesta el dolor.
Métodos de escalas: las escalas se agrupan en dos tipos, las numérico-verbales y las visuales- analógicas.
Escalas numéricas verbales: en ellas se puede reflejar la intensidad del dolor a intervalos, bien numéricos que suelen ir de 0 a 10, bien con expresiones verbales, que van desde nada de dolor, hasta dolor intenso.
Ejemplos:
a) Escala numérica del dolor.
b) Escala Likert.
c) Escala de los vasos.
d) Termómetro del dolor.
Escalas visuales analógicas: Útiles para niños mayores de 4 años, tienen la ventaja de que no hace falta que el niño comprenda bien los números o las palabras unidas al dolor; algo importante es que la escala que se utilice esté bien validada.
Ejemplos:
Escalas de dibujos faciales.
Escala de los < Ay> o de Oucher.
Escala frutal analógica.
Escala visual analógica.
Escala visual analógica de color.
Escala de las fichas de póker.
La valoración debe ser continua, dado que el proceso patológico y los factores que influyen sobre el dolor cambian con el transcurso del tiempo. Por tanto, siempre que el niño pueda hacerlo, la valoración del dolor deberá ser autodeclarada. Si el niño no tiene capacidad para hacerlo, la valoración la hará su cuidador principal y en segundo lugar los profesionales de la salud. Para ello es necesaria una buena comunicación entre ambos así como una valoración correcta de los parámetros vitales y las observaciones reflejadas en la historia clínica. 5,11
Cuando los niños son incapaces de describir su dolor con palabras, como ocurre con los bebés y en los niños pequeños o cuando tienen cualquier situación que impida hacerlo, deben ser observados cuidadosamente para detectar signos de su comportamiento que indiquen dolor. En ocasiones estos signos son muy sutiles, manifestándose como un malestar o dolor psicológico que solo son detectados por su cuidador. 1,11
Según la edad, el niño manifiesta el dolor de diferente manera.
Los recién nacidos (hasta un año de edad): se mueven menos de lo normal, lloran con más frecuencia y están muy inquietos, pueden estar pálidos y sudorosos, no comen bien y lloran si se les toca o mueve.
Los niños entre 1 y 3 años pueden llorar más de lo normal, están inquietos y tienden a moverse menos de lo normal. Pueden mostrar signos que sugieran localización del dolor, aunque no pueden afirmar explícitamente cuando lo sienten.
Los niños entre 3 y 6 años (preescolares) no siempre verbalizan su dolor. Se les puede preguntar y ayudar a localizar su dolor, incluso, con figuras del cuerpo para que indiquen la zona adolorida. Una vez localizada es necesario tratar de identificar la intensidad con alguna escala disponible.
Los niños entre 6 y 12 años son capaces de verbalizar y medir la intensidad del dolor. Pueden manifestar otros signos físicos y ser influenciados por creencias culturales.
Los adolescentes presentan manifestaciones similares a los adultos. Su dolor puede ir acompañado de insomnio, pérdida del apetito, aislamiento social, miedo y ansiedad o incluso enojo. 13-15
Tratamiento
En el enfoque integral del tratamiento del dolor en pacientes con un padecimiento oncológico se incluyen tanto medidas farmacológicas como no farmacológicas. Se considera efectivo cuando reduzca en un 30 % en la escala de evaluación de su sintomatología, con una mejoría concomitante en su capacidad funcional y la calidad de vida relacionada con su salud. El enfoque multidisciplinario se impone sobre la elección de una opción aislada. En este sentido, además de las opciones farmacológicas, el tratamiento puede incluir rehabilitación física, cambios en el estilo de vida, terapia psicológica y abordajes invasivos.
Tratamiento farmacológico:
El tratamiento con un fármaco aislado no es en general eficaz para aliviar el dolor, por lo que la combinación de medicamentos es de práctica habitual.
La vía oral es la de elección, tanto en dolor agudo como crónico, en su defecto puede utilizarse la vía rectal. Se desaconseja la vía intramuscular Si está canalizada una vía endovenosa, será la preferente en el dolor agudo. El empleo de un reservorio (tipo Port-a-cath) puede ser de gran utilidad. Los dispositivos electrónicos tipo PCA (analgesia controlada por el paciente) requieren una consideración individualizada en cada paciente a partir de los cinco años. Se ha de remarcar que este método ha de ser exclusivamente utilizado por el niño y nunca a demanda de la familia o del personal sanitario. 16
En la década de los 80, la Organización Mundial de la Salud (OMS) estableció un marco para el manejo general del dolor que han utilizado numerosas organizaciones. En 1998 confirmó los mismos principios para el manejo específicamente en el niño que padece de cáncer. Se definen cuatro pautas generales: 17,18
Por la vía apropiada
Por reloj: los analgésicos deben ser administrados de forma regular y no según dolor, el objetivo es prevenir su aparición; para ello es necesario que el paciente reciba la dosis antes que el dolor reaparezca.
Para cada niño: toda medicación se debe dosificar según las circunstancias de cada niño.
Por escalera: el esquema analgésico se elige según la intensidad del dolor.
La OMS en 1986 marcó, además el manejo del dolor en tres pasos para los pacientes con cáncer dependiendo de la severidad del dolor. 15,18
Primer peldaño: (dolor leve). Uso del paracetamol más analgésicos antiinflamatorios no esteroideos (AINE)
Segundo peldaño: (dolor moderado). Uso de opioides débiles, AINE y/o paracetamol.
Tercer peldaño: (dolor severo). Opioides fuertes AINE y/o paracetamol más técnicas intervencionistas.
Los coadyuvantes y medidas no farmacológicas puedes ser usados en cualquier nivel de la escalera analgésica. Es aceptado comenzar por el peldaño que más se ajuste al tipo e intensidad del dolor y ascender o descender en la escalera según las necesidades, lo que se conoce como ascensor analgésico, que junto a la terapéutica multimodal logran un mejor control.
El abordaje del tratamiento farmacológico del dolor con una escalera de dos peldaños demuestra ser una estrategia más efectiva que la anteriormente introducida por la OMS, para el manejo del dolor persistente en niños. En la escalera de tres peldaños se recomendaba la utilización de codeína para el tratamiento del dolor moderado, mientras que actualmente se considera la utilización de opioides fuertes a bajas dosis. 4
Los beneficios de utilizar estos últimos son mayores, en comparación a los beneficios que pudieran tener los opioides de potencia moderada. Los riesgos de la utilización de opioides fuertes para el dolor moderado son aceptables.
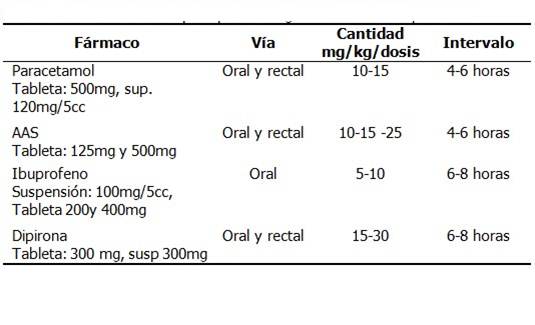
Antiinflamatorios no esteroideos (AINE) y paracetamol: son útiles para el dolor producido por procesos inflamatorios o metástasis óseas. Estos tienen un efecto techo, es decir, que no se obtiene mayor analgesia al incrementar la dosis, ni al combinar dos drogas de esta misma familia. (Tabla 1).
En la práctica médica actual se aboga, además, por el uso pediátrico del diclofenaco disponible en formulaciones resistentes a los ácidos gástricos (25 y 50 mg), rápidos comprimidos efervescentes (50 mg), formas de liberación lenta y controlada (75, 100 o 150 mg), supositorios (50 y 100 mg), y en fórmulas inyectables (50 y 75 mg).
Dosis recomendadas: niños de 1 a 12 años: 0,5-3 mg/kg/día repartidos en 2-4 dosis. Máximo de 150 mg/día. Niños > 12 años: la dosis inicial es de 50 mg cada 8-12 horas; la dosis de mantenimiento 50 mg cada 12 horas.
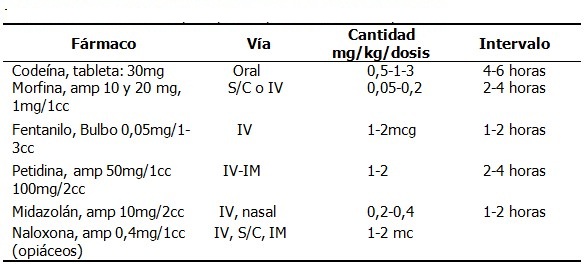
Opioides: no tienen dosis techo. La dosis correcta es la que alivia el dolor. El opioide recomendado por la OMS es la morfina (más económica y existen preparaciones magistrales). Son alternativas: la oxicodona, la metadona (opioide sintético de vida media larga y variable) y el fentanilo. 16,17) (Tabla 2).
Específicamente en el dolor por cáncer se ha extendido actualmente el uso del tramadol que tiene una afinidad selectiva por los receptores M 1. Una dosis de 10 mg equivale a una dosis de codeína de 6 mg. Las dosis habituales son: 0.5-1 mg/kg/8h intravenoso (niños menores de un año); 1-2 mg/kg/ 8h intravenoso (máximo 6 mg/kg/24h, niños mayores de un año). Perfusión continua 2-4 mcg/kg/minuto en adolescentes mayores de 12 años: Normalmente, la dosis recomendada de hidrocloruro de tramadol es de 50-100 mg cada 4-6 horas. No se debe exceder de 100 mg de tramadol por toma. Se presenta además en tabletas de 50 y 100 mg y gotas de 50mg en 10 ml.
La sobredosis de opioides es un hecho muy poco frecuente. Entre sus principales manifestaciones clínicas, se describe la depresión respiratoria acompañada de síntomas neurológicos, tales como somnolencia, embotamiento, bradipnea y miosis puntiforme. Cuando se produce, generalmente lo hace en pacientes vírgenes de opioides y es extremadamente rara la aparición en el paciente con un padecimiento oncológico al que se le ha titulado la dosis de manera adecuada.
Adyuvantes: son drogas que, habitualmente, se utilizan con otros fines terapéuticos, pero que asociadas a los analgésicos primarios propician una reducción de las dosis así como sus efectos secundarios y por tanto contribuyen al alivio del dolor. 4
Anticonvulsivantes: son útiles en el dolor de tipo punzante y paroxístico.
Gabapentina: inicialmente diseñado para el tratamiento de convulsiones parciales, su mecanismo de acción permanece desconocido, pero es útil en el tratamiento del dolor neuropático. Sus efectos adversos son poco frecuentes.
Carbamazepina: a pesar de ser una droga clásica para el manejo del dolor neuropático, actualmente no se la considera de elección.
Antidepresivos: su acción se relaciona con el bloqueo de la recaptación de noradrenalina y serotonina en la brecha presináptica. Mejoran el estado de ánimo, poseen efecto analgésico directo y ejercen una acción sinérgica con los opioides. La amitriptilina es la droga más comúnmente utilizada. Tiene buena absorción en el tracto gastrointestinal, con una vida media prolongada (20 a 80 horas). Esto la convierte en el agente ideal para administrarlo una vez al día, preferentemente en la noche para hacer uso de sus propiedades sedantes.
Antagonistas NMDA: pueden ser utilizados para cualquier tipo de dolor ya sea neuropático, inflamatorio, o debido a enfermedad vascular periférica. La metadona combina la acción opioide con el antagonismo de los receptores NMDA. La ketamina a dosis subanestésicas, tiene efecto analgésico, sin alterar el estado de conciencia. Puede ser administrada por vía subcutánea.
Corticosteroides: inhiben la producción de prostaglandinas con disminución del edema e inflamación asociado a metástasis. Son útiles para aliviar el dolor por compresión de vías nerviosas, metástasis óseas, cefalea por hipertensión endocraneana y para el dolor secundario a distensión capsular. La dexametasona es la más comúnmente utilizada por su potencia, duración de efecto y mínima acción mineralocorticoide. Debido a la constelación de efectos adversos que produce, es conveniente su utilización por pulsos, es decir ciclos cortos de 3 a 5 días, que deben ser repetidos cuando los síntomas lo hagan necesario.
Los coadyuvantes y medidas no farmacológicas pueden ser usadas en cualquier peldaño.
Tratamiento no farmacológico: 4,19,20,21,22,23,24
Estas estrategias forman parte integral del tratamiento del dolor, complementan el tratamiento medicamentoso adecuado, pero no lo sustituyen.
Medidas físicas: afectan los sistemas sensoriales (presión, masaje, frío, calor, estimulación nerviosa eléctrica transcutánea).
Medidas psicológicas: (cognitivas): influencian los pensamientos del paciente, modifican el foco de atención [distracción, visualización, musicoterapia] (conductuales): tienden a modificar conductas (relajación, técnicas de respiración).
La radioterapia: se utiliza en las en las metástasis óseas o local para el dolor localizado por infiltración tumoral.
Bifosfonatos: inhiben la resorción ósea, se utilizan en el tratamiento de la hipercalcemia y las metástasis.
Las cirugías paliativas.
Conclusiones
En el origen del dolor, influyen no solo aspectos orgánicos, sino también factores emocionales, sociales y hasta económicos. Si no se interviene sobre estas áreas, el dolor puede transformarse en un síntoma intratable, a pesar de estar adecuadamente manejado desde el punto de vista farmacológico. Al abordar a un niño con dolor, se debe hacerlo con un enfoque interdisciplinario para poder contemplar cada uno de los aspectos que intervienen y poder brindar el alivio adecuado.