INTRODUCCIÓN
El glutatión reducido (GSH) desempeña funciones vitales para las células. Se reconoce su papel en la protección del daño oxidativo y en la destoxificación de xenobióticos y quimiofármacos. Así como, en la regulación de procesos claves como la proliferación y la muerte celular. Por lo que las alteraciones en la homeostasis del GSH han estado implicadas en varias enfermedades, entre las que se puede mencionar el cáncer. 1
De manera particular, en los tumores como el cáncer de pulmón (CP), la homeostasis del GSH se encuentra frecuentemente disregulada y los cambios en los niveles de este tripéptido, se han vinculado a los mecanismos de quimioresistencia, sin embargo, los eventos que vinculan al sistema del GSH con los procesos de resistencia a los quimiofármacos son extremadamente complejos y no están del todo esclarecidos. En este sentido, estudios in vitro sugieren que el incremento de las concentraciones de GSH durante la aplicación de los tratamientos puede promover mecanismos de resistencia a través de la inhibición de los procesos de apoptosis y promoviendo la expresión de enzimas destoxificadoras como la glutatión S-transferasa, la glutatión sintetasa y de proteínas transportadoras, como la proteína asociada a la resistencia multidrogas (MRP1). Esta última proteína participa como transportador de varios citostáticos como el cisplatino, la vincristina, el etopóxido y la doxorrubicina y requiere para su actividad al GSH como sustrato. 2
En estadios avanzados del CP los esquemas de poliquimioterapia (PQT) continúan siendo los de mayor elección, de acuerdo con su efecto en la supervivencia de los pacientes. En este sentido las terapias citotóxicas más empleadas incluyen en el esquema a agentes alquilantes como el cisplatino, el que se combina con otros quimiofármacos como la vinblastina y el etóposido en función de lograr una mejor respuesta terapéutica y para tratar de minimizar los eventos de quimiorresistencia descritos para el cisplatino. 3,4
Pocos estudios han abordado los cambios en la homeostasis del glutatión reducido en pacientes con cáncer de pulmón después de finalizado el régimen de poliquimioterapia. En este contexto el objetivo del presente estudio fue evaluar el efecto de la poliquimioterapia con cisplatino y vinblastina en los niveles intracelulares de glutatión reducido, glutatión oxidado (GSSG) y en el estado redox celular en pacientes con cáncer de pulmón de células no pequeñas (CPCNP) en estadios avanzados.
MÉTODOS
Se realizó un estudio observacional, analítico, de casos y controles. La muestra de estudio estuvo conformada por 38 pacientes confirmados con CPCNP en estadios avanzados (IIIB/IV) con una edad promedio de 63 años y de ambos sexos. Todos los pacientes incluidos en el estudio fueron diagnosticados en el período correspondiente a mayo del 2016 a mayo del 2018 en el Hospital Neumológico Benéfico Jurídico (HNBJ) y fueron tratados solamente con un régimen de PQT basado en la combinación de cisplatino con vinblastina, según los protocolos establecidos por el servicio del HNBJ. En el grupo control fueron incluidos 25 sujetos aparentemente sanos con una edad promedio de 52 años y de ambos sexos. Estas personas fueron previamente entrevistadas y se les realizó un examen físico y estudios de laboratorio clínico (pruebas de función hepática, glicemia, creatinina, lipidograma y parámetros hematológicos), para confirmar su estado de salud. Además, se constató la no utilización de suplementos antioxidantes y hábitos tóxicos como el consumo de alcohol y el tabaquismo. Se descartaron procesos infecciosos agudos o enfermedades crónicas en agudización.
Para las determinaciones de los marcadores del estado redox del GSH, a todos los participantes se les extrajeron 2 ml. de sangre venosa en ayunas, la que se colectó en tubo con EDTA-K2 como anticoagulante. En el caso de los pacientes la muestra se tomó al culminar el tratamiento oncológico.
Para la realización del estudio se obtuvo el lisado de eritrocitos. Posteriormente, se realizó el pre-tratamiento del lisado celular, el que consistió en la desproteinización con ácido perclórico al 10 % (5:1, v/v). La separación cromatográfica del GSH y del GSSG, así como el cálculo del potencial redox del par GSH:GSSG, indicador del estado redox celular, se realizó según reportes previos del grupo de trabajo. 5) Todos los procedimientos se llevaron a cabo dentro de las dos horas posteriores a la extracción.
Los resultados se expresaron como medias +/- desviación estándar. Se utilizó la prueba no paramétrica U-Mann Whitney para la comparación de las medias aritméticas de las variables de respuesta (pacientes tratados vs. controles). La significancia estadística se estableció a partir de p<0,05. Todos los análisis se realizaron con el paquete estadístico STATISTICA versión 8.0 para Windows.
En el desarrollo de la presente investigación se tuvieron en cuenta los criterios establecidos en la Declaración de Helsinki de 1975, modificada en el 2013. Todos los participantes se incluyeron en el estudio luego de que emitieran voluntariamente su consentimiento. El proyecto de investigación fue revisado y aprobado por el Comité de Ética del Centro Nacional de Genética Médica.
RESULTADOS
A continuación se relacionan los marcadores estudiados en el grupo de pacientes tratados con PQT y los controles. (Tabla 1).
Tabla 1 Resultados de los marcadores estudiados en pacientes tratados con PQT (n=38) y controles (n=25)

*Los resultados de los marcadores son expresados en Media ± SD (Desviación estándar), †p: nivel de significación
Una vez concluido el tratamiento oncológico, los pacientes mostraron una disminución significativa en las concentraciones de GSH (p=0,036), sin embargo, las concentraciones de GSSG no difieren entre los grupos (p=0,498). (Gráfico 1).
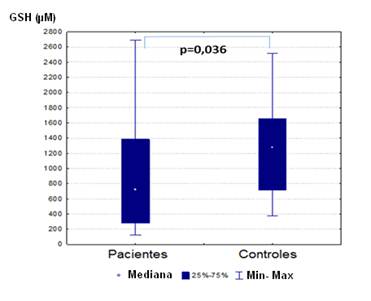
Gráfico 1 Concentraciones intraeritrocitarias de GSH en los pacientes una vez concluido el tratamiento y controles. Prueba U-Mann Withney, p=0,036
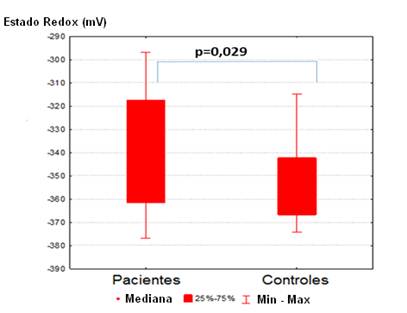
El estado redox celular, determinado por el potencial redox del par GSH:GSSG muestra variaciones entre el grupo de pacientes tratados y los controles. Los sujetos sanos mostraban en valores absolutos un potencial redox mayor, -353 mV como promedio, lo que indica un potencial redox más reductor. En contraste con los pacientes tratados, los que mostraban un potencial más positivo, -338 mV como promedio, lo que sugiere un ambiente redox más oxidante. (Gráfico 2).
DISCUSIÓN
Los tratamientos oncológicos no quirúrgicos, como la PQT están indicados en aquellos pacientes en los que la cirugía no es posible por el grado de extensión clínica de la enfermedad. Su intención es paliativa, para intentar mejorar la calidad de vida y en otros casos para aumentar la supervivencia. La mayoría de los quimiofármacos en su mecanismo de acción promueven citotoxicidad y liberación de ciertas especies reactivas del oxígeno (ERO). 6) En el caso particular del cisplatino da lugar a varias respuestas citotóxicas entre las que se incluyen: aumento de los procesos de peroxidación lipídica, la disfunción mitocondrial, inhibición de la síntesis proteica y daños al material genético. 7
Los datos obtenidos en la presente investigación indican que una vez finalizado el tratamiento oncológico los pacientes muestran una disminución significativa en las concentraciones de GSH. En este contexto la depleción que se observa podría estar relacionada fundamentalmente a las funciones destoxificadoras de este compuesto, teniendo en cuenta que el grupo sulfidrilo del GSH tiene una alta afinidad al platino (7,8) y por otra parte, no hay diferencias en los niveles de GSSG entre los grupos estudiados.
En concordancia con estos hallazgos, Srivastva y cols. reportaron que los niveles de GSH disminuyen con el incremento de los ciclos de quimioterapia en los pacientes con CPCNP. 9) En un estudio similar, realizado en pacientes con CP tratados con radioterapia y posteriormente con carboplatino, los autores refieren que al final de la terapia empleada, los pacientes mostraban una disminución del nivel de GSH intraeritrocitario, lo que se encontraba condicionado a la formación del complejo GSH-platino y que este proceso guardaba relación al tiempo del tratamiento. 10
Por otra parte, basado en resultados de estudios experimentales, los que revelan que cuando se reducen los niveles de GSH, se observa un aumento significativo en la sensibilidad al cisplatino, 11 se podría esperar una respuesta favorable en los pacientes tratados, aspecto que deberá ser abordado en futuras investigaciones y constituye una de las limitaciones del presente trabajo.
Los agentes que alteran las concentraciones de GSH pueden afectar la expresión de enzimas detoxificadoras, la proliferación celular y la apoptosis, debido a que los mecanismos de señalización redox participan en la regulación de estos eventos celulares. 7,8) Los resultados indican que la deficiencia del GSH afecta la relación GSH:GSSG y por consiguiente se producen cambios en el estado redox celular. Este marcador no solo va a reflejar la presencia de condiciones de estrés oxidativo sino también las posibles afectaciones en la señalización y control redox. 11) En el marco de esta investigación la relación GSH/GSSG en los pacientes tiende hacia un estado más oxidativo, contexto en el que se pueden activar cascadas de señalización que reducen la proliferación celular e incrementan los procesos de apoptosis, lo que constituiría el efecto terapéutico esperado. En este sentido, se ha descrito que la alteración del estado redox mediado por la modulación de las ERO puede impactar en la sensibilidad al cisplatino. 12,13) Estos resultados podrían ser el punto de partida para una evaluación personalizada de la respuesta de los pacientes a la PQT, aspecto que debería ser considerado en estudios próximos.
Finalmente, el régimen de poliquimioterapia con cisplatino y vinblastina induce una disminución de los niveles intraeritrocitarios de GSH y cambios en el estado redox celular. Estos efectos podrían contribuir a una mayor supervivencia en los pacientes que responden al tratamiento.