Introducción
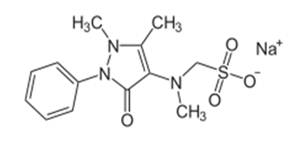
La COVID‐19 es una enfermedad reciente debido al surgimiento de un nuevo coronavirus de ARN, que se caracteriza por el síndrome respiratorio agudo severo coronavirus 2 (SARS‐CoV‐2). Entre los síntomas más comunes de la enfermedad y que son similares a los de la gripe se encuentran la fiebre, tos y astenia, entre otros, y puede progresar a neumonía intersticial grave y a otras enfermedades respiratorias agudas. Entre los medicamentos antipiréticos y analgésicos ampliamente utilizados en la etapa epidémica se encuentra el Metamizol o Dipirona; debido a la disponibilidad del fármaco, bajo costo y su alta prevalencia en el tratamiento del dolor y de la fiebre. (Tsahi T. Lerman et al, 2021; Hearn L, Derry S, Moore RA, 2016, Edwards J et al, 2002 y Hinz Bet al, 2007). El Metamizol o Dipirona es un derivado de la pirazolona, (acido 1,5-dimetil-3-oxo-2-fenilpirazol-4il)-metilamino] metanosulfónico (IUPAC) (Metamizole, 2020, https://doi.org/10.1111/bcp.14703), con propiedades farmacológicas antiinflamatoria no esteroideo (AINE) e inhibidor de la síntesis de prostaglandinas (Figura 1).
Es un analgésico superior al paracetamol en dolores agudos de tipo moderado o medio; útil en dolores de tipo cólico. Es un pro-fármaco, que se hidroliza específicamente en dos agentes activos|: N-metil-4-aminoantipirina (MAA) y 4-Aminoantipirina (AA). (Jasiecka A, Maślanka T, Jaroszewski JJ, 2014).
Debido al surgimiento y propagación de la enfermedad COVID-19 en Cuba y al cese de la importación desde China de este medicamento (Dipirona-600, inyectable); fue necesario realizar su producción en Cuba (Laboratorios Farmacéuticos AICA, UEB AICA+), para su empleo en el tratamiento de la fiebre y el dolor en los pacientes con COVID y otros pacientes. En el Laboratorio de Control de la Calidad UEB AICA+ la valoración del Metamizol sódico (ingrediente farmacéutico activo, IFA) en la Dipirona-600 y el Espasmoforte, se realiza por un método volumétrico (Iodometría, técnica del fabricante). Este método es el más empleado en la industria farmacéutica, y está descrito en diferentes Farmacopeas (Farmacopea Argentina, 2013, Farmacopea Británica 2020, Real Farmacopea Española, Edición 3, 2005, Farmacopea China, 1990 y Farmacopea Brasileña, 2010). Tiene como desventaja, que es inespecífico y engorroso porque requiere de condiciones controladas (bajas temperaturas); debido a que diferentes factores pueden afectar su exactitud. Además, la Dipirona es fotosensible y se oxida fácilmente. Debido a esto, se procedió al montaje y validación de un método cromatográfico (HPLC) que resultara rápido, sencillo y específico para la valoración del Metamizol Sódico (Materia prima) y en los inyectables Dipirona-600 y Espasmoforte; con vista a su implementación en los Laboratorios de Control de la Calidad físico-químico y mecánico, y en el de Control de Proceso; y para la realización de los estudios de estabilidad.
Materiales y Métodos
Reactivos y Materiales
Metamizol sódico (Patrón secundario, Código: 205401, Valoración HPLC: 99.08 % y Agua: 5.14 %). Agua para inyección (Código: A2005118, UEB AICA+), disolución de Hidróxido de sodio 10 % (UEB AICA+), Ácido acético glacial (Lote: K51195756909, Merck), Acetonitrilo grado gradiente para HPLC (Lote: I0988730901, Merck), Metabisulfito de sodio (MP-8012191064, Lote: K50695357).
Se emplearon los materiales siguientes: Cristalería del laboratorio certificada: Probeta de 1000 mL, matraces volumétricos de 10 mL y 25 mL. Micropipetas variables 100-1000 µL; Discovery y 20-200µL (Calibrada y Certificada Lab. Metrología AICA). Puntas amarillas para micropipetas, papel indicador de pH 0.5-5.5 (SIGMA-ALDRICH) y de pH 0-14 (Whatman).
Muestras de ensayo
Materia prima (IFA): Metamizol sódico, Lotes: C01-1800550, C 01-1800551, C01-1800552, C01-1800553, C01-1800569, C01-1800570 y C01-1800571 (Wuhan Wuyao Pharmaceutilcal, China).
Producto terminado: Dipirona-600 (Lotes: D22006, D22009, D22022 y D22028, UEB AICA+) y Espasmoforte (Lote: E2005).
Equipamiento
Balanza analítica Secura 224/1S (Sartorius, Alemania, ANO), estufa 30-360 (MEMMERT, Alemania), pHmetro GLP21 (Crison, CEE). Cromatógrafo Líquido (HPLC) Prominence (Shimadzu, Japón) equipado con desgasificador DGU-20A 5R, bomba cuaternaria LC-20 AD, auto inyector SIL-20 AC, horno CTO-20 AC, detector UV-Vis SPD-20 AV y controlador CBM-20 A acoplado a computadora. Se empleó el software LabSolutions para la adquisición y procesamiento de los cromatogramas.
Condiciones cromatográficas:
Se empleó un método descrito por Daniella Carla Napoleão y col. 2015, al cual se le hicieron pequeñas modificaciones en relación a la composición de la fase móvil y el rango: como fase móvil una mezcla de Ácido acético glacial al 10 % y Acetonitrilo (75:25, v/v). Se empleó una columna Nucleosil RP-18, 100, 5 µm, 250 x 4.6 mm (KNAUER, Alemania), a flujo de 0.7 mL/min y temperatura de 300C. El volumen de inyección fue de 10 µL y la detección a una longitud de onda (λ) de285 nm. El tiempo de corrida o adquisición fue de 8 minutos.
Evaluación de los Parámetros de validación
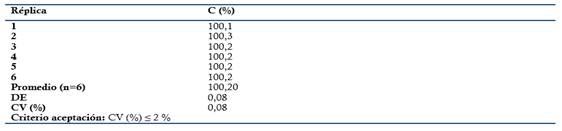
Aptitud sistema: Se evaluó a partir de un patrón de Metamizol sódico a concentración teórica correspondiente al 100 % (0.3 mg/mL). El mismo fue analizado seis veces. Criterios de aceptación: Factor asimetría o cola: ≤ 2, resolución (Rs ≥ 1.5) entre la sustancia relacionada de la Dipirona y Coeficiente de variación (CV ≤ 2 %) para inyecciones repetidas (n= 6).
Especificidad: Se analizaron por triplicado el Diluente (Fase Móvil), patrón Metamizol sódico a concentración de 100 %, el placebo correspondiente a ambos inyectables (Dipirona-600 y Espasmoforte) y las muestras de ensayo (Dipirona-600 y Espasmoforte). Criterio de aceptación: No se observan picos interferentes al analizar el diluente y el placebo con el tiempo de retención (tr) correspondiente al Metamizol sódico (IFA), obtenidos tanto para el patrón y las muestras de ensayo.
Especificidad por degradación: Se evaluó además para las muestras de producto terminado Dipirona-600 (Lote: D22006) y el Espasmoforte (Lote: E2005) sometidas a una degradación forzada o ensayo de estrés: Debido a la estructura química del IFA, fácilmente oxidable, se empleó como agente oxidante (oxidación) el oxígeno ambiental para lo cual las muestras del inyectable se dejaron a temperatura ambiente hasta que ocurra un cambio de coloración incoloro o ligeramente amarillo a amarillo (5 h). Para la Fotólisis se expuso el inyectable a una λ = 254 nm durante 1 h y para la Termólisis se sometió el inyectable a 70 0C durante 1 h. Para la Hidrólisis básica y ácida a 3 mL del inyectable se adicionó 0.5 mL de NaOH 1 mol/Litro o HCL 1 mol/Litro, se calentó a 70 0C durante 1 h, respectivamente. Para el análisis de las muestras por el cromatógrafo, se neutralizaron y/o ajusto el pH entre 2-8 para evitar daño de la fase estacionaria de la columna. Criterio de aceptación: El método es específico si los picos desconocidos obtenidos durante el ensayo de estrés o degradación forzada no interfieren con los tiempos de retención (tr) correspondiente al Metamizol sódico (Resolución, Rs ≥ 1.5) obtenido en la muestra de ensayo (Dipirona-600).
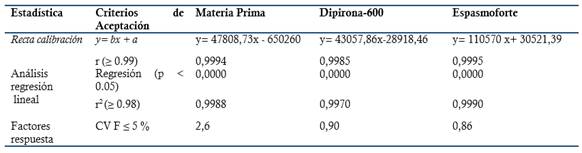
Linealidad del sistema: Se prepararon tres réplicas de curva de calibración en fase móvil. Se empleó como rango de concentración: 80-120 % (Concentración final HPLC: 0.24-0.36 mg/mL, Dipirona-600 y 0.20-0.30 mg/mL para el Espasmoforte). Criterios de aceptación: Análisis de regresión lineal (r ≥ 0.99, p ≤ 0.05, r2≥ 0.98, pendiente recta calibración (b) significativo 0 (p ≤0.05) e intercepto (a) no significativo 0. Coeficiente variación de los factores respuesta: CVF ≤ 5 %.
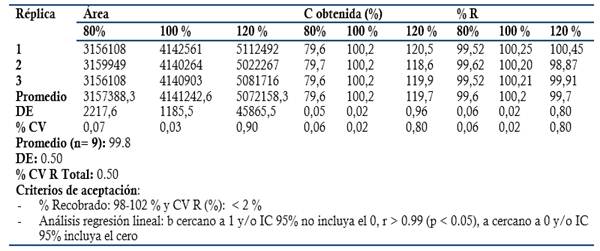
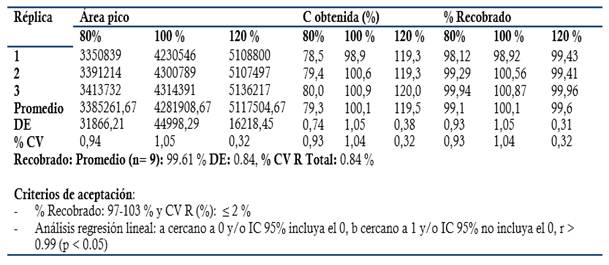
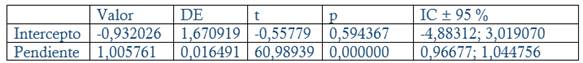
Exactitud: Se prepararon tres réplicas a concentración teórica correspondiente al 80, 100 y 120 % Concentración final HPLC: 0.24, 0.3 y 0.36 mg/mL en el placebo correspondiente (Disolución acuosa de metabisulfito de sodio a concentración final 0.002 mg/mL). Criterios de aceptación: Recobrado entre 97-103 % para la materia prima, 98-102 % (Producto Terminado, Dipirona-600) y % CV Total Recobrado ≤ 2 %. Análisis regresión lineal: r ≥ 0.99 (p ≤ 0.05), Pendiente recta (b) cercano a 1, p ≤ 0.05 y/o intervalo de confianza 95 % (IC 95 %) no incluya el 0. Intercepto (a) no significativo de cero (p ≥ 0.05) y/o el IC 95 % incluya el 0.
Precisión: Se prepararon tres réplicas a concentración teórica correspondiente al 100 % (Concentración final HPLC: 0.3 mg/mL). Para evaluar la Repetibilidad se analizaron por sextuplicado en el mismo día y analista, y para la Precisión intermedia fueron analizadas por triplicado por dos analistas en dos días consecutivos. Criterio de aceptación para la Repetibilidad: CV ≤ 2 % para el ensayo de Repetibilidad. Criterio de aceptación para la Precisión intermedia: CV Total % ≤ 2 % (Analistas y Días) y ANOVA: no diferencias en los resultados obtenidos entre los analistas y días (p ≥ 0.05).
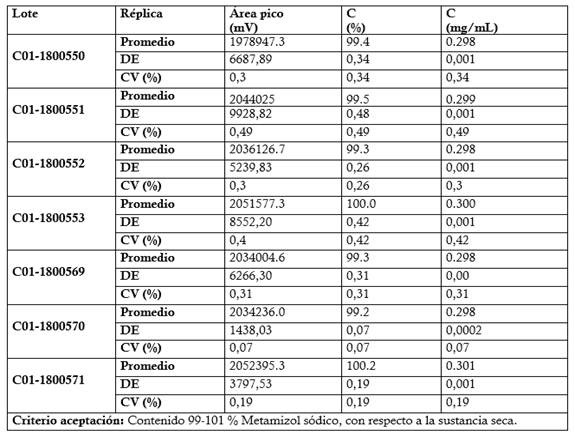
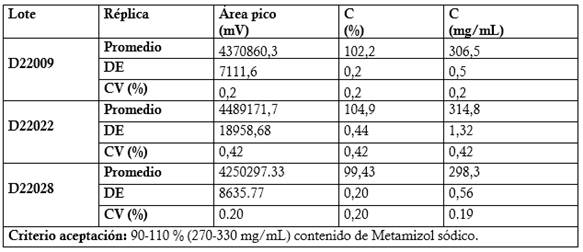
Valoración de las muestras de ensayo (Materia prima y productos terminado: Dipirona-600 y Espasmoforte): Se prepararon tres réplicas a concentración teórica correspondiente al 100 % (Concentración final HPLC: 0.3 mg/mL) para las muestras de materia prima (7 lotes) y producto terminado (tres lotes de Dipirona-600 y un lote de Espasmoforte). Criterios de aceptación para el contenido del Metamizol sódico: 99-101 % para la materia prima (IFA), con respecto a la sustancia seca y para los productos terminado de 90-110 % (270-330 mg/mL, Dipirona-600) y (225-275 mg/mL, Espasmoforte).
Análisis estadístico
Para el procesamiento estadístico de los resultados se trabajó para una probabilidad del 95 % (p= 0,05) y se emplearon los programas Excel y el STATISTIC 7.0.
RESULTADOS y DISCUSIÓN
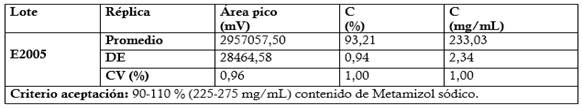
El método por HPLC validado para la valoración del Metamizol sódico en la materia prima y los productos terminados (Dipirona-600 y Espasmoforte) es rápido (tiempo corrida 8 min), sencillo y específico (Figura 2). Se obtuvieron tiempos de retención de 4,8 min, correspondiente a una sustancia relacionada C o E de los cuatros sustancias relacionadas y de 5,7 min para el Metamizol sódico (Dipirona) con resolución entre los picos de 2.17 (≥ 1.5) y factor asimetría de 1.20 y 2.0, respectivamente). El método propuesto permite la detección (285 nm) y cuantificación de una de las cuatro sustancias relacionadas, la misma no se pudo identificar por no contar con los patrones correspondientes; lo cual constituye una limitación del estudio. Además, a los 4,8 min co-eluye también el metabisulfito de sodio, agente antioxidante que se emplea en ambos inyectables al analizar el placebo.
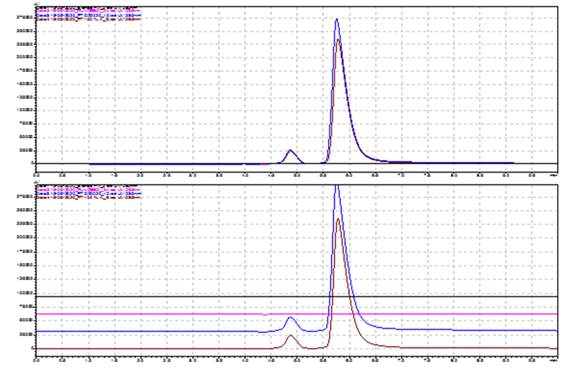
Fig. 2 Cromatogramas obtenidos en la evaluación de la especificidad del método para la valoración de la Dipirona-600 (Materia Prima y Producto Terminado).
Leyenda Negro: Fase móvil (Diluente del patrón) Morado: Placebo (Dipirona-600)Carmelita: Patrón de Metamizol sódico a concentración correspondiente al 100 % (Sust. Relacionada tr1 = 4.8 min ± 0.001 y Metamizol sódicotr2= 5.75 min ± 0.001
Azul: Dipirona-600 (Lote D22022), a concentración correspondiente al 100 % (Sustancia Relacionada: tr1: 4.8 min y Metamizol sódico tr2: 5.78 ± 0.001)
Entre los métodos instrumentales descritos en la literatura el más empleado es la Cromatografía de Alta Resolución (HPLC) en fase reversa (C-8 y C-18) para el análisis de la Dipirona, sus productos de degradación y de las sustancias relacionadas en diferentes tipos de muestras: formulaciones farmacéuticas (tabletas e inyectables) y muestras ambientales (Mayorga R, Sánchez JE, Gutiérrez RF, Calixto-Romo M., 2017; Daniella Carla Napoleão, Daniela Ribeiro da Silva, Joan M. Rodríguez Díaz, Mohand Benachour, Luis R. Bravo Sánchez y Valdinete da Silva, 2015; Chusnul Chotimah, Sudjadi, Sugeng Riyanto, and Abdul Rohman, 2015; Galaon T, Radulescu M, David V, Medvedovici A. 2012 ySenyuva H, Ozcan S, Aksahin I, Kabasakal B, 2005). La composición de la fase móvil varía, desde el empleo de mezclas sencillas y complejas con uso de disoluciones amortiguadoras, pares iónicos, etc. La detección se realiza en el ultravioleta y pueden emplearse diferentes longitudes de onda (254 nm, 275 nm, 285 nm y 290 nm); debido al espectro de absorción ultravioleta del Metamizol sódico. Los métodos espectrofotométricos también han sido empleados para la valoración del Metamizol o Dipirona, con detección en el ultravioleta a longitudes de onda entre 200-290 nm. (Achim H, 2018 y Quino, Israel; Choque, Rigoberto; Cáceres C., Luis Fernando, 2005). A pesar que el máximo de absorción es a 271 nm, se empleó la longitud de onda de 285 nm porque permite una mejor detección de una de las sustancias relacionadas/productos de degradación; y del metabisulfito de sodio empleado como antioxidante en ambos inyectables (Dipirona y Espasmoforte).
El método también es específico para la valoración de la Dipirona en el Espasmoforte, inyectable que contiene dos IFA (Dipirona y el Clorhidrato de Camilofina) (Figura 3). Además, se demostró que el método también es específico para el análisis de muestras de Dipirona-600 sometidas a degradación forzada (Ensayo de estrés) (Tabla 1 y 2); porque los picos desconocidos obtenidos no interfirieron con el tiempo de retención correspondiente al Metamizol sódico y la resolución entre los picos fue de 1.5-4.8.
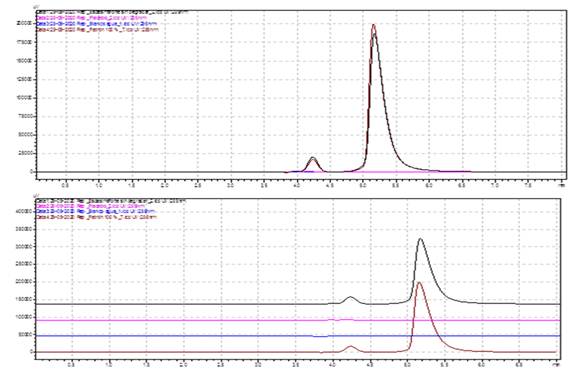
Fig. 3 Cromatogramas obtenidos en la evaluación de la especificidad del método para la valoración del Espasmoforte (Producto Terminado).
Leyenda:Azul: Diluente (Agua para inyección) Carmelita: Patrón de Metamizol sódico (100 % ó 250 mg/mL)Morado: Placebo Negro: Espasmoforte (Lote: E2005)Pico 1: Sustancia relacionada del Metamizol sódico tr1: 4,24 min Pico 2: Metamizol sódico tr2: 5,17 min.
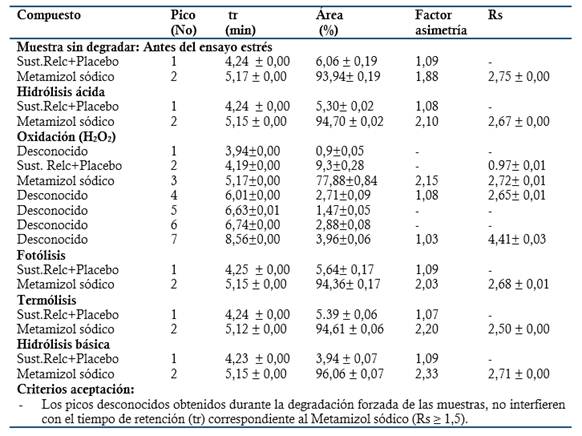
Tabla 1 Resultados obtenidos en la evaluación de la especificidad del método: Ensayo de estrés o degradación forzada de la Dipirona-600 (Lote: D22006, UEB aica+). (Promedio ± DE, n= 3).
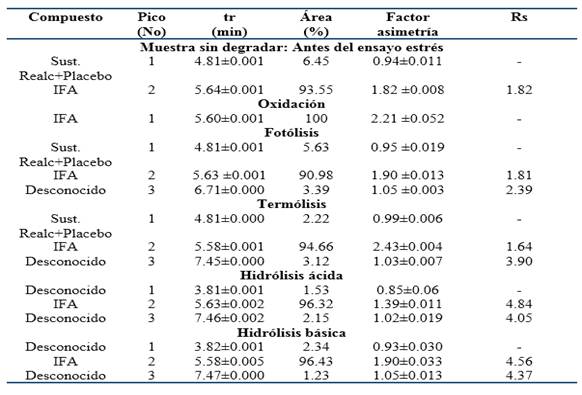
Para las muestras sometidas a:
Fotólisis: se obtuvo una degradación del 5.63 % (Valoración final 94.37 %) y un pico desconocido a los 6.71 min.
Termólisis: se determinó una degradación de un 3.12 % (Valoración final 96.88 %) y se observó un pico desconocido a los 7.45 min.
Oxidación: resultó una degradación del 15.43 %, con incremento del área del pico en relación al blanco correspondiente.
Hidrólisis ácida: mostró una degradación de un 3.68 % (Valoración final 96.32 %) y se obtuvieron dos picos desconocidos a tiempo de retención de 3.81 min y 7.46 min.
Hidrólisis básica: se obtuvo una degradación del 3.57 % (Valoración final 96.43 %) y se observaron dos picos desconocidos a tiempo de retención de 3.82 min y 7.47 min.
Tabla 2 Resultados obtenidos en la evaluación de la especificidad del método: Ensayo de estrés o degradación forzada para el Espasmoforte (Lote: E2005, UEB aica+). (Promedio ± DE, n= 3)
En resumen, el método cromatográfico validado es específico para el análisis de las muestras sometidas a degradación forzada, obteniendo por cientos de degradación del IFA para la Dipirona-600 no mayor del 20 %; y la degradación fue mayor para las muestras sometidas a oxidación y fotólisis, lo cual coincide con lo descrito en la literatura especializada. (Daniela Carla Napoleão, 2015)
El método es lineal en el rango de concentración evaluado (80-120 % contenido Metamizol sódico para la Dipirona-600 y el Espasmoforte) (r≥ 0.99, p = 0,000 y r2≥ 0.98, Tabla 3 y Figura 4, 5 y 6), exacto con por ciento de recobrado mayor del 99 % para los tres niveles de concentración evaluados para el IFA y la Dipirona-600 (Tabla 4 y 5 y Figura 7 y 8, 9, 10 y 11); y preciso con coeficiente de variación menor 2 % en ambos ensayos (Tabla 6, 7 y 8). No hubo diferencias en los resultados obtenidos entre los analistas y los días (Precisión intermedia), obteniendo coeficiente de variación menor al 2 %.
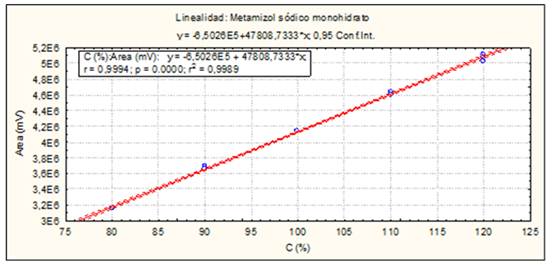
Fig. 4 Linealidad del sistema (Materia Prima, IFA): Curva de calibración: área del pico contra concentración (%) del Metamizol sódico.
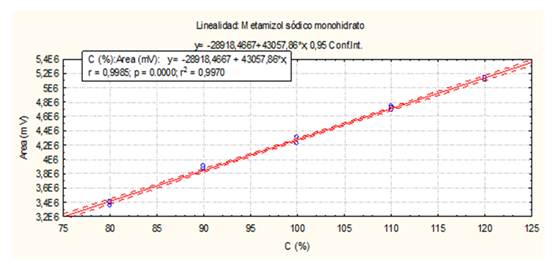
Fig. 5 Linealidad del sistema (Dipirona-600): Curva de calibración: área del pico contra concentración (%) del Metamizol sódico.
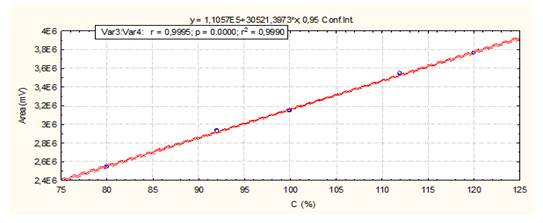
Fig. 6 Linealidad del sistema (Espasmoforte): Curva de calibración: área del pico contra concentración (%) del Metamizol sódico.
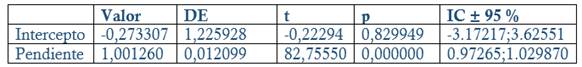
Fig. 7 Evaluación de la linealidad del método para la exactitud (IFA): Concentración obtenida (%) contra concentración teórica (%)
Tabla 7. Evaluación de la Precisión: Ensayo de Precisión intermedia evaluando la influencia de los días en los resultados.
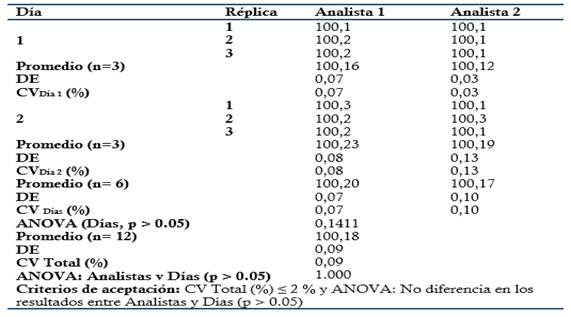
Tabla 8 Evaluación de la Precisión: Ensayo de Precisión intermedia evaluando la influencia de los analistas en los resultados.
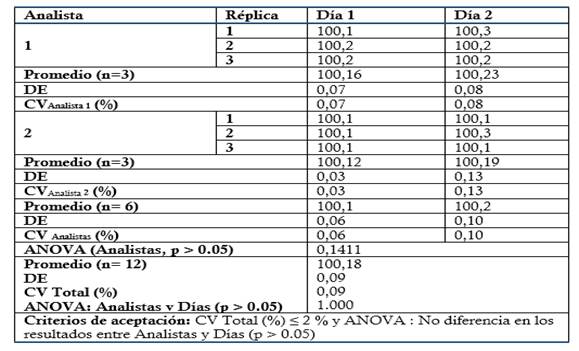
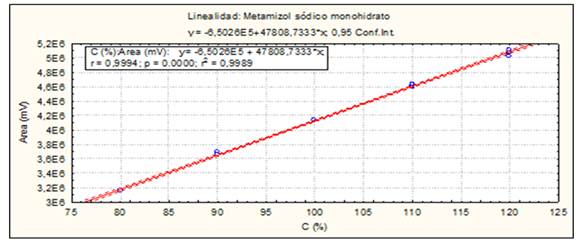
Fig. 9 Linealidad del sistema (Materia Prima, IFA): Curva de calibración: área del pico contra concentración (%) del Metamizol sódico.
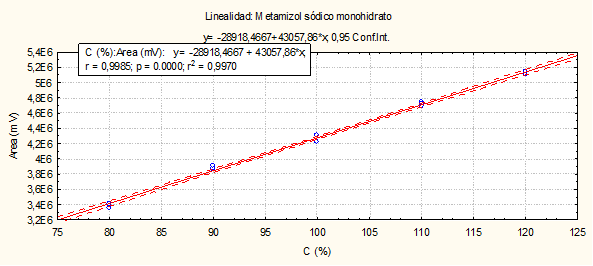
Fig. 10 Linealidad del sistema (Dipirona-600): Curva de calibración: área del pico contra concentración (%) del Metamizol sódico.
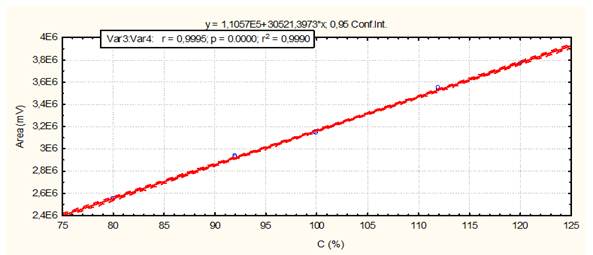
Fig. 11 Linealidad del sistema (Espasmoforte): Curva de calibración: área del pico contra concentración (%) del Metamizol sódico.
El método cromatográfico validado, se empleó en la valoración de siete lotes de materias primas, tres lotes de Dipirona-600 y un lote de Espasmoforte (Tabla 9, 10, 11 y 12), obteniendo resultados satisfactorios al cumplir con los criterios de aceptación para el contenido de 99-101 % respecto a la sustancia seca (Farmacopea Británica, 2020) y de 90-110 % (Técnica del fabricante); respectivamente.
Debido a los resultados obtenidos en la validación del método, se puede emplear para realizar la valoración del Metamizol sódico o Dipirona (Materia prima y producto terminado) en los Laboratorios de Control de Proceso, de Control de la Calidad; y en los estudios de estabilidad de los inyectables: Dipirona-600 y el Espasmoforte.
Conclusiones
El método cromatográfico (HPLC) validado para la valoración del Metamizol sódico, en la materia prima y los productos terminado (Dipirona-600 y Espasmoforte), cumplió con los criterios de aceptación para cada parámetro de validación o desempeño evaluados. El mismo se implementó en los laboratorios de control de la calidad físico-químico y mecánico (UEB AICA+) y en la realización de los estudios de estabilidad.