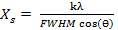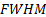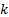INTRODUCCIÓN
La búsqueda de materiales sustitutivos del tejido óseo constituye hoy día una de las temáticas de mayor actividad para la Ingeniería Biomédica. Diferentes investigaciones se realizan con el objetivo de encontrar un biomaterial en una estructura 3D que permita al unísono: restablecer la continuidad del tejido óseo lesionado sin provocar eventos adversos (biocompatibles), cumplimentar las exigencias mecánicas del sitio de implante (biofuncionales), acelerar los procesos de osteosíntesis y contribuir a la formación de nuevos vasos sanguíneos; implantes que además, se osteointegren totalmente con el paso del tiempo o puedan reabsorberse dejando paso al tejido neoformado, e incluso, que puedan liberar sustancias biológicamente activas para contrarrestar diferentes patologías (Jodati, Yilmaz & Evis, 2020, Kumar, et al, 2020, Morejón, et al, 2019 y Pupilli, et al, 2022). El desafío es extremadamente grande, imitar a la naturaleza con su gran diversidad de variables biológicas hace que se investigue hoy en implantes personalizados con gran multiplicidad de propuestas.
La hidroxiapatita sintética estequiométrica, de fórmula: [Ca10(PO4)6(OH)2] (HA), al ser análoga al componente inorgánico fundamental de huesos y dientes de los vertebrados constituye, desde hace ya medio siglo, uno de los biomateriales de elección para la fabricación de implantes óseos. Su alta biocompatibilidad con el tejido vivo (Dorozhkin, 2008), su capacidad para enlazarse directamente al hueso circundante sin una interfaz (bioactividad) (Dorozhkin, 2013) y sus propiedades de osteoconducción (LeGeros, 2002) y osteoinduccción (LeGeros, 2008) han sustentado los excelentes resultados en aplicaciones en Estomatología, Ortopedia, Neurocirugía o Cirugía Máxilofacial. (Dorozhkin, 2018, Du, Chen, Liu, Xing & Song, 2021)
No obstante, existen diferencias entre la hidroxiapatita sintética pura y la apatita biológica, pues esta última, posee dimensiones nanométricas y muy baja cristalinidad aspectos que le confieren una mayor solubilidad que permite al hueso, como importante reservorio de iones Ca2+ y PO4 3-, mantener la homeostasis de estos elementos en el medio biológico. Además, la apatita biológica no es estequiométrica como la sintética, la cual posee una relación molar Ca/P exacta de 10/6=1,67, ya que su estructura cristalina puede acomodar otros iones. Entre los iones que se acomodan de forma natural en la apatita biológica destacan: en sustitución del Ca2+, cationes monovalentes como Na+ y K+ o divalentes como Sr2+, Mg2+ y Ba2+; en sustitución de los grupos PO4 3-, aniones como CO3 2- y en sustitución de los grupos OH- aniones como CO3 2-, Cl- ó F-. (Elliot, 2013 y Liu, Huang, Matinlinna, Chen & Pan, 2013)
Una vía abordada en la actualidad para reproducir sintéticamente a la hidroxiapatita natural con sus cualidades de ser nanométrica, de baja cristalinidad y con iones y/o vacancias estructurales es la utilización de iones de dopaje incorporados a exprofeso a la estructura de la HA. (Pu'ad, Koshy, Abdullah, Idris, & Lee, 2019) Pero a la vez, el dopaje constituye un camino para la incorporación de especies químicas en este biomaterial capaces de estimular procesos de osteosíntesis, de angiogénesis, de reducir la actividad osteoclástica o lograr actividad antibacteriana, antifúngica o antitumoral, entre otras muchas variantes. (Šupová, 2015) No solo se ha explorado la inclusión de un único dopante sino que se investiga la inclusión de multicomponentes en la búsqueda de sinergia en las propiedades finales del dispositivo médico. (Gaddam, et al, 2022 y Vukomanovic, et al, 2022)
El estroncio, como ion divalente puede sustituir al ion calcio y acomodarse en su estructura, de ahí que la hidroxiapatita natural puede incorporarlo directamente a partir de la ingesta de alimentos, suplementos o medicamentos ricos en Sr2+ con efectos positivos demostrados en el tratamiento de Osteoporosis, Osteoartritis u Osteopenia (Baier, et al, 2013). Se ha demostrado que, al igual que el Ca2+, el Sr2+ en el metabolismo óseo media funciones celulares clave en células de osteoblastos y osteoclastos, entre ellas: el crecimiento celular, la diferenciación y la apoptosis, y a la vez, estimula la osteosíntesis mientras que simultáneamente inhibe la osteoclastia (Bonnelye, Chabadel, Saltel & Jurdic, 2008), efectos ambos, favorables para la restauración ósea. Por esta razón, ha sido explorada la obtención de HA-Sr a partir de diferentes procedimientos de síntesis y con diferentes contenidos del ion dopante desde concentraciones mínimas hasta un 100% de sustitución del ion Ca2+ . (Edwin & Wilson, 2019 y Frasnelli, et al, 2017) A la fecha existe consenso en que las HA-Sr han demostrado mejores resultados en comparación que sus homólogos sin dopar tanto en ensayos de cultivos celulares in vitro como en estudios de implantación in vivo en diferentes modelos animales en términos de bioactividad, proliferación celular, curación ósea y osteointegración.
Este trabajo investiga la efectividad de la inclusión del ion Sr2+ en la estructura de la HA a través de la técnica de síntesis de precipitación por vía húmeda con auxilio de ultrasonido basado en antecedentes de la efectividad de la síntesis de nanohidroxiapatita pura por esta metodología (Fernandes Cota, et al, 2016 y Lunz, et al, 2015). Se evalúa el efecto del dopaje resultante en las propiedades de la celda cristalina de la hidroxiapatita, así como, su influencia en las características de cerámicas microporosas diseñadas para aplicaciones biomédicas.
MATERIALES Y MÉTODOS
Síntesis y caracterización de hidroxiapatita sin y con dopaje de iones de Sr2+Ec.1 Ec.2 Ec.3 Ec.4
Síntesis de nanopartículas de hidroxiapatita: La síntesis de hidroxiapatita nanométrica sin dopaje (nanoHA) se llevó a cabo a partir de la reacción entre los iones de una disolución de fosfato de sodio dodecahidratado, Na3(PO4).12H2O(ac) (p.a, Merck, Alemania) como fuente precursora de iones fosfato y una disolución de nitrato de calcio, Ca(NO3)(ac) (p.a, Merck, Alemania) como precursora de iones calcio en una relación molar Ca/P de 1,67 a través de siguiente reacción química:
Para ello se adicionó lentamente (0,5mL/min) la disolución de Na3(PO4).12H2O(ac) sobre la disolución de Ca(NO3)2(ac) en recipiente cerrado dentro de baño ultrasónico (Branson 3200, Alemania). Se aplicó por intervalos 10 min de ultrasonido y 10 min de adición sin ultrasonido para evitar el calentamiento de la solución y se repitió el procedimiento hasta acabar la disolución de fosfato. Al finalizar se aplicaron 10 min extras de ultrasonido. Se controló que el pH final de la reacción fuera mayor que 10. Se dejó envejecer la disolución por 72 horas, se separó la solución sobrenadante por decantación y se realizaron tres lavados con agua bidestilada nueva, aplicando en cada etapa de lavado 10 min de ultrasonido, reposo por 24h y decantación de las aguas madres. Se secó el sólido blanco obtenido en estufa (Venticell. España) a temperatura de 80°C.
Síntesis de nanopartículas de hidroxiapatita dopadas con iones Sr 2+ : La síntesis de hidroxiapatita nanométrica sustituida con iones estroncio (Sr2+) se llevó a cabo por un procedimiento similar al de síntesis de la hidroxiapatita sin dopaje. Para ello se preparó una disolución de Na3(PO4).12H2O(ac) (p.a, Merck, Alemania) y otras dos soluciones cada una con una mezcla Ca(NO3)2/Sr(NO3)2 (reactivos p.a, Merck, Alemania) con una concentración de un 10 % molar de iones Sr2+ denominada: nanoHA-10Sr, o con un 20 % molar de iones de dopaje: nanoHA-20Sr. Estas disoluciones se hicieron reaccionar con la solución precursora de iones fosfato en una relación molar (Ca+Sr)/P de 1,67 empleando flujo de goteo de 0,5mL/min e intervalos de 10min de ultrasonido/descanso. Se supervisó que el pH final fuera mayor que 10. Se dejaron en reposo las suspensiones por 72h, se separaron las aguas madres por decantación, se repitió por tres veces el proceso de lavado con agua bidestilada, reposo 24h y decantación de aguas madres. Se secó el sólido blanco obtenido en estufa (Venticell. España) a temperatura de 80°C. Las ecuaciones de ambas reacciones químicas se detallan a continuación:
Síntesis nanoHA-10Sr:
Síntesis nanoHA-20Sr:
Espectroscopia Infrarroja a Transformada de Fourier con Reflectancia Total Atenuada (FTIR-ATR): Una muestra de los polvos de cada reacción fue caracterizada directamente sin preparación previa mediante FTIR-ATR empleando un equipo Nicolet( (iS50-ATR, EEUU). Los registros se llevaron a cabo en el rango de 4000 a 400 cm-1.
Difracción de Rayos-X (DRX): A las muestras sintetizadas se les obtuvo su patrón de difracción de rayos-X en un difractómetro PANalytical® (Empyrean Nano, Reino Unido) utilizando para el procesamiento de la data el software X´Pert High Score® v2.01. Se utilizó como radiación de referencia Cu (K(1), ( = 1,5406 Å operando a 30 mA y 40 kV. La data fue colectada en un rango de 2θ de 10-60° con paso de 0,02626° y un tiempo de acumulación de 20 s. Para la determinación del tamaño de cristalito  , se utilizó la ecuación de Debye-Scherrer tomando como referencia la reflexión (0 0 2) ubicada en 25,913° (2θ):
, se utilizó la ecuación de Debye-Scherrer tomando como referencia la reflexión (0 0 2) ubicada en 25,913° (2θ):
dónde:
es el tamaño de cristalito en nm, |
|
es la longitud de onda del haz de Rayos-X monocromático, |
|
es la anchura a la altura media del pico de difracción bajo estudio, |
|
es el ángulo de difracción |
|
es la constante con valor de 0,9 |
Además se calcularon: el porciento o Fracción de cristalinidad (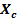 ) (r28), los Parámetros de red a=b y c (Badran, Yahia, Hamdy & Awwad, 2017) y el Volumen de la celda unidad (V) a través de las siguientes ecuaciones:
) (r28), los Parámetros de red a=b y c (Badran, Yahia, Hamdy & Awwad, 2017) y el Volumen de la celda unidad (V) a través de las siguientes ecuaciones:
Parámetros de red a=b y c:
donde:
d: |
es la distancia entre dos planos adyacentes |
h k l |
son los índices de Miller correspondiente a los planos cristalográficos |
Volumen de la celda unidad (V):
Espectroscopia fotoelectrónica de Rayos-X (XPS): Los polvos obtenidos fueron caracterizados utilizando un equipo de XPS (Sepcs, Alemania) con detector Phoibos 150 y fuente monocromada de Al empleando una energía de excitación de 1486,71 eV y una energía cinética de 136,71 eV. El espectro fue procesado con el software Casa XPS® v2.3.19PR1.0. Se llevó a cabo el análisis en el rango de 0-1400 eV de energía de enlace.
Distribución del tamaño de partícula: Por el método de Dispersión Dinámica de Luz (DLS) se analizó la distribución de tamaño de partículas con analizador Zetasizer nano-ZS90 (Malvern, Estados Unidos). Para ello las muestras fueron dispersadas en agua y ultrasonicadas (Fisherbrand FB11201, Reino Unido) durante 1 minuto empleando como dispersante trifosfato de sodio pentabásico (pureza (98%, Aldrich-Sigma, EEUU).
Preparación y caracterización de biomateriales cerámicos porososEc.5
Preparación de biomateriales cerámicos porosos: Se prepararon discos a partir de los polvos de nanoHA sintetizados y posteriormente fueron sinterizados de acuerdo con estudio previo (Morejón, et al, 2021). Seis réplicas de cada muestra de aproximadamente 250 mg se prensaron en troquel cilíndrico de acero inoxidable con 8 mm de diámetro y bajo una presión uniaxial de 200 MPa por 1 minuto con prensa hidráulica (Specac Ltd, Reino Unido). Las muestras fueron sinterizadas a 900°C durante 6 horas en un horno mufla Termiber. España, utilizando una rampa de calentamiento de 2°C/min hasta la temperatura de sinterización.
Caracterización de los biomateriales cerámicos porosos: Se calculó el área de las muestras antes y después del proceso de sinterización empleando imágenes tomadas con un Microscopio Óptico Digital de Alta Definición (Uteruik, Estados Unidos). Se procesaron las microfotografías con el software ImageJ® v.1,39 y con las datas de áreas se calculó el porciento de Contracción (%C). Además, se determinó la Densidad Aparente (ρ) por el método geométrico a través de la expresión: 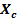 , donde la masa (m) de las muestras se determinó con balanza analítica (Sartorius BL60(S), Alemania), el área (A) a través de procesamiento digital de imágenes y la altura (h) fue medida con pie de rey.
, donde la masa (m) de las muestras se determinó con balanza analítica (Sartorius BL60(S), Alemania), el área (A) a través de procesamiento digital de imágenes y la altura (h) fue medida con pie de rey.
Se estimó también el porciento de Porosidad Total (%P) de las muestras mediante la expresión:
considerando que la densidad teórica de la hidroxiapatita es  = 3,16 g/cm3.
= 3,16 g/cm3.
Por medio de la Microscopía Electrónica de Barrido (SEM) (JEOL JSM 5410, Tokyo, Japan) se tomaron micrografías a 10 kV de la superficie de los discos previamente metalizados con pulverizador de oro (Agar Scientific AGB7340, Reino Unido). Las imágenes fueron procesadas con el software ImageJ® (v.1,39) para medir las dimensiones de los granos y también las dimensiones de los poros. Para todas estas determinaciones se tomaron más de 400 medidas por muestra.
Se realizó análisis estadístico, con el auxilio del programa Statgraphics (Centurion XVI.I), para comparar las medias de Contracción (%), Densidad Aparente, Porosidad Total (%), Tamaños de Granos y
Tamaño de los Poros
Evaluación de la bioactividad: Se preparó una disolución de Fluido Fisiológico Simulado (SBF) tomando como referencia el protocolo para su preparación reportado por Kokubo. (Kokubo & Takadama, 2006) Para ello se utilizó agua desionizada y se añadieron los reactivos grado analítico (Merck, Alemania): NaCl, KCl, K2HPO4. 3H2O, MgCl2. 6H2O, 1M-HCl, CaCl2, Na2SO4, NaHCO3 (ApliChem, Alemania) y NH2C(CH2OH)3 (Spectris, Reino Unido) en el orden y cantidad que se indican en el procedimiento, manteniendo constante la temperatura (36,5 °C) la agitación según lo indicado y con el ajuste de pH sugerido (7,26).
Réplicas de los discos de las tres muestras: nanoHA, nanoHA-10Sr y nanoHA-20Sr fueron colocadas en recipientes plásticos con 3 ml de SBF filtrado con filtro estéril de teflón de 0,22 µm acoplado a jeringa estéril. Las muestras se mantuvieron en contacto con el SBF a 37°C por dos periodos de ensayo: 7 y 21 días. Una vez concluido el tiempo de ensayo las muestras fueron enjuagadas con agua bidestilada y alcohol y se dejaron secar a temperatura ambiente en desecadora hasta su visualización por Microscopía Electrónica de Barrido (SEM) (JEOL JSM 5410, Tokyo, Japan).
RESULTADOS Y DISCUSIÓN
En el presente trabajo, se evaluó la efectividad de la metodología de síntesis por vía húmeda acoplada a ultrasonido como técnica para la obtención de HA de dimensiones nanométricas dopada con iones Sr2+. A la par, se evaluó la influencia de este ion en las características estructurales de las HA sintetizadas y también su efecto en la estructura de cerámicas porosas fabricadas a partir de las HA-Sr sinterizadas las cuales pudieran ser potencialmente empleadas como sustitutos del tejido óseo.
En particular, para las nanopartículas se determinó la influencia del ion Sr2+ sobre el tamaño de cristalito y de las partículas, la cristalinidad de las muestras y los parámetros de la celda cristalina; en el caso de las cerámicas, se estudió el efecto sobre propiedades como tamaño de los granos cerámicos, dimensiones de poros, porosidad total y bioactividad in vitro en Fluido Fisiológico Simulado.
Caracterización de polvos de hidroxiapatita sin y con dopaje de iones de Sr2+
Como resultado de los procedimientos experimentales llevados a cabo se obtuvo que en todas las síntesis se produjo la formación de un precipitado blanco muy fino que se mantenía en suspensión. El pHfinal de todas las reacciones fue próximo a 11 hecho que propicia la formación de hidroxiapatita y no de otros compuestos fosfatocálcicos. En todas las síntesis se obtuvieron rendimientos elevados.
Los espectros FTIR de las muestras sintetizadas (Figura 1) indicaron la obtención de muestras con baja cristalinidad y las bandas detectadas se corresponden con las vibraciones características de los grupos presentes en la hidroxiapatita [Ca10(PO4)6(OH)2]. Se observó una banda ancha alrededor de 3500 cm-1 que corresponde con agua de humedad adsorbida, no obstante, para todas las muestras la ampliación de esta zona indica una señal aguda correspondiente a la vibración de estrechamiento del grupo OH- en 3566 cm-1, típica de la HA. Se aprecian además las bandas características del grupo PO4
3- a 1104-1006 cm-1 ( ), 962 cm-1 (
), 962 cm-1 ( ), 603-560 cm-1 (
), 603-560 cm-1 ( ), 470-460 cm-1 (
), 470-460 cm-1 (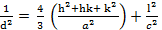 ) y las bandas correspondientes al grupo CO3
2- en 1455, 1416 cm-1 y 871 cm-1 lo que indica una ligera carbonatación de las muestras por las condiciones de obtención. Se ha reportado (refe 3) que la inclusión de Sr2+ a la HA sintetizada por métodos biomiméticos resulta en una desaparición de las bandas FTIR del ion CO3
2-, efecto que también puede ser observado en este trabajo por la disminución de las bandas a 1455, 1416 cm-1 en comparación con las de la nanoHA, Figura 1a).
) y las bandas correspondientes al grupo CO3
2- en 1455, 1416 cm-1 y 871 cm-1 lo que indica una ligera carbonatación de las muestras por las condiciones de obtención. Se ha reportado (refe 3) que la inclusión de Sr2+ a la HA sintetizada por métodos biomiméticos resulta en una desaparición de las bandas FTIR del ion CO3
2-, efecto que también puede ser observado en este trabajo por la disminución de las bandas a 1455, 1416 cm-1 en comparación con las de la nanoHA, Figura 1a).

Fig. 1 Espectros FTIR-ATR de las hidroxiapatitas sintetizadas. a) Espectros de 4000-400cm-1; b) Espectros ampliados en la región de las vibraciones de valencia del grupo PO4 3-
La Figura 1b) muestra de forma ampliada la región del espectro que corresponde con las vibraciones de valencia de los grupos PO4 3- para lo cual se detecta que con el incremento del contenido de Sr2+ se desplazan las bandas de absorción a corrimientos menores de la longitud de onda. Este efecto es indicativo de que ha ocurrido una modificación en el entorno químico local de los grupos fosfatos en las muestras de nanoHA-Sr por la incorporación de los iones estroncio a la estructura. El mayor radio iónico del estroncio en comparación con el del ion calcio puede influir en que aumenten las repulsiones anión-anión y las frecuencias de vibración de los grupos fosfatos se desplacen a menores energías como consecuencia de que disminuye la fortaleza del enlace P-O.
Estos cambios en las posiciones FTIR de las señales asociadas a los modos de vibración del grupo PO4 3- por la presencia de Sr2+ hacia menores valores de números de onda en comparación con la HA sin dopantes, han sido reportados también por otros autores. La Tabla 1 compara los valores obtenidos para nuestras muestras con otros reportes de la literatura.
Como se aprecia, las frecuencias de vibración que se detectan en este trabajo por FTIR para las HA-Sr son similares a los de otros estudios, aun cuando no se emplearan las mismas técnicas de síntesis. Estos resultados son indicativos, al menos de forma cualitativa, de la obtención de hidroxiapatitas sustituidas con estroncio. Se distingue también de los reportes que la aplicación excesiva de ultrasonido puede contrarrestar el efecto del corrimiento de las señales cuando se utilizan bajos contenidos de Sr2+.
La Figura 2 muestra los patrones de difracción de las muestras sintetizadas. Se detecta coincidencia cercana con las reflexiones del patrón reportado para la hidroxiapatita pura (JCPDS n° 00-09-432) con un ensanchamiento de las señales lo que indica la obtención de muestras con baja cristalinidad directamente luego de la síntesis.
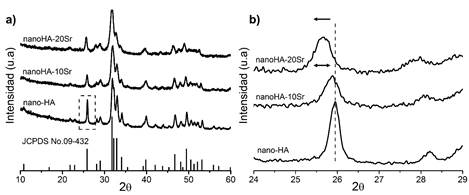
Fig. 2 a) Difractogramas de los polvos sintetizados: nanoHA, nanoHA-10Sr, nanoHA-20Sr y el patrón de la HA pura (JCPDS n° 09-432); b) Región ampliada de la reflexión (0 0 2) ubicada a 25,913° (2θ)
Un análisis más detallado de la data DRX a través del software X´Pert High Score® v2.01 indicó la presencia del ion estroncio en la estructura de las sustancias dopadas por una mayor coincidencia con las fichas JCPDS n° 00-034-0484 correspondiente a Ca9Sr(PO4)6(OH)2 y ficha JCPDS n° 00-034-0483 asociada a Ca8Sr2(PO4)6(OH)2 para las muestras nanoHA-10Sr y nanoHA-20Sr respectivamente, lo que refleja la efectividad del procedimiento empleado en este trabajo para la síntesis de las HA sustituidas.
En la literatura Aina, (Aina, et al, 2013) reportó la síntesis de HA y HA sustituida con estroncio (20 y 40%) por el método de estado sólido, y comprobaron que existía correspondencia entre los patrones de difracción obtenidos de cada una de las muestras con los reportados en la base de datos ICDD; para la HA (JCPDS n° 09-432), la HA-20Sr (JCPDS n° 34-0483), y para la HA-40Sr (JCPDS n° 34-0480). Sin embargo, reportaron que para un 20% de sustitución de la HA con estroncio la fase mayoritaria presente correspondía a la apatita, pero que a un 40% del dopaje, existía la presencia de otra fase fosfatocálcica: el β-fosfato tricálcico (β-TCP), además de la fase de hidroxiapatita.
Este efecto también ha sido reportado por otros autores (Abert, Bergmann & Fischer, 2014), los que evaluaron la incorporación de Sr2+ en un 0, 5, 10, 15, 18, 26 y 34% detectando que a bajos porcientos de sustitución se obtenía apatita como fase mayoritaria pero que a altas concentraciones de iones estroncio (18, 26 y 34%), ocurría una desestabilización de la estructura de la HA y se favorecía la formación de β-TCP como fase secundaria. No obstante, Kaygili sintetizó HA-Sr utilizando solo pocas cantidades de sustituyente (0; 0,45; 0,90; 1,35 y 2,25%) mediante el método de Sol-Gel y detectó en todos los difractogramas la presencia combinada de hidroxiapatita y β-fosfato tricálcico (contenido de β-TCP entre 1,35 y 4,65%), lo que sugiere que no sólo influye la concentración del sustituyente en la pureza de la fase final, sino también la metodología y las condiciones de síntesis. ( refe 19) En nuestro trabajo no hubo indicio de formación de otras fases fosfatocálcicas.
La Figura 2b) muestra de forma ampliada la reflexión (0 0 2) ubicada a 25,913° (2θ) en la que se observa claramente que con la incorporación del ion dopante se produce un desplazamiento de las señales a menores valores de 2 y un ensanchamiento de las reflexiones indicio de una menor cristalinidad en las muestras con sustituyente.
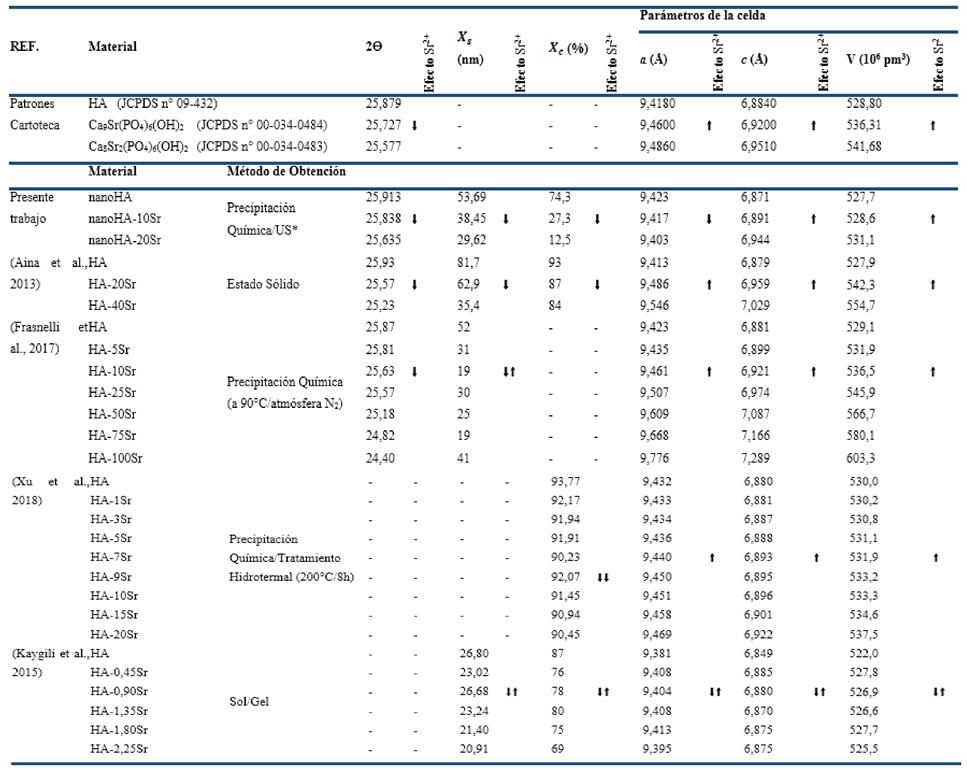
La Tabla 2 resume los valores calculados de Tamaño de cristalito ( ), Fracción de cristalinidad (
), Fracción de cristalinidad ( ), Parámetros de la red y Volumen de la celda unidad de los polvos sintetizados de conjunto con los valores de muestras patrones de la cartoteca y reportes de la literatura. Para todas las muestras experimentales de este trabajo se detecta que las dimensiones son nanométricas (
), Parámetros de la red y Volumen de la celda unidad de los polvos sintetizados de conjunto con los valores de muestras patrones de la cartoteca y reportes de la literatura. Para todas las muestras experimentales de este trabajo se detecta que las dimensiones son nanométricas (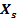 ( 54nm), además, se evidencia que con el incremento del contenido de Sr2+ en las muestras sintetizadas las posiciones de las reflexiones aparecen a menores valores como ocurre en los patrones de difracción para HA sustituidas de la cartoteca (Tabla 2) y en correspondencia con los hallazgos unánimes de otros autores (Ehret, et al, 2017 y Frasnelli, et al, 2017) hecho que evidencia la incorporación del Sr2+ a la estructura de la HA en las condiciones de síntesis empleadas. (El-Gohany, et al, 2012)
( 54nm), además, se evidencia que con el incremento del contenido de Sr2+ en las muestras sintetizadas las posiciones de las reflexiones aparecen a menores valores como ocurre en los patrones de difracción para HA sustituidas de la cartoteca (Tabla 2) y en correspondencia con los hallazgos unánimes de otros autores (Ehret, et al, 2017 y Frasnelli, et al, 2017) hecho que evidencia la incorporación del Sr2+ a la estructura de la HA en las condiciones de síntesis empleadas. (El-Gohany, et al, 2012)
Asimismo, se observa que la presencia del Sr2+ afecta sensiblemente las propiedades estructurales de la nanoHA ya que disminuye tanto el Tamaño de cristalito (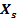 ) (desde ~50nm a ~30nm) como la Fracción de cristalinidad (
) (desde ~50nm a ~30nm) como la Fracción de cristalinidad ( ) casi en un 80% (desde 74,3% a 12,5%). Además, se detectó que la incorporación del Sr2+ al cristal de la HA modifica los parámetros estructurales de la red, disminuyendo las dimensiones de a mientras que se aprecia un aumento preferencial en el parámetro de la red c, lo que produce un incremento global del Volumen de la celda unidad desde 527,7 a 531,1 (106 pm3).
) casi en un 80% (desde 74,3% a 12,5%). Además, se detectó que la incorporación del Sr2+ al cristal de la HA modifica los parámetros estructurales de la red, disminuyendo las dimensiones de a mientras que se aprecia un aumento preferencial en el parámetro de la red c, lo que produce un incremento global del Volumen de la celda unidad desde 527,7 a 531,1 (106 pm3).
Tabla 2 Valores de Tamaño de cristalito ( ), Fracción de cristalinidad (
), Fracción de cristalinidad ( ), Parámetros de la red y Volumen de la celda unidad de los polvos obtenidos.
), Parámetros de la red y Volumen de la celda unidad de los polvos obtenidos.
El incremento del Volumen de la celda unidad está en correspondencia con el mayor radio iónico del Sr2+ (1,13 Å) en comparación con el del Ca2+ (0,99 Å). Todas esas variaciones de parámetros sin dudas podrían tener influencia en el proceso posterior de sinterización para el conformado de piezas cerámicas con vistas a ser usadas como biomateriales implantables en el tejido óseo. Influencia que podría ser en principio a consecuencia de: la disminución de la cristalinidad, las menores dimensiones de los cristales por la presencia del sustituyente (ya de por sí nanométricas) y por ende de la mayor área superficial de esas partículas, así como por la presencia del ion Sr2+ en la red cristalina.
El análisis de la Tabla 2 nos indica que la incorporación del Sr2+ incide generalmente en una disminución del Tamaño de cristalito ( ) y de la Fracción de cristalinidad (
) y de la Fracción de cristalinidad ( ). El empleo de ultrasonido durante la síntesis en este trabajo puede ser la causa de la disminución tan abrupta de la Fracción de cristalinidad (
). El empleo de ultrasonido durante la síntesis en este trabajo puede ser la causa de la disminución tan abrupta de la Fracción de cristalinidad ( ) (disminución de ~80%) dado que otras metodologías no conducen a resultados tan marcados. Así, el dopaje de la HA con este elemento y el empleo de ultrasonido en la síntesis producen un efecto sinergia que conduce a partículas de dimensiones nanométricas menores y de muy baja cristalinidad. Este efecto puede ser aprovechado para la síntesis de HA-Sr que serán usadas directamente como carga inorgánica en la preparación de composites poliméricos o también de cementos fosfatocálcicos para aplicaciones médicas, dado que sus dimensiones nano y su baja cristalinidad pueden favorecer un rápido intercambio con el entorno fisiológico para acelerar procesos biológicos.
) (disminución de ~80%) dado que otras metodologías no conducen a resultados tan marcados. Así, el dopaje de la HA con este elemento y el empleo de ultrasonido en la síntesis producen un efecto sinergia que conduce a partículas de dimensiones nanométricas menores y de muy baja cristalinidad. Este efecto puede ser aprovechado para la síntesis de HA-Sr que serán usadas directamente como carga inorgánica en la preparación de composites poliméricos o también de cementos fosfatocálcicos para aplicaciones médicas, dado que sus dimensiones nano y su baja cristalinidad pueden favorecer un rápido intercambio con el entorno fisiológico para acelerar procesos biológicos.
En cuanto a los parámetros de la red se reporta en la literatura generalmente que los ejes a y c de la celda incrementan ambos sus dimensiones con la incorporación del sustituyente de mayor radio atómico y provocan una distorsión de la celda cristalina que conlleva a un incremento final del Volumen de la celda unidad. Se discute que el ion Sr2+ al ser un ion divalente (al igual que el ion Ca2+), al introducirse en la red cristalina de la HA puede ocupar las posiciones características de los iones Ca (I) y Ca(II) o puede producirse una sustitución mixta, (Kumar, Jagannatham, Venkateswarlu, Dumpala & Sunil, 2021) pero hoy día aún existe controversia sobre qué incide en que se ocupe preferencialmente una u otra posición y sea en una u otra posición así será la variación de los parámetros de la red.
No obstante, en este debate también es de destacar que el uso del ultrasonido juega un papel fundamental en las dimensiones de la celda unidad. En el estudio de Edwin de síntesis de HA-Sr por precipitación vía húmeda, ultrasonido y calcinación de las muestras a 600 °C/2 h evaluaron tanto el dopaje con Sr2+ como el efecto de la aplicación de ultrasonido por diferentes periodos de tiempo. Para este estudio se obtuvo que en dependencia del tiempo de ultrasonido los parámetros de la red a y c pueden aumentar o decrecer, por ejemplo comparando los parámetros de la red con los de la apatita obtenida en la condición previa : HA pura 0min US (a= 9,389 y c=6,838); 5min US (a=9,369( y c=6,805(); 10min US (a=9,382( y c=6,815(); 20 min US (a=9,345( y c=6,817(); 60min US (a=9,355( y c=6,826() mientras que para HA-20Sr 0min US (a= 9,447 y c=6,927); 5min US (a=9,416( y c=6,848(); 10min US (a=9,453( y c=6,866(); 20 min US (a=9,416( y c=6,841(); 60min US (a=9,442( y c=6,679().
Las variaciones detectadas en este trabajo en las propiedades de Tamaño de cristalito ( ), Fracción de cristalinidad (
), Fracción de cristalinidad (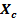 ), Parámetros de la red y Volumen de la celda unidad en comparación con los valores obtenidos para la HA sin dopaje constituyen una clara evidencia de la efectividad de la incorporación del Sr2+ en la estructura por la metodología empleada.
), Parámetros de la red y Volumen de la celda unidad en comparación con los valores obtenidos para la HA sin dopaje constituyen una clara evidencia de la efectividad de la incorporación del Sr2+ en la estructura por la metodología empleada.
Por su parte, la Figura 3 muestra los espectros de la caracterización a través de la Espectroscopia Fotoelectrónica de Rayos-X (XPS) en donde se detectan los elementos atómicos de la HA, acordes con las energías de enlace características de los orbitales: Ca (2s, 2p, 3s y 3p), O (1s) y P (2s y 2p). Mientras que para las HA sustituidas (Figura 3b y Figura 3c) aparecen además las señales correspondientes al Sr (3p) lo que confirma también la inclusión del ion en la red y no una simple adsorción del elemento.

Fig. 3 a) Espectros XPS de los polvos sintetizados: nanoHA, nanoHA-10Sr, nanoHA-20Sr; b) y c) Ampliación de la zona del espectro de las muestras sustituidas para la apreciación de las señales del Sr.
La Tabla 3, detalla las energías de enlace características de cada elemento químico presente en las hidroxiapatitas sintetizadas. Reportes de la literatura para la HA-Sr incluyen señales XPS: Ca2p3/2 (347,5 eV), O1s (531,5 eV), P2p3/2/Sr3d5/2 (133,5 eV), Sr3p3/2 (269,5 eV), además de la señal de C1s (285,0 eV). La señal ubicada a 133,5 eV se corresponde a la unión de Sr3d y P2p porque Sr3d5/2 (133 ± 0,5 eV), Sr 3d3/2 (135 ± 0,5 eV) y las líneas de P2p (132-133 eV) están ubicadas muy cerca una de otra. (Robinson, Salma-Ancane, Stipniece, Meenan & Boyd, 2017)
Tabla 3 Energías de enlace (eV) detectadas por XPS de las muestras nanoHA, nanoHA-10Sr y nanoHA-20Sr.

Con relación al análisis de las partículas por Dispersión Dinámica de la Luz (DLS) se determinó la distribución de tamaños hidrodinámicos de los polvos sintetizados (Figura 4). Los valores detectados se correponden con las dimensiones de los aglomerados más estables de las partículas, dado que éstas se aglutinan en suspensión a consecuencia de su elevada área y carga superficial a pesar de haber empleado polifosfato como dispersante. No obstante, los tamaños promedio de los aglomerados son nanométricos y van desde 150 a 270 nm, aunque no se detecta una tendencia clara con la incorporación del Sr2+ en el valor promedio de tamaños. Sin embargo, sí se detecta que hay influencia en la dispersión de los tamaños de partículas ya que para las dos HA substituidas se obtienen distribuciones de tamaños significativamente más estrechas en relación con la HA sin dopante.
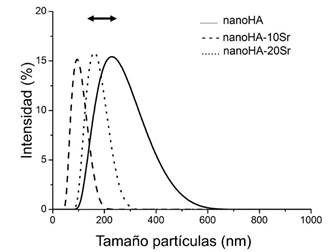
Fig. 4 Distribución del tamaño hidrodinámico de partículas de las HA sintetizadas -HA; - - - HA-10Sr; ····HA-20Sr
En la literatura, Frasnelli reporta que las dimensiones obtenidas por DLS en HA con sustituciones de 0-100% de Sr2+ van desde 98 a 228 nm, mientras que, las determinaciones por SEM de las longitudes de los nanocilindros que obtuvieron, eran entre un 45-55% de tamaño menor, desde 45 a 125 nm. Enrhet a su vez reporta la formación de agregados mucho mayores, sus determinaciones por DLS resultan para HA (3,26 ± 0,62 μm); HA-8Sr (4,15 ± 0,83 μm) y HA-50Sr (4,35 ± 0,85 μm).
Según reporta Edwin el ultrasonido modifica tanto la morfología como el tamaño de las partículas. A partir de los núcleos primarios, el ultrasonido inicialmente favorece el crecimiento de los cristales por el mecanismo de autoensamblaje de nanopartículas adyacentes compartiendo un plano cristalográfico común para disminuir la energía superficial (crecimiento preferencial en el eje c). Esto incrementa sustancialmente la relación de aspecto (se obtienen nanocilindros) pero a mayor tiempo de ultrasonido la cavitación ultrasónica induce la ruptura de las partículas y disminuye la relación de aspecto. Por lo que el tiempo de ultrasonido puede incidir lo mismo en un aumento del tamaño de partículas como en un decrecimiento de las dimensiones. Según sus resultados, la fragmentación en las HA dopadas con Sr2+ es proporcional a la cantidad del dopante en la muestra. Estudios previos también han evidenciado que no sólo influye el tiempo de aplicación de ultrasonido en la morfología y cristalinidad de las partículas, sino también la amplitud de la señal ultrasónica. (Lunz, et al, 2014)
Hasta aquí, puede señalarse que la técnica de síntesis de precipitación por vía húmeda utilizada para la obtención de apatitas sustituidas con Sr2+ fue efectiva para la inclusión del agente dopante en la estructura del cristal; que la presencia del Sr2+ modificó las posiciones de las bandas de vibración FTIR y las posiciones de las señales DRX debido a cambios en el entorno de los elementos y grupos funcionales de la HA. Además, que el Sr2+ disminuyó el tamaño de cristalito y la cristalinidad en las muestras, y por demás, que el empleo de ultrasonido contribuyó a la obtención de HA aún más nanométricas y con muy baja cristalinidad. También, que se incrementó el Volumen de la celda unidad por la presencia del dopante de mayor radio iónico, y que se consiguieron partículas con distribuciones de tamaños más homogéneas.
Caracterización de implantes cerámicos porosos de hidroxiapatita sin y con dopaje de iones de Sr2+
La Figura 5 muestra las imágenes de Microscopia Electrónica de Barrido (SEM) de discos de nanoHA pura y con Sr2+ como sustituyente (10 y 20%). En todos los casos es posible distinguir los granos cerámicos, la formación de cuellos de unión entre éstos y que a la temperatura empleada para la sinterización (900°C) aún no existe una coalescencia total de los granos cerámicos por lo que quedan espacios entre ellos y se obtienen estructuras porosas. Se observa, además, que tanto los granos cerámicos como las cavidades entre ellos (poros) son de dimensiones heterogéneas, que las piezas cerámicas aparentan una estructura más compacta con el incremento del contenido de Sr2+, pero que conservan aún microporosidad que parece estar interconectada.
La Tabla 4 resume los valores calculados para distintas propiedades de las cerámicas obtenidas a partir de las nanoHA, nanoHA-10Sr y nanoHA-20Sr sintetizadas.
Con relación a los Tamaños de Granos resultan nanométricos o submicrométricos, con dimensiones que son más pequeñas que el de las cerámicas convencionales por lo cual las cerámicas obtenidas exponen mayor área de contacto al medio biológico que sus análogas micrométricas. El Tamaño de Grano aumenta con la incorporación del Sr2+ detectándose diferencias estadísticas significativas entre muestras con un nivel del 95,0% de confianza. Las dimensiones de los granos varían desde nanómetros a micras en el siguiente orden: nanoHA (150-1640 nm)(nanoHA-10Sr (250-1720 nm)( nanoHA-20Sr (400-1940 nm). El hecho que se detecten estas diferencias sustanciales sugiere que el Sr2+ posee efecto sobre la temperatura de inicio de la sinterización, la cual debe ser menor a mayor contenido del ion dopante y por ello las piezas cerámicas resultan con mayor coalescencia entre granos a iguales tratamientos térmicos.
Tabla 4 Densidad Aparente, Porosidad Total (%) y Contracción (%) de las cerámicas de nanoHA y nanoHA-Sr (10, 20%) al ser sinterizadas a 900°C.

La Figura 6a) muestra las distribuciones de Tamaños de Grano obtenidas a partir de los histogramas en donde se puede apreciar que se incrementa el tamaño medio con la incorporación del sustituyente, sin embargo, no hay un efecto marcado en la amplitud de las distribuciones.

Fig. 6 a) Distribución del Tamaño de Granos de las cerámicas obtenidas a partir de las HA sintetizadas; b) Distribución del Tamaño de Poros de las cerámicas obtenidas a partir de las HA sintetizadas. -HA; - - - HA-10Sr; ····HA-20Sr
Por su parte, el Tamaño de los Poros disminuye sustancialmente por la presencia del sustituyente con diferencias estadísticas significativas entre muestras con un nivel del 95,0% de confianza. Las muestras cerámicas a partir de nanoHA (Figura 5a) poseen desde cavidades irregulares con pequeños poros entre granos, hasta espacios libres de mayores dimensiones por los que se pueden propagar grietas, lo que sugiere, muestras con bajas propiedades mecánicas. En contraposición las muestras de nanoHA-20Sr poseen cavidades con menor tamaño medio (~600nm) y una distribución de Tamaños de Poros significativamente más estrecha que las de las cerámicas de nanoHA-10Sr y nanoHA (Figura 6b).
Con relación a la Densidad Aparente esta se incrementa al dopar la nanoHA con una mayor cantidad de iones estroncio, ello es debido al mayor peso atómico de este elemento químico en relación con el Ca2+ y también a las diferencias de contracción de las piezas en el proceso de sinterización. No obstante, todos los valores de Densidad Aparente resultan menores que la densidad teórica de la hidroxiapatita (3,16 g/cm3). El análisis estadístico reveló que, debido a la dispersión de valores, no existen diferencias significativas entre las muestras nanoHA y nanoHA-10Sr, pero la muestra nanoHA-20Sr sí posee una Densidad Aparente significativamente mayor.
La Porosidad Total (%) osciló entre un 50-60%, lo que es positivo para lograr una mayor interacción con el tejido huésped y si bien las dimensiones de poros no alcanzan dimensiones macrométricas para la colonización celular, estas cerámicas tendrán una mayor área superficial para la interacción implante-célula, se favorecerá la adsorción de proteínas y la irrigación sanguínea por fuerzas de capilaridad, a la vez que permitirán el paso de fluidos e intercambio de nutrientes/desechos con el medio y podrán tener mejores propiedades para aplicaciones con mayores exigencias mecánicas. No obstante, el análisis estadístico indicó que no existen diferencias estadísticas entre las muestras nanoHA y nanoHA-10Sr, pero la muestra nanoHA-20Sr posee una porosidad significativamente menor.
En cuanto a los cambios dimensionales, las muestras sin dopar presentaron bajos valores de Contracción, apenas 2,5 ± 0,2%. Sin embargo, las muestras con Sr2+ presentaron valores de contracción de ~20%. El análisis estadístico indicó que existen diferencias estadísticas entre todas las parejas de muestras, o sea: nanoHA/nanoHA-10Sr, nanoHA/nanoHA-20Sr y nanoHA-10Sr/nanoHA-20Sr. Este efecto puede deberse a que el ion dopante afecta las propiedades de los polvos de partida: menor Tamaño de cristalito y menor Fracción de cristalinidad, lo que implica que las muestras al estas constituidas por partículas más pequeñas y más amorfas poseen mayor área superficial, y por tanto, puede existir mayor interacción entre las partículas durante el proceso de sinterización lo que da lugar a mayor Contracción/Densificación y por tanto menor Porosidad final, sin descartar que a la vez exista un efecto del ion Sr2+ en la temperatura de inicio de la sinterización.
Finalmente, los estudios llevados a cabo de bioactividad in vitro por inmersión en Fluido Fisiológico Simulado refrendan que cerámicas obtenidas a partir de nanoHA dopada con Sr2+ aceleran los procesos de bioactividad como se observa en la Figura 7b), en donde se aprecia que a 21 días hay diferencias marcadas en comparación con las cerámicas sin dopar, Figura 7a) dado que se detecta la presencia de núcleos de depósitos fosfatocálcicos sobre los granos cerámicos, lo que no ocurre de forma clara aún con las cerámicas sin dopar al mismo periodo de inmersión. Las flechas en la Figura 7a) indican sólo la somera presencia de núcleos amorfos de un depósito superficial en los granos cerámicos.
De acuerdo a reportes de la literatura, (Kaygili, et al, 2015) muestras de HA dopadas con Sr2+ sumergidas en una solución de SBF durante 28 días presentan una mejor relación molar en la capa depositada superficialmente (Ca+Sr)/P (1,53 vs. 1,60) a medida que se incrementa el contenido del sustituyente (de 0,45% a 2,25% de Sr2+). Mahabole, por su parte reportó cambios morfológicos superficiales luego de la inmersión en SBFmodificado de piezas de HA-Sr obtenidas por intercambio iónico a partir de HA pura y posterior tratamiento térmico a 500 °C/2h. (Mahabole, Bahir, Kalyankar & Khairmar, 2012) Específicamente detectaron que a 8 días de incubación en SBFmodificado había nucleación de abundantes partículas diminutas de apatita granular mientras que a los 16 días la superficie se encontraba totalmente cubierta de una capa de agregados de apatita y que generalmente con el tiempo de inmersión mejoraba esa tasa de nucleación de apatita lo que atribuyeron a que la HA-Sr actúa como plantilla para el crecimiento superficial de apatita y evidencia su naturaleza bioactiva.
Los resultados de nuestro trabajo confirman estos estudios previos y que la incorporación de este agente dopante incrementa la bioactividad de las cerámicas.
CONCLUSIONES
En este trabajo se verificó la efectividad de la síntesis por vía húmeda de hidroxiapatitas sustituidas con Sr2+ (10, 20%) y la utilidad de la aplicación de ultrasonido para disminuir aún más el tamaño de cristalito, la cristalinidad y el tamaño de partículas. Los resultados obtenidos con relación a las variaciones de los parámetros de red estuvieron en concordancia con otros reportes previos. La inclusión del estroncio como ion dopante en la hidroxiapatita modifica significativamente propiedades como la contracción y la porosidad total resultante de cerámicas microporosas, así como, el tamaño de granos y el tamaño de poros, lo que tendrá influencia en las propiedades mecánicas y por tanto en las aplicaciones biomédicas finales. Se demostró además que la presencia de estroncio incide en una mayor bioactividad de las cerámicas.