INTRODUCCIÓN
Los hongos poseen una gran diversidad biológica que les permite una amplia distribución en la naturaleza. Sus propágulos son un componente constante del aire como constituyente de los bioaerosoles, con concentraciones y composiciones conocidas que fluctúan de acuerdo a la compleja interacción entre factores biológicos y ambientales tales como: ubicación geográfica, contaminación del aire, condiciones climáticas, actividad humana y fuente local de vegetación (Grinn-Gofron & Bosiacka, 2015). Los más frecuentes en el aire son Cladosporium, Penicillium, Aspergillus y Alternaria, con concentraciones altas independientemente de la latitud y altitud sobre el nivel del mar (Ramos & Meza, 2017). Debido a su versatilidad fisiológica, pueden crecer sobre disímiles sustratos provocando cambios no deseados en sus propiedades (Ljaljević et al., 2013). Ellos juegan el rol más importante en la biodegradación de materiales que conforman las colecciones de interés patrimonial y aunque las bacterias también pueden participar, los hongos requieren menos humedad para desarrollarse en las condiciones ambientales que normalmente existen en locales de oficinas, depósitos de archivos y museos, siendo estos entornos más favorables para el crecimiento de hongos que de bacterias (Mallo et al., 2017). Son capaces de permanecer en el ambiente por largos períodos de tiempo sin originar grandes daños, pero cuando las condiciones ambientales son apropiadas, es decir, la temperatura se encuentra por encima de los 25ºC, la humedad relativa es superior al 65%, la disponibilidad de agua en los materiales es alta (actividad de agua (aw) superior al 70%), la ventilación y la circulación del aire es baja, la bioreceptividad del sustrato así como sus propiedades fisicoquímicas son compatibles con sus demandas nutricionales, pueden ocasionar efectos negativos sobre el material, colonizándolo y acelerando su biodeterioro (Micheluz et al., 2015; Borrego et al. 2018; Mallo et al., 2020). Estos efectos se están incrementando debido a las alteraciones que está provocando el Cambio Climático en el régimen de lluvias, incidiendo en los factores críticos de temperatura y humedad que condicionan la alteración de los materiales por la actividad biológica (Mallo et al., 2020; Awad et al., 2020).
Es sumamente importante tener en cuenta que la manipulación de documentos contaminados y la inhalación de altas concentraciones de propágulos ambientales y de sus fragmentos, pueden constituir un grave riesgo para la salud de los trabajadores, ya que muchos de estos hongos son patógenos/toxigénicos, incluso aunque no estén viables (Simon-Nobbe et al., 2008; Eduard, 2009). Además, estos microorganismos son ampliamente reconocidos como desencadenantes alergénicos implicados en enfermedades respiratorias graves (Denning et al., 2014; Twaroch et al., 2015; Borrego & Molina, 2018).
Los objetivos de esta investigación fueron determinar la diversidad fúngica y calidad del aire ambiental en dos departamentos de la Oficina Cubana de la Propiedad Industrial (OCPI), así como evaluar cualitativamente la capacidad biodeteriogénica de los aislados.
MATERIALES Y MÉTODOS
Locales analizados
Los departamentos de Fondos (DF) y el de Marcas (DM) están situados uno al lado del otro en la planta baja del edificio. El depósito doble que está en el interior del DF es el más grande y está construido en dos niveles en forma de mezzanine (Fig. 1a, 1b). Sus dimensiones son de 17 m de largo x 8 m de ancho x 10 m de altura aproximadamente y el local contiene 3 unidades de sistemas de aire acondicionado. Este local cuenta con un total de 5 ventanas y 3 puertas, las que se mantuvieron abiertas durante todo el tiempo de muestreo por las reparaciones que se estaban realizando dentro de él. Es conveniente destacar que para acceder a este depósito doble de documentos es imprescindible atravesar la oficina que le antecede (Fig.1c).
En el DF se seleccionaron un total de 17 puntos a muestrear (Sanchis, 2002) que se distribuyeron de la siguiente manera: 6 puntos en la parte alta del depósito doble (A1), 6 punto en la parte baja del mismo depósito (A2) (para un total de 12 puntos), 1 punto en el Archivo Central (AC), 2 puntos en el área central de la oficina, y 1 punto en la zona de la oficina que queda debajo del mezzanine para un total de 16 puntos en el interior y 1 punto en el patio exterior (Fig. 1d, 1e).
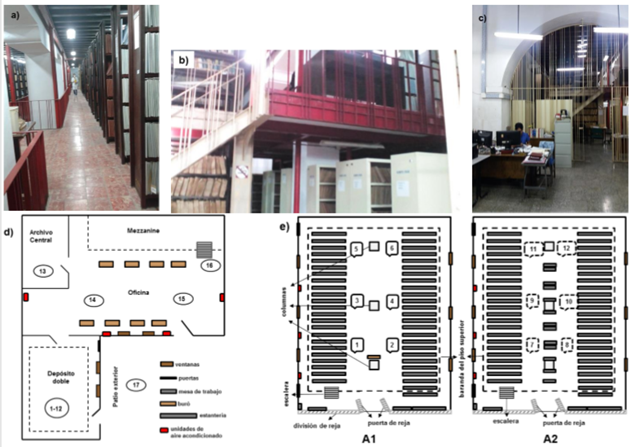
Fig. 1 Departamento de Fondos (DF) de la OCPI. a) Dimensiones del depósito doble principalmente del parte superior visto durante el muestreo microbiológico ambiental. b) Vista lateral de los dos niveles en forma de mezzanine. c) Oficina que antecede al depósito doble y que constituye la entrada al mismo. d) Croquis de la distribución de los espacios y algunos puntos muestreados en el DF. e) Croquis de una vista superior de los dos pisos del depósito doble con los puntos de muestreos (A1: parte de arriba; A2: parte de abajo). Se usaron líneas discontinuas para señalizar los puntos de muestreos en la parte de abajo del depósito doble (A2).
El DM es más pequeño y el depósito de archivo (DA) que está en su interior se ubica en el segundo piso del mezzanine (Fig. 2a, 2b). Las dimensiones de todo el local son de aproximadamente 5 m de largo x 7 m de ancho x 6 m de alto. Este local dispone de otras unidades de aire acondicionado que comparten tanto el área de oficinas como el depósito. En este departamento, se seleccionaron cinco puntos a muestrear distribuidos como sigue: un punto en la oficina de la Jefa, tres puntos en la zona de oficina central (uno delante de la puerta de entrada, uno en el medio del pasillo de las computadoras y otro punto debajo del mezzanine en el centro de la oficina) y otro arriba del mezzanine en el centro, correspondiente al DA (Fig. 2c).
MUESTREO MICROBIOLÓGICO AMBIENTAL
En los locales del DF y en el exterior se realizó la toma de las muestras el día 30 de enero de 2020. Todas las áreas comprendidas dentro de este departamento, incluido el depósito doble no tenían climatización ya que se estaban haciendo trabajos de reparación constructiva dentro de éste. La puerta de entrada del local se mantuvo abierta todo el tiempo. La ventana central del depósito doble que da al patio estuvo abierta todo el tiempo debido a que estaban trabajando en la restauración de ella particularmente. En este depósito también existen dos puertas pequeñas que dan al patio central (Fig. 1e) y que se mantuvieron abiertas todo el tiempo. El muestreo en el DM se realizó el día 31 y nuevamente se muestreó el aire del patio. Este local se mantuvo abierto todo el día sin climatización y además la puerta del centro se abrió cerca de las 10:20 a.m. Durante los dos muestreos el personal se mantuvo en sus puestos de trabajo haciendo sus labores habituales.
En cada punto estudiado, las muestras se tomaron por triplicado, empleando un biocolector portátil tipo SAS (Super 100 TM, Italy) a intervalos de 1 hora entre réplicas y a un volumen de 100 L por 2 minutos. Se emplearon placas de Petri con Agar Extracto de Malta suplementado con NaCl (7.5%) (Borrego et al., 2017) y una vez colectadas las muestras, se incubaron invertidas de 5 a 7 días a 30ºC. Posteriormente, se realizó el conteo de las colonias fúngicas crecidas en el medio de cultivo y se determinaron las unidades formadoras de colonias por m³ de aire (UFC/m³) según las orientaciones del fabricante del equipo (SAS Super 100 ™, 2001).
Para conocer la calidad del aire, se calculó la relación interior/exterior (I/E) de acuerdo a la sugerencia de Stryjakowska-Sekulska et al. (2007) a partir de las UFC/m3 obtenidas en los interiores y en el ambiente exterior. Estos autores indicaron que un valor de esta relación igual o menor que 1.5 es propio de un ambiente no contaminado y con buena ventilación, un valor superior a 1 es indicativo de una calidad ambiental regular y un valor mayor que 2, refleja un ambiente contaminado y con una ventilación pobre.
La densidad relativa (DR) fue calculada según Smith (1980), donde:
DR = (número de colonias de un taxón especifico/ total de colonias de todos los taxones contabilizados) x 100.
El coeficiente de similitud de Sørensen (Sánchez et al., 2019) se utilizó para comparar la composición de taxones obtenidos en los ambientes interiores con el exterior.
Coeficiente de similitud de Sørensen (QS) = 2a / b + c
Donde:
a |
es el número de taxones comunes |
b |
es el número de taxones detectados en el ambiente interior |
c |
es el número de taxones detectados en el ambiente exterior |
Identificación taxonómica
Para la identificación taxonómica hasta género de los hongos aislados se tuvieron en cuenta las características culturales y morfológicas (macro y microscópicas). Se realizaron microcultivos, preparaciones en fresco y semipermanentes con lactofenol, según las técnicas de Casadesús & Rojas (1981), mientras que, para los casos de estructuras hialinas, se utilizó lactofenol-azul algodón, según Johnston & Booth (1983). Las estructuras observadas se compararon con los manuales de Barnett & Hunter (1972) y Domsch et al. (1980).
Análisis termohigrométricos
Las determinaciones de temperatura (T) y humedad relativa (HR) se realizaron con un termohigrómetro digital (Pen TH 8709, China) por triplicado en los mismos puntos de muestreo microbiológico.
Determinación cualitativa de la actividad biodeteriorante
Actividad celulolítica
Para determinar el poder degradativo de la celulosa, las cepas se cultivaron en cuatro tubos con un medio de cultivo salino cuya composición para 1L fue: nitrato de sodio 2g; fosfato de dipotasio 1g; sulfato de magnesio 0,5g; cloruro de potasio 0,5g; sulfato ferroso 0,01g; agar 20g; pH = 5,5. Cada tubo contenía uno de los tres tipos de fuentes de celulosa ensayadas. En el primer caso se usó una tira de papel de filtro (PF) Whatman No.1 (Inglaterra) de 4,8 cm de largo por 1 cm de ancho (equivalente a 50 mg de papel de filtro), mientras en los otros se utilizaron carboximetilcelulosa (CMC) y celulosa cristalina (CC) al 1% respectivamente. Como control se empleó glucosa al 1%. Los cultivos se incubaron durante 21 días a 30ºC (Borrego et al., 2010; Lavín et al., 2014).
Producción de pigmentos
La producción de pigmentos se determinó en la misma tira de papel de filtro, utilizada en la prueba descrita anteriormente (Molina & Borrego, 2014).
Actividad proteolítica
La actividad proteolítica se determinó a través del hidrólisis de gelatina en tubos de cultivo que contenían un medio de cultivo salino de similar composición al antes descrito, pero con gelatina a 120 g/l (Borrego et al. 2017). Los tubos inoculados fueron incubados por 7 días a 30ºC y finalmente incubados durante 1 hora a 4ºC. La reacción de hidrólisis se evidenció por la licuefacción del medio al invertir los tubos.
Actividad amilolítica
La actividad amilolítica fue determinada a través del hidrólisis del almidón en placas, con medio agarizado de composición salina similar a la antes descrita utilizando como fuente de carbono almidón al 1%. Se incubó durante 7 días a 30ºC. Para el revelado de la prueba se vertió sobre cada placa de cultivo 5 ml de solución del reactivo de Lugol. La presencia de una zona incolora alrededor de las colonias se tomó como indicador de hidrólisis positiva (Borrego et al., 2017)
Producción de ácidos orgánicos
Para la determinación de ácidos se realizaron suspensiones de esporas de las cepas aisladas, que posteriormente se sembraron en un caldo de cultivo de composición salina similar al empleado anteriormente con glucosa al 1%, rojo fenol al 0.03% y pH inicial ajustado a 7. Los cultivos se incubaron por 3 días a 30ºC y posteriormente se midió el pH del medio de cultivo con un potenciómetro (Hanna HI 8314, Italia) (Borrego et al., 2017; 2020).
Análisis estadísticos realizados
En el análisis estadístico de los datos se usó el programa Startgraphic Centurion XV. Se empleó la correlación de Pearson para determinar correlaciones entre la T, HR y la concentración fúngica. Para comparar medias se realizó un análisis múltiple mediante el método de mínima diferencia significativa (LSD) para (p ≤ 0.05). Además, se plotearon los valores de la concentración fúngica obtenida en ambos pisos del depósito doble ubicado en el DF en el programa Surfer 8.00 (Golden Software, Inc.) para visualizar su distribución espacial y determinar la existencia de posibles zonas de amplificación fúngica dentro de este depósito.
Resultados y Discusión
Grado de contaminación fúngica
Durante el muestreo microbiológico, se realizaron mediciones de T y HR en los mismos sitios donde se tomaron las muestras. Se comprobó que la T dentro de los departamentos se mantuvo fresca y con valores que oscilaron entre 26(C y 26.9(C con un promedio de la T exterior de 26.7(C mientras que la HR en los locales osciló entre 66.5% y 75% y el valor promedio exterior fue de 71.6% (Tabla 1). En el DF, los valores de HR mayores se detectaron en puntos apartados de la mayor ventilación (5, 6, 11, 12) (Fig. 1b), mientras que las áreas que están ubicadas más próximas a la puerta del departamento como son el AC y la oficina (puntos 13, 14, 15, 16) poseen los valores más bajos. Sin embargo, el depósito doble posee los valores de HR más altos, a pesar de que la ventana central izquierda y las puertas estaban abiertas. El DM también exhibió elevados valores de HR en todos los puntos analizados, debido posiblemente a la influencia de altos valores de HR provenientes del exterior luego de la lluvia caída la noche anterior al muestreo.
Tabla 1 Concentraciones fúngicas, relaciones interiores/exteriores (I/E) y parámetros termohigrométricos obtenidos en los diferentes locales estudiados en la OCPI.
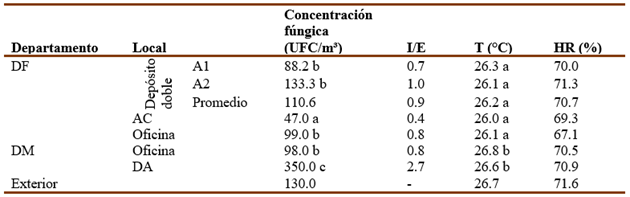
a, b, c: Indican diferencias significativas según el método de LSD (p ≤ 0.05). Letras iguales indican que no hay diferencias significativas.
La concentración promedio obtenida en el depósito doble del DF fue de 110.6 UFC/m3; sin embargo, la concentración obtenida en la parte superior (A1) fue ligeramente menor (88.2 UFC/m3) a la obtenida en la parte inferior (A2, 133.3 UFC/m3), mientras que las concentraciones obtenidas en el AC y la zona de oficina fueron de 47 UFC/m3 y 99 UFC/m3, respectivamente. Por su parte en el DM, las concentraciones determinadas en la zona de oficina y el DA fueron de 98 UFC/m3 y 350 UFC/m3, respectivamente. Al comparar los valores de concentraciones fúngicas obtenidos en los departamentos, se pudo constatar que solo el valor obtenido en el DA resultó significativamente mayor.
En la actualidad no existe consenso internacional para indicar cuando un ambiente está contaminado o no, algunos autores han señalado que para saber si un ambiente tiene buena calidad es importante comparar las concentraciones interiores con respecto a las exteriores a través del índice I/E (Stryjakowska-Sekulska et al., 2007; Cabral, 2010; Salonen et al., 2015; Kadaifciler, 2017; Osman et al., 2017; Awad et al., 2020) y en dependencia del valor que se obtenga se puede estimar la calidad microbiológica ambiental. Las relaciones I/E obtenidas en este estudio mostraron que la mayoría fueron ≤ 1.0, sugiriendo que estos locales tuvieron buena calidad ambiental. Por el contrario, el DA que se encuentra dentro del DM mostró una relación superior a 1, propio de un ambiente de mala calidad. Si el aire interior está influenciado por el aire exterior (Pinzari, 2011, Rahmawati et al., 2018, Borrego & Perdomo, 2016, Kadaifciler, 2017), entonces se debería obtener una concentración menor o igual a la que existe en el exterior. Sin embargo, cuando un aire interior muestra un índice I/E igual o mayor que1 refleja una elevada contaminación, lo que significa que hay una fuente interior que suministra al aire propágulos fúngicos. A pesar de que esta parte del local dentro del departamento no está dividido por ninguna pared (Fig. 2), se estimó que en ese espacio hay muy mala circulación de aire lo que provoca su estancamiento y por consiguiente un aumento de la concentración fúngica en esa área, evidenciando una zona de amplificación de la concentración de propágulos fúngicos.

Fig. 2 Departamento de marcas (DM) de la OCPI. a) Ubicación del depósito de archivo (DA) dentro del DM. b) Vista del DA. c) Puntos de muestreo dentro del DM. Los puntos de muestreo con líneas discontinuas indican que son de la planta baja del local.
Los puntos muestreados en ambos departamentos revelaron en su mayoría concentraciones que oscilaron entre 47 y 350 UFC/m3, indicativo de ambientes no contaminados. Al comparar estos valores con los umbrales reportados por Roussel et al., (2012), se puede apreciar que los puntos muestreados en ambos departamentos revelaron en su mayoría ambientes no contaminados y solamente los puntos 3 (ubicado en A1) y 8 (situado en A2) pertenecientes al DF y el punto 22 correspondiente al DA del DM tuvieron una contaminación moderada, resultado que coincide con los índices I/E calculados (Tabla 1).
En investigaciones previas realizadas solo en depósitos documentales de la OCPI, se obtuvieron concentraciones fúngicas entre 55 y 80 UFC/m³ para ambientes interiores y entre 90 y 150 UFC/m³ para ambientes exteriores, mientras que todas las relaciones I/E calculadas resultaron menores de 1.5 indicando ambientes de buena calidad, y siendo estos valores inferiores a los reportados en el presente estudio (Borrego & Molina, 2020; Borrego et al., 2021), lo que sugiere que las acciones constructivas y el mantenimiento de los espacios que se estaba realizando favorecieron los aumentos de las concentraciones fúngicas. En el reporte de Borrego et al. (2021), no se describe la zona de amplificación de la concentración fúngica antes referida y esto pudo deberse a que en ese momento los sistemas de clima estaban funcionando correctamente y mantenían una buena circulación del aire en todo el departamento.
Al correlacionar la T, la HR y las concentraciones fúngicas se obtuvo una correlación media negativa (48%) entre la T y la HR (r = -0.4788, p = 0.0004), indicativo de que cuando aumenta T disminuye HR. No obstante, entre estos parámetros termohigrométricos y la concentración fúngica no se evidenció ninguna correlación, resultado que no coincide con el obtenido previamente por Borrego et al. (2021). Pero, al plotear los valores de estos tres parámetros en un gráfico radial (Fig. 3) se observó que tanto la T como la HR tuvieron gran estabilidad en todos los locales estudiados a pesar de estar abiertos y con ventilación natural; pero las concentraciones fúngicas obtenidas en cada punto de muestreo revelaron un incremento marcado en el punto 3 (233 UFC/m3) ubicado en la parte izquierda y media del piso superior del depósito doble del DF (A1). Situación similar ocurrió con el punto 8 (210 UFC/m3) ubicado en la parte derecha y delantera de la planta baja del mencionado depósito (A2). Esto podría ser indicativo de que en estas localizaciones pudieran existir otras zonas de amplificación de la concentración fúngica debido posiblemente a una acumulación de propágulos fúngicos en esos puntos por la entrada de bioaerosoles a través de la ventana y puertas abiertas y al incorrecto movimiento del aire dentro del depósito que provoca su estancamiento en esas áreas. Asimismo, se destaca la concentración fúngica obtenida en el punto 22 (350 UFC/m3) del DA dentro del DM, aspecto que corrobora lo antes planteado de la existencia de una zona de amplificación de la concentración fúngica.
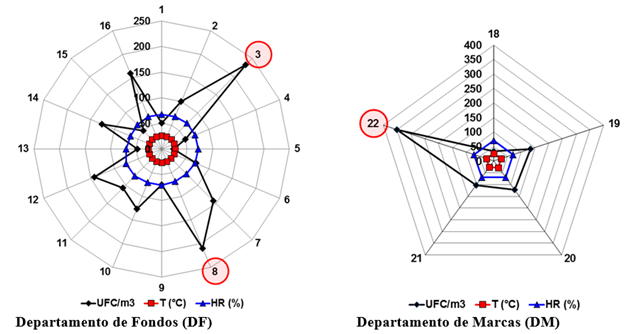
Fig. 3 Comportamiento de la T, la HR y la concentración fúngica en los puntos muestreados en los departamentos de la OCPI estudiados. Note el aumento considerable de la concentración fúngica en los puntos 3, 8 y 22, todos pertenecientes a los depósitos de archivos.
Al analizar la distribución espacial de las concentraciones fúngicas de ambos pisos del depósito doble ubicado en el DF con el programa Surfer 8.0 (Fig. 4), se puede apreciar que a la entrada de ambos pisos existen concentraciones altas y esto pudiera deberse a que como no existe una correcta circulación del aire en esa zona está comenzando a parecer una zona de amplificación de la concentración fúngica. En el caso de A1 además, se observan altas concentraciones en la zona entre los puntos 1 (50 UFC/m3), 2 (100 UFC/m3), 3 (233 UFC/m3) y 4 (50 UFC/m3) y esto posiblemente se debió a que como la ventana que está ubicada en la pared izquierda en la parte baja del mezzanine estaba abierta, provocó un movimiento ascendente del aire dentro del depósito y con ello el arrastre de los propágulos fúngicos hacia esa área en la parte superior del mezzanine, mientras que para la zona del punto 5 (23 UFC/m3) la carga fúngica fue más baja debido posiblemente a la influencia de la puerta abierta que existe en ese sitio que probablemente contribuyó a la salida del aire y de estos propágulos. En A2, el área donde se encuentran los puntos 9 (70 UCF/m3) y 10 (127 UFC/m3) (zona media), la concentración fúngica resultó ser más baja que la existente no solo a la entrada del depósito (7: 143 UCF/m3 y 8: 210 UCF/m3) sino también en la zona posterior del mismo (puntos 11: 107 UCF/m3 y 12: 143 UCF/m3), donde se evidencia estancamiento de la carga fúngica a pesar de las puertas y ventanas ubicadas en esa zona (Fig. 4). En este piso del mezzanine, contrario a lo que ocurrió arriba (A1), posiblemente existió una mayor circulación del aire en esa zona media lo que pudo contribuir a disminuir la concentración de los propágulos aerotransportados. Por las dimensiones y la ubicación de la ventana en el depósito es posible que la circulación de aire proyecte una parte del flujo hacia arriba lo que afecta la parte superior del mezzanine, en cambio las puertas ubicadas en la parte delantera y en la parte posterior al ser pequeñas probablemente no logran mover el aire suficientemente en esas áreas del depósito. En resumen, con este análisis se sugieren las zonas de “amplificación fúngica” que han sido informadas anteriormente por Pinzari (2011) y que pueden existir en depósitos de documentos que no están bien ventilados. Estas zonas pueden resultar preocupantes ya que es donde existen condiciones para que los hongos aerotransportados puedan sedimentar sobre las superficies, incluidos los documentos, y comenzar a crecer y a colonizar los materiales, resultando dañinos principalmente para los documentos y posteriormente para la salud del personal.
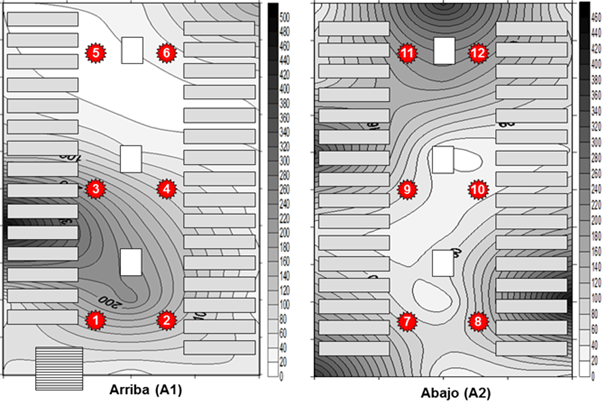
Fig. 4 Distribución espacial de la concentración fúngica obtenida en los pisos A1 y A2 del depósito documental doble ubicado en el departamento de Fondos (DF) de la OCPI.
Géneros fúngicos identificados y su distribución
En cuanto a los taxones detectados se evidenció un predominio de anamorfos del phylum Ascomycota (Fig. 5), cuestión que había sido previamente reportado (Osman et al. 2017; Mallo et al., 2020; Pyrri et al., 2020; Savković et al., 2021). Este predominio puede deberse a que en la región del Caribe representantes de ese phylum han sido detectados en altas concentraciones en el aire exterior (Fröhlich-Nowoisky et al., 2016) y particularmente en Cuba (Almaguer & Rojas, 2013). Se identificaron 10 taxones en los ambientes analizados con predominio de los géneros Aspergillus, Cladosporium, Penicillium y un micelio no esporulado (MNE), resultado que concuerda con otros obtenidos previamente en archivos cubanos incluida la OCPI (Rodríguez et al., 2014; Anaya et al., 2016; Borrego & Perdomo, 2016; Borrego et al., 2017; 2020; Borrego & Molina, 2020; Borrego et al., 2021). Además, estos taxones también han sido detectados con prevalencia en ambientes interiores de bibliotecas, museos y archivos polacos (Gutarowska et al., 2012), de dos bibliotecas egipcias (Osman et al. 2017), del Archivo Nacional de Chile (Zúñiga et al., 2017), de una biblioteca indonesa (Rahmawati et al., 2018), de la Biblioteca Nacional de Grecia (Pyrri et al. 2020) y de tres bibliotecas brasileñas (Silva et al., 2021).
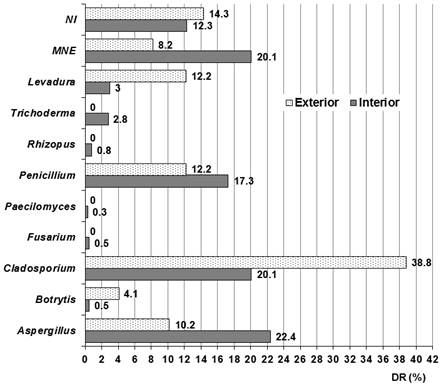
Fig. 5 Taxones identificados en el aire interior de los locales estudiados y en el exterior. MNE: Indica micelio no esporulado. NI: Indica que fueron taxones no identificados.
Al determinar el coeficiente de similitud de Sørensen (QS) de los taxones obtenidos en el aire interior con relación a los detectados en el exterior, se obtuvo una elevada similitud que fue respaldada por un QS de 0.8, mostrando que la mayoría de los taxones detectados en el aire interior provienen del exterior. En ambos ambientes se detectaron los géneros Aspergillus, Botrytis, Cladosporium y Penicillium, así como levaduras y el MNE. Esto evidencia la influencia que tuvo el ambiente exterior en el ambiente interior de los locales. Sin embargo, hubo cuatro géneros que solo fueron detectados en el aire interior de los locales y ellos fueron Fusarium, Paecilomyces, Rhizopus y Trichoderma (Fig. 5).
La prevalencia de los géneros Aspergillus, Cladosporium y Penicillium así como del MNE los clasifica ecológicamente como abundantes en estos ambientes, lo que concuerda con resultados previos (Borrego & Molina, 2020; Borrego et al. 2021).
La distribución de los taxones identificados en los diferentes locales muestreados aparece en la figura 6. El depósito doble del DF (A1 y A2) fue el que mostró la mayor diversidad de taxones (9), con un amplio predominio de Aspergillus. Sin embargo, Cladosporium predominó en el ambiente del DM, cuestión que era de esperarse ya que las puertas del local permanecieron abiertas todo el tiempo y que ese fue el género que predominó en el ambiente exterior. En la oficina que se encuentra dentro del DF se detectaron propágulos fúngicos correspondientes a los taxones Aspergillus, Cladosporium, Penicillium y MNE, y de ellos predominó Cladosporium, género que se encuentra en mayor concentración debido al intercambio con el exterior (el local se mantuvo abierto todo el tiempo); resultado que concuerda con estudios previos (Borrego & Molina, 2020; Borrego et al. 2021).
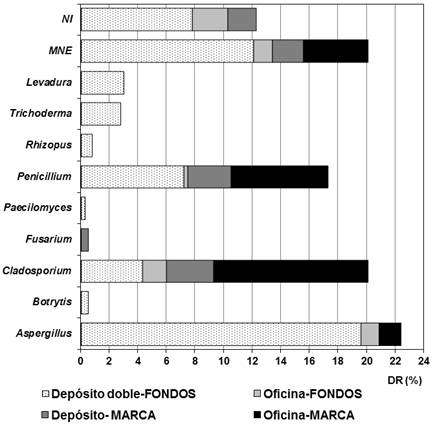
Fig. 6 Distribución de los diferentes taxones aislados en los locales analizados. MNE: Indica micelio no esporulado. NI: Indica que fueron taxones no identificados.
Teniendo en cuenta que los géneros fúngicos pueden ser bioindicadores de la calidad ambiental (Cabral, 2010), se puede sugerir que el predominio de Cladosporium en el aire de las oficinas es un buen indicio de la calidad de esos ambientes ya que es uno de los géneros que debe predominar en el ambiente interior de los locales a concentraciones de hasta 500 UFC/m3 en verano para que la calidad ambiental sea buena (Guild & MacDonald, 2004), y en esos locales las concentraciones fueron menores (30 - 90 UFC/m3).
La distribución de los cuatro taxones mayoritarios en el aire interior por cada uno de los puntos muestreados en el depósito doble del DF (Fig. 7a) muestra cantidades de colonias mayores en la planta baja del depósito (A2) con excepción del punto 9 en el que se detectaron solamente tres colonias del género Aspergillus; y esto pudo deberse a que está ubicado en la zona en que precisamente estaba la ventana abierta. Si bien el género Aspergillus estuvo presente en todos ellos, se observó un marcado predominio del MNE en algunos de los puntos (3: 9 colonias y 12: 18 colonias) mientras que en el resto de los puntos fueron menores o iguales a 8 colonias. Cladosporium spp. solo fue aislado en cuatro puntos (1, 2, 3 y 8) mientras que Penicillium spp. fue detectado en seis puntos (3, 4, 7, 8, 11 y 12). Cabe destacar que a pesar de que la parte superior del depósito (A1) mostró en general menores cantidades de colonias de los taxones, el punto 3 resultó ser el de mayor diversidad fúngica con los 4 taxones predominantes en este estudio. Similar diversidad se detectó también en el punto 8 de A2.
Para el DM (Fig. 7b) se corrobora lo antes observado, el piso superior donde se encuentran los documentos es el más contaminado (punto 22) y con un predominio del género Penicillium, caracterizado por proporcionar olor a humedad en ese espacio. Sin embargo, el punto 21 que está ubicado exactamente debajo, fue el que mostró la mayor diversidad fúngica. Cabe resaltar que, a diferencia del depósito doble del DF, en el DM predominaron los micelios no esporulados.
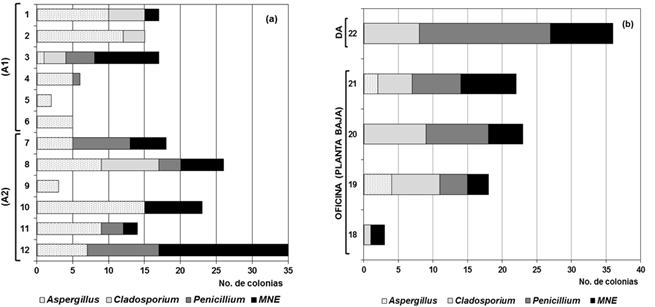
Fig. 7 Distribución de los taxones predominantes Aspergillus, Cladosporium, Penicillium y el MNE (micelio no esporulado) en (a) los dos pisos del depósito doble ubicado en el DF y (b) el DM de la OCPI. A1: parte alta del depósito. A2: parte baja del depósito. DA: Depósito de archivo ubicado dentro del DM.
Es importante tener en cuenta que los micelios no esporulados se han referido previamente en ambientes de archivos cubanos incluida la OCPI (Rodríguez et al., 2014; Borrego & Perdomo, 2016; Borrego & Molina, 2019; Borrego & Molina, 2020; Borrego et al., 2021) y de otros países como Egipto, Indonesia y Turquía (Osman et al., 2017; Kadaifciler, 2017; Rahmawati et al., 2018); además de que se ha informado que muchos de ellos corresponden a especies patógenas (Pounder et al., 2007).
Potencial biodeteriorante
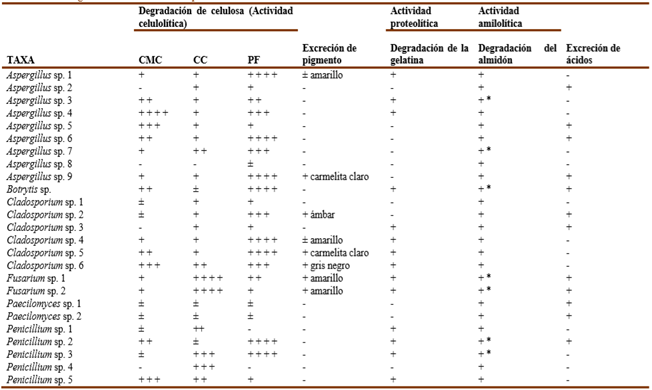
Las cepas aisladas presentaron un elevado poder biodeteriogénico sobre los componentes del papel. La mayoría de las cepas, destacándose Aspergillus y Cladosporium fueron capaces de degradar el PF como única fuente de carbono, mientras que la CC, de más compleja asimilación que el resto de los polímeros celulolíticos empleados en este estudio (Molina & Borrego, 2014), fue mayormente degradada por las dos cepas de Fusarium. También, 12 de las cepas (40%) excretaron pigmentos con predominio de los tonos ámbar y carmelitas, similar a lo ocurrido en estudios anteriores (Borrego & Molina, 2014; Molina et al., 2017; Borrego & Molina, 2020). La gelatina fue degradada por 19 cepas (63.3%) en tanto el 100% de las cepas degradaron el almidón, incluso 11 de ellas (36.7%) resultaron tener una fuerte actividad amilolítica. El almidón y la gelatina resultan compuestos de suma importancia a tener en cuenta en el biodeterioro documental debido a que forman parte de muchos aditivos y pegamentos utilizados para encuadernaciones (Molina & Borrego, 2014; Molina et al., 2017). La producción de ácido por parte de las cepas aisladas, resultó ser baja en comparación con un estudio realizado previamente en esta misma institución (Borrego & Molina, 2020), pues solo el 36.7% de ellas excretaron ácidos (Tabla 2 y 3). Estos resultados indican la enorme diversidad metabólica que puede existir entre las diferentes cepas, incluso siendo aisladas del mismo ecosistema.
Es importante destacar que cuando una misma cepa presenta varias potencialidades degradativas, resulta ser más peligrosas para los documentos que se conservan (Borrego et al., 2017), ya que es capaz de utilizar los componentes del papel y de las encuadernaciones como nutrientes de forma más agresiva, siempre que la T y la HR sean apropiadas para su crecimiento. En este estudio se comprobó que el 13.3% de las cepas fueron capaces de mostrar las cinco actividades degradativas ensayadas (Fusarium sp. 1, Fusarium sp. 2, Rhizopus sp., Trichoderma polysporum), el 40% de ellas mostraron cuatro de las actividades (Aspergillus sp. 1, Aspergillus sp. 9, Botrytis sp., Cladosporium sp. 2, Cladosporium sp. 3, Cladosporium sp. 4, Cladosporium sp. 5, Cladosporium sp. 6, Penicillium sp. 2, Trichoderma piluliferum, Trichoderma reesei) y el 30% mostraron tres de estas actividades (Aspergillus sp. 3, Aspergillus sp. 4, Aspergillus sp. 5, Aspergillus sp. 6, Paecilomyces sp. 1, Paecilomyces sp. 2, Penicillium sp. 3, Penicillium sp. 5, Penicillium sp. 6), indicando el alto riesgo que representan los hongos ambientales para las colecciones documentales atesoradas en la OCPI.
Tabla 3 Poder degradativo de las diferentes cepas aisladas de los ambientes muestreados. (continuación de la tabla 2)
|
|
+ + + | ± | + + + | - | + | + | - |
|
|
+ + | + + + | + | ± ámbar | + | + * | + |
| + + + | + + | + + | ± amarillo | + | + * | - | |
| + + + | + + + | + + + | + amarillo | + | + * | - | |
| + + + + | + + + | + + + | + amarillo limón | + | + * | + |
Consideraciones finales
En este trabajo, se detectaron diferencias en el comportamiento de la calidad micológica del aire en locales de la OCPI en relación a estudios previos, a pesar del predominio de algunos taxones que son frecuentes en ambientes de archivos y museos cubanos. Aunque imperaron los géneros Aspergillus, Cladosporium, Penicillium así como un MNE, el depósito doble del DF mostró la mayor diversidad fúngica. Algunos de los géneros que se detectaron con preponderancia en este estudio como Aspergillus, Cladosporium y Penicillium, pueden desencadenar estados alérgicos más o menos severos, lo que se ve potenciado por el pequeño tamaño de sus esporas, considerado como atributo patogénico importante ya que son capaces de llegar hasta el tracto respiratorio inferior, lo que depende también de las concentraciones de sus propágulos en el aire y el tiempo de exposición de los trabajadores durante la jornada laboral. Por ello, es importante que el personal use medios de protección personal durante el trabajo en las áreas de depósitos de documentos o cuando manipula documentos empolvados.
Los índices interiores/exterior obtenidos en el Departamento de Fondos (DF) (con promedio en su depósito doble (A1 y A2) de 0.9, en AC de 0.4 y en la oficina de 0.8) y en el Departamento de Marcas (DM) (oficina con 0.8 y el DA con 2.7) sugieren que la mayoría de las áreas analizadas poseen buena calidad micológica del aire, a excepción del depósito de archivo (DA) ubicado en el DM.
Se evidenció la existencia de zonas de amplificación de la concentración fúngica en dos puntos del depósito documental doble ubicado en el departamento de Fondos (DF) y en el DA localizado en el DM, indicativo de que en esas áreas no hay buena circulación del aire y por tanto se produce su estancamiento, así como el aumento de la concentración de los propágulos fúngicos aerotransportados.
También se demostró la alta correspondencia de los taxones identificados en el ambiente interior y en el exterior, como fueron Penicillium y Cladosporium, lo que indica la incidencia del ambiente exterior en el interior de los locales.
La mayoría de las cepas evaluadas resultaron positivas a cuatro de las cinco pruebas fisiológicas realizadas (actividad celulolítica, proteolítica, amilolítica y excreción de ácidos y pigmentos), lo que es indicativo de que las colecciones documentales atesoradas en la OCPI están expuestas a un alto riesgo potencial de biodeterioro.
Los estudios de la micobiota ambiental enfocados al biodeterioro de materiales y a la salud humana, deben realizarse de forma puntual y sistemática, además de incluir una buena identificación taxonómica y caracterización fisiológica de las cepas más abundantes.