INTRODUCCIÓN
El procesamiento del plasma sanguíneo es una de las más importantes industrias en el sector biofarmacéutico, debido a su amplio uso en padecimientos asociados con las deficiencias congénitas o adquiridas de anticuerpos y enfermedades de la sangre, específicamente el uso de diversas proteínas plasmáticas como la inmunoglobulina (IgG), la albúmina humana y los factores VIII y IX de la coagulación sanguínea para su tratamiento (Cádiz et. al.,1984).
La terapia con proteínas plasmáticas se distingue de las tradicionales drogas farmacéuticas en importantes aspectos. En lugar de sintetizarse en un laboratorio químico, las proteínas del plasma se obtienen a partir de una donación del plasma de personas aparentemente sanos. Esto implica que tanto el proceso de producción como los productos obtenidos, están sometidos a regulaciones relativas a la seguridad y protección de los pacientes (Cádiz et. al.,1984).
Una endotoxina es una fracción de lipopolisacárido de la pared celular de algunas bacterias Gram negativas, que al solubilizarse actúa como toxina. Se conoce que las endotoxinas son los mayores contaminantes en las proteínas disponibles comercialmente o en las sustancias biológicamente activas y con frecuencia complican su efecto biológico (Aida y Pabst, 1990; Anspach, 2001; Lu et al, 2008; Park y Lee, 2013; Petsch y Anspach, 2000; Raetz y Whitfield, 2002).
Las endotoxinas no actúan directamente contra las células u órganos sino a través de la activación del sistema inmunitario, especialmente los monocitos y macrófagos, mejorando así la respuesta inmunitaria. Estas células liberan mediadores, como el factor de necrosis tumoral (TNF), varias interleucinas, prostaglandinas, factor estimulante de colonias, factor activador de plaquetas y radicales libres. Los mediadores tienen una potente actividad biológica y son responsables de los efectos secundarios de la exposición a las endotoxinas. Estos incluyen alteraciones en la estructura y función de órganos y células, cambios en las funciones metabólicas, aumento de la temperatura corporal, activación de la cascada de la coagulación, modificación de la hemodinámica e inducción de shock (Magalhaes et al, 2007).
Como parte de las exigencias para el cumplimiento de las Buenas Prácticas de Fabricación en la producción de hemoderivados, estos tienen que cumplir con niveles de endotoxinas establecidos por la farmacopea europea y la farmacopea de los Estados Unidos (USP) de América las regulaciones nacionales e internacionales para poder ser usados en la clínica para su administración parenteral. (CECMED, 2020; European Pharmacopeia , 2019; FDA, 2012; USP 43 th edition, 2019).
En el caso de las inmunoglobulinas de uso intramuscular el límite establecido por farmacopea es < 5 EU/mL y en el caso de las inmunoglobulinas intravenosas < 1 EU/mL, donde este último es tomado como criterio de evaluación de la efectividad de cada alternativa evaluada por ser el peor caso. (European Pharmacopeia, 2019; USP 43th edition, 2019)
Los métodos más conocidos para la remoción de endotoxinas emplean la separación selectiva mediante membranas de ultrafiltración (10 kDa) con amplia aplicación en el tratamiento de agua, la separación selectiva de fases con detergentes aniónicos (Tritón X-114), el uso de adsorbentes electropositivos multimodales como Histidina, Polymyxin-B o Toyopearl-NH2-750F, el uso de Hydroxyapatita, así como diferentes variantes cromatográficas. (Aida y Pabst, 1990; Anspach, 2001; Chen et al, 2022; Gagnon, 2017; Koziel et al, 2018; Liu et al, 1997; Ma et al, 2012; Madadkar et al, 2018; Magalhaes et al, 2007; Ongkudon et al, 2012; Petsch y Anspach, 2000; Sandle, 2022; Silva et al, 2021; Schneier et al, 2020; Teodorowicz et al, 2017; Yang et al, 2021; Zhao et al, 2020).
Los métodos cromatográficos son razonablemente efectivos para la eliminación de endotoxinas de soluciones de proteína con recuperaciones de proteína relativamente altas. Sin embargo, en el caso de resinas de afinidad estas no se pueden limpiar con condiciones estándar de despirogenización con hidróxido de sodio, aunque las resinas de intercambio iónico más recientes (eje: Fractogel) son más resistentes a estos tratamientos. (Pratt, 2019)
Aunque la cromatografía basada en perlas (resina) sigue siendo predominante y eficaz para las operaciones de elución de productos, tiene varias desventajas inherentes para las aplicaciones de pulido o eliminación de trazas de impurezas. Además, la capacidad de unión por adsorción de las columnas basadas en perlas que se utilizan en esta aplicación suele ser de 3 a 4 órdenes de magnitud mayor que la requerida porque las columnas normalmente se dimensionan para lograr el caudal deseado en lugar de la capacidad. (Anspach, 2001; Magalhaes et al, 2007; Petsch y Anspach, 2000)
La cromatografía basada en membrana explota los mismos mecanismos utilizados en la cromatografía de afinidad y de intercambio iónico, pero ofrece un reducido tiempo de procesamiento e inversión inicial. Similar a la cromatografía de afinidad, se puede lograr un rendimiento del producto cercano al 100%. (Anspach y Petsch, 2000; Petsch y Anspach, 2000)
En la adsorción de membrana, los mismos ligandos usados en cromatografía de afinidad o resinas utilizadas en cromatografía de intercambio iónico se unen a un medio de soporte. El uso de una membrana mejora en gran medida las tasas de flujo y casi elimina las limitaciones de difusión. Las membranas pueden estar hechas de celulosa, acetato de celulosa, nailon, acetato de polietileno vinílico, alcohol polivinílico y fluoruro de polivinilideno. (Schneier et al, 2020)
Las cápsulas de membrana son de un solo uso, lo que significa que no hay necesidad de eluir, limpiar o regenerar. Los beneficios de las membranas de un solo uso incluyen una menor posibilidad de contaminación del producto, menor tiempo de proceso y menor volumen de tampón debido a la disminución de los pasos de limpieza requeridos. (de Vries et al., 2018)
La cromatografía basada en membrana se ha empleado con éxito para separaciones preparativas, predominantemente para separaciones de proteínas. Sin embargo, la adopción universal de esta tecnología no ha tenido lugar porque la cromatografía de membrana está limitada por la capacidad de unión, que es pequeña en comparación con las columnas basadas en perlas, aunque las ventajas de alto flujo que brindan la adsorción en membranas conducirían a una mayor productividad. (Chen et al, 2022; Madadkar et al, 2018; Magalhaes et al, 2007; Ongkudon et al, 2012; Schneier et al, 2020)
Se continúan ensayando nuevos materiales para la remoción de endotoxinas en soluciones de proteínas. (Silva et al, 2021; Schneier et al, 2020; Yang et al, 2021; Zhao et Al, 2020;).
En este trabajo se emplea un concepto bien conocido y establecido como es el uso de la cromatografía en el modo negativo (flow-through) ya sea mediante el uso de resinas o usando soportes cromatográficos embebidos (acoplados) a membranas de filtración (membrane absorber) que en este caso hace uso de soportes cromatográficos aniónicos para aprovechar que las endotoxinas tienen fundamentalmente carga negativa.
Se considera posible establecer un proceso cromatográfico que permita remover las endotoxinas residuales presentes en una solución de inmunoglobulina hasta cumplir el requerimiento regulatorio (< 1 EU/ml) para inmunoglobulinas intravenosas y para ello se evalúan dos alternativas cromatográfica: resina del tipo Fractogel TMAE-M y cápsula del tipo Sartobind-Q, ambos con grupo funcional amino cuaternario, para los que se evalúa la incidencia en este proceso de la concentración de proteínas, la fuerza iónica y el pH.
MATERIALES Y MÉTODOS
Los reactivos a utilizados en este estudio fueron; sodio dihidrógeno fosfato dihidratado, di-sodio hidrógeno fosfato anhidro, sodio cloruro, el sodio hidróxido y el ácido acético fueron obtenidos de Merck Millipore (Alemania), lipopolisacáridos de E. coli O55:B5, fueron obtenidos de Sigma Aldrich Co. (St. Louis, MO. USA), reactivo PerciNorm-U fue obtenido de Roche (Suiza), y se utilizó un Kit cinético cromogénico PyroChrome para determinación de endotoxinas (LAL) de Cape Cod Inc., (USA). Todos los productos químicos utilizados para este estudio eran grado reactivo.
MÉTODOS
Preparación de solución de endotoxinas:
Los polisacáridos (LPS) fueron disueltos en agua libre de endotoxinas y filtrado por cápsula de 0,22 µm y luego se diluyó hasta 500,000 EU/ml. La solución madre de LPS se usó para calcular las diferentes diluciones a ensayar 325 Eu/ml (real: 321,76 EU/ml); 120 EU/ml (real: 119,18 EU/ml) y 75 EU/ml (real: 72,52 EU/ml) respectivamente.
Preparación de las muestras de inmunoglobulina-G:
Se empleó como material de partida la pasta-II (rica en inmunoglobulina) parcialmente purificada que fue obtenida durante el proceso de fraccionamiento alcohólico del plasma, la que puede contener un determinado nivel de endotoxinas. Se preparó una solución madre de proteína que contenía 15,0 mg/ml de proteína en fosfato de sodio 10 mM, pH 6,0 o pH 6,5. Se diluyó una alícuota primaria de 425 ml de la solución madre de proteínas con el mismo tampón hasta alcanzar una concentración de proteínas cercana a 8 mg/ml a los pH seleccionados.
Procedimiento cromatográfico de remoción de endotoxinas en modo negativo:
Se empleó columna preempacada de intercambio aniónico, modelo Minichrom con resina Fractogel TMAE-M de 5ml, de Φ8x100mm, volumen muerto Vo=3ml, (Merck-Millipore, Alemania) y cápsula con membrana de intercambio aniónico del tipo Sartobind-Q, modelo Nano, altura de la cama de resina 4 mm, volumen de resina de 1ml, volumen muerto Vo=5ml Area-36,4 cm² (Sartorius-Stedim, Alemania).
La remoción de endotoxinas se ejecutó en modo negativo (acoplando las endotoxinas) inyectando 4 VC con el objetivo de atrapar las endotoxinas. Las muestras fueron cargadas usando el sistema cromatográfico Akta Star, (GE, USA) a una velocidad de flujo de 1,0 ml/min. El tampón de trabajo 10mM sodio fosfato, pH-6,5/6,0 fue empleado para el equilibrado y el lavado, la elución del material acoplado (endotoxinas y contaminantes proteicos) se realizó con el tampón de trabajo con 1M de sodio cloruro. Antes de iniciar/terminar cada proceso se procedió a descontaminar el soporte cromatográfico: con NaOH-0,5M para la columna Fractogel TMAE-M y en el caso de la cápsula Sartobind-Q con NaOH-1M. A continuación, se enjuagó con abundante agua libre de endotoxinas y luego se equilibró nuevamente con el tampón de trabajo. Se tomaron muestras del material de partida y del material no acoplado (pass-through) en el soporte cromatográfico en forma de alícuotas cada 2/0,5 ml las que se utilizó para las siguientes mediciones:
Determinación de endotoxinas:
Las mediciones se realizaron utilizando un lector de microplacas de incubación modelo ELx808 IU para determinación de LAL, (BioTek® Instruments, USA). Se toman muestras antes de inyectar en la columna/cápsula cromatográfica, así como de cada alícuota (2/0,5 ml) colectada a la salida de estos.
A su vez los valores de endotoxinas obtenidos permiten calcular:
El valor de reducción logarítmica (LRV) para cada alícuota, como el logaritmo en base 10 del cociente entre el valor de endotoxina de la muestra inicial y el de cada alícuota colectada a la salida de la columna/cápsula expresada en EU/ml.
Endotoxinas totales contenidas en la muestra inicial fueron calculadas como el resultado de la multiplicación de la carga EU/ml por el volumen total de la muestra inyectada en la columna/cápsula.
Endotoxinas totales removidas en cada alícuota colectada, se determinó como la diferencia entre la carga de endotoxinas por ml de la muestra inicial (EU/ml) y la carga residual de cada alícuota colectada al salir de la columna/cápsula, que se multiplicó por el volumen de cada alícuota.
Capacidad de remoción total de endotoxinas (EU) en la columna/cápsula, se determinó como la suma total de los valores individuales de las endotoxinas totales removidas en cada alícuota.
Porciento de remoción total de endotoxinas, se expresó como el cociente entre el valor de la remoción total de endotoxinas y el valor total de endotoxinas de la muestra inicial.
Medición de la absorbancia:
Las mediciones de absorbancia se realizaron a temperatura ambiente utilizando un espectrofotómetro UV-Vis modelo V-630 (Jasco internacional Co., Ltd., Tokio, Japón) y una celda de cuarzo de 10 mm de paso óptico. El tamaño de la muestra es de 10 µL usando el coeficiente para 1 mg/ml. Se tomó una muestra de la solución de inmunoglobulina antes de inyectar/salida a la columna/cápsula cromatográfica.
Los valores de absorbancia obtenidos permiten calcular:
Proteínas totales de la muestra inicial y de cada alícuota colectada, como la multiplicación del valor (promedio) de proteínas por su volumen correspondiente.
Recobrado acumulado por alícuotas, que se obtiene de dividiendo el valor de las proteínas totales de cada alícuota entre las proteínas totales de la muestra inicial y añadiendo el valor acumulado en la alícuota anterior.
Merma de cada proceso, como la diferencia entre las proteínas totales de la muestra inicial y de la suma total de las alícuotas colectadas.
RESULTADOS Y DISCUSION
Se analizó la influencia de tres parámetros tecnológicos (concentración de proteínas, fuerza iónica y pH) en el comportamiento de los dos principales criterios técnicos de eficiencia del procedimiento: 1. Capacidad de remoción en endotoxinas expresada como EU (unidades de endotoxinas) totales, 2. Recobrado de proteínas expresado como mg/proteína total. En cada caso se ejecutaron 3 réplicas.
Todas las operaciones relacionadas con el proceso de ensayos se realizaron en condiciones controladas observando las Buenas Prácticas de Laboratorio.
Columna aniónica con resina del tipo Fractogel TMAE-M.
Influencia de la concentración de proteínas y la fuerza iónica en la capacidad de remoción de endotoxinas.
En el caso de la columna aniónica con resina del tipo Fractogel TMAE-M se prefijó un valor de pH=6,5 y se ensayó a dos valores extremos de la concentración de proteínas (máx. posible 15% [150 g/L] y mín. deseado 7,74% [77,4 g/L]) en dos escenarios posibles para evaluar adicionalmente la influencia de una ligera fuerza iónica en los dos criterios técnicos de eficiencia del procedimiento.
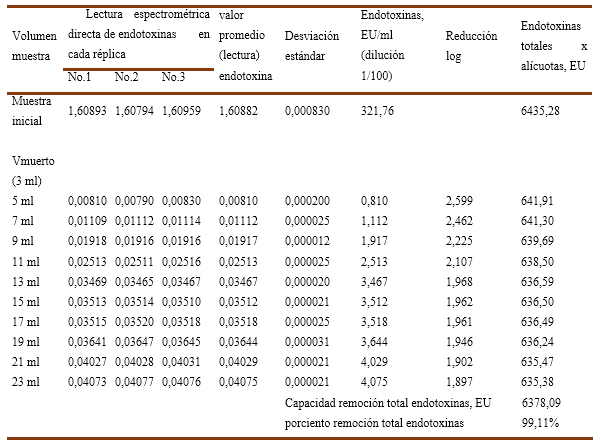
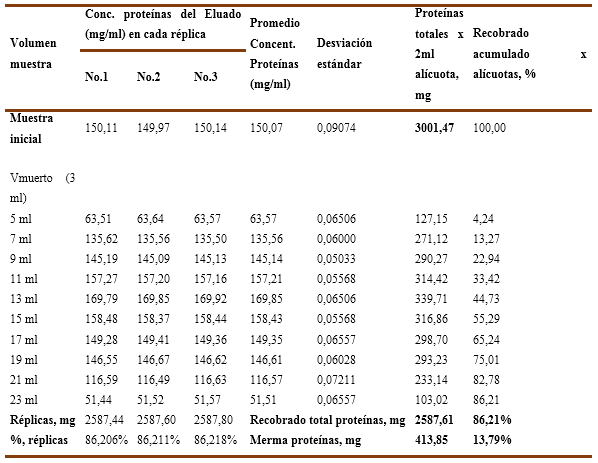
Para el experimento No.1, se empleó una solución de inmunoglobulina-G al 15 % preparada en el buffer de trabajo con una carga inicial de endotoxinas 312,76 EU/ml en las que se emplean dos variantes de fuerza iónica: a) sin cloruro de sodio b) con 25mM-NaCl. Los valores numéricos de las variables determinadas y calculadas para las 3 réplicas ensayadas se recogen en la Tabla No.1 y Tabla No.2 como se explicó anteriormente.
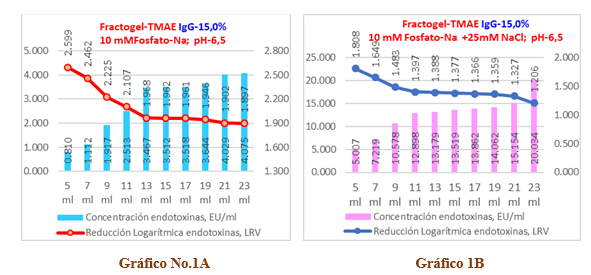
Gráficos No 1A y 1B se observa la influencia de la fuerza iónica (0mM-NaCl y 25mM-NaCl) en la capacidad de remoción de endotoxinas para una muestra de inmunoglobulina-G al 15% con una carga inicial de endotoxinas de 321,764 EU/ml en una columna del tipo Fractogel TMAE.
En el Gráfico No.1 A sin cloruro de sodio, se aprecia que solo la primera alícuota de 2ml (< 0,5 VC) es capaz de cumplir con el límite de endotoxinas (< 1 EU/ml) establecido para las inmunoglobulinas intravenosas que en este caso corresponde a un valor de 0,810 EU/ml, lo cual resulta en una reducción logarítmica de endotoxinas de 2,6 LRV para esta alícuota y aunque remueve un 99,11% (ver Tabla No.1) de las endotoxinas totales en los 4VC ensayados, en el resto de las alícuotas resulta totalmente ineficiente la columna de Fractogel TMAE-M al obtener valores superiores al referido límite.
Por otra parte, en el Gráfico 1B corresponde a una fuerza iónica reforzada, se aprecia que para estas condiciones ninguna de las alícuotas es capaz de remover endotoxinas por debajo del límite establecido, comportándose la carga de endotoxinas residuales por alícuotas desde 5,01 EU/ml hasta los 20,03 EU/ml, correspondiendo este comportamiento a una reducción logarítmica de las endotoxinas que oscila en el rango entre 1,8 LRV a 1,2 LRV y que al finalizar la corrida solo es removido el 96,10% (ver tabla No.2) de todas las endotoxinas lo que significa que esta variante es inclusive menos eficiente que la anterior.
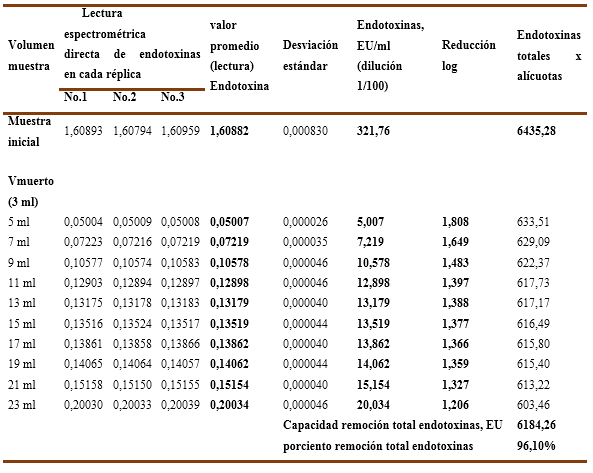
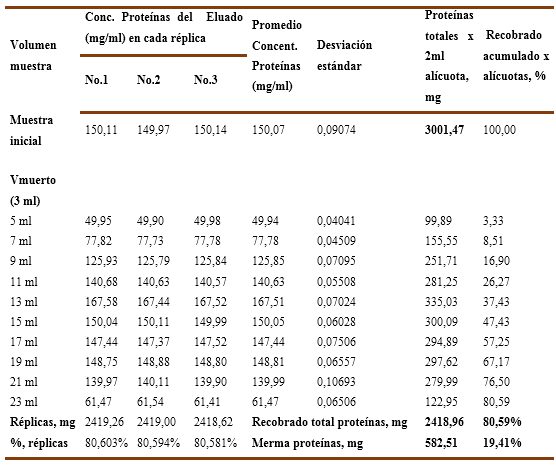
En el experimento No.2 se empleó la misma solución de inmunoglobulina del primer ensayo, pero en este caso se diluyó su concentración hasta cerca de la mitad con el buffer de trabajo, resultando una concentración de proteínas de 7,74 % (77,4 g/L) y una carga inicial de endotoxinas 119,18 EU/ml. Al igual que en el primer experimento se ensayaron dos variantes de fuerza iónica. Los resultados numéricos para las réplicas ensayadas se recogen en la Tabla No.3 y Tabla No.4.
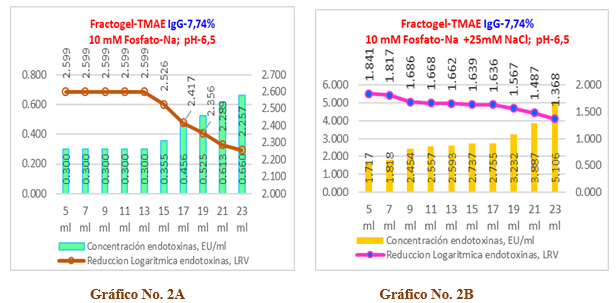
Gráfico No 2A y 2B. Se observa la influencia de la fuerza iónica en la capacidad de remoción de endotoxinas para una muestra de inmunoglobulina-G diluida al 7,74% con una carga inicial de endotoxinas de 119,18 EU/ml en una columna del tipo Fractogel TMAE-M.
Al comparar los dos experimentos ejecutados con la resina Fratogel TMAE-M en cuanto a la capacidad de remoción de endotoxinas se evidencia que los mejores resultados se obtienen donde la fuerza iónica es mínima y cuando la concentración de proteínas es de 7,74 %.
En el Gráfico No.2A, sin cloruro de sodio, para la carga inicial de endotoxinas ensayada, la resina es capaz de remover de forma efectiva las mismas en todos los 20 ml de muestra, donde la carga de endotoxinas residual en la solución se mueve desde un nivel de 0,300 EU/ml en los primeros 10 ml y luego para los restantes 10 ml se incrementa hasta un valor de 0,659 EU/ml, que corresponden a una reducción logarítmica de las endotoxinas en el rango que oscila entre 2,6 LRV y 2,3 LRV, así como remueve el 99,66% (ver tabla No.3) de las endotoxinas totales en los 4VC ensayados, lo cual significa que todas las alícuotas cumplen con el límite establecido (< 1 EU/ml) y que la resina Fractogel TMAE-M trabaja de forma eficiente y eficaz.
Por otra parte, en el Gráfico No. 2B, con refuerzo de la fuerza iónica, ninguna de las alícuotas es capaz de remover endotoxinas por debajo del límite establecido, comportándose la carga de endotoxinas residuales por alícuotas desde 1,72 EU/ml hasta los 5,11 EU/ml que corresponde a una reducción logarítmica de las endotoxinas que oscila en el rango entre 1,8 a 1,4 LRV y aunque es removido el 97,58% (ver Tabla No.4) de las endotoxinas en los 4VC ensayados, para estas condiciones de fuerza iónica reforzada la columna de Fractogel TMAE es incapaz de remover de forma efectiva las endotoxinas y
Al comparar los dos experimentos ejecutados con la resina Fratogel TMAE-M en cuanto a la capacidad de remoción de endotoxinas se evidencia que los mejores resultados se obtienen donde la fuerza iónica es mínima y cuando la concentración de proteínas es de 7,74%.
Influencia de la concentración de proteínas en el recobrado de proteínas
La segunda parte de los ensayos realizados está relacionada con el análisis del recobrado de proteínas al usar la resina aniónica Fractogel TMAE-M en los dos escenarios antes descritos para realizar una valoración de los resultados que se discuten a continuación.
Se evalúa, para el experimento No.1 el comportamiento del recobrado de proteínas para una solución de inmunoglobulina al 15% en las dos variantes ensayadas con y sin cloruro de sodio, cuyos resultados numéricos (parámetros medidos o calculados) se recogen en la Tabla 5 y la Tabla 6.
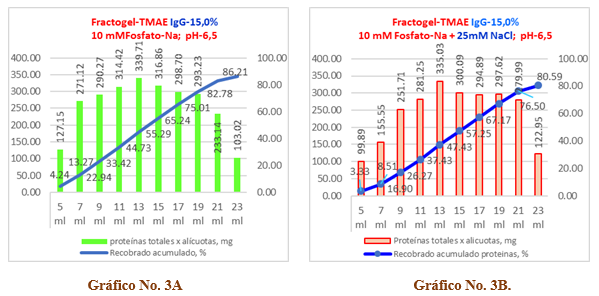
Gráfico No 3A y 3B. Se observa el comportamiento del recobrado de proteínas para una muestra de inmunoglobulina-G al 15,0 % en una columna del tipo Fractogel TMAE-M.
En el Gráfico No. 3A, sin cloruro de sodio, se observa que el recobrado total de proteínas alcanza un valor de 2587,61 mg lo cual corresponde a un 86,21% del valor inicial, así como una merma de 413,85 mg que significa un 13,79%. A su vez, en el gráfico de la derecha correspondiente a la solución que se le adicionó 25 mM de cloruro de sodio se aprecia un recobrado del 80,59% que corresponde a 2418,96 mg de proteína con una merma del 19,41% que equivale a 413,85 mg.
Para el experimento No.2, los resultados se observan en el Gráfico No.4A y 4B, donde el Gráfico No.4A corresponde a una solución de IgG al 7,74 % sin cloruro de sodio, el recobrado total de proteínas es de un 94,34 % que equivale a un valor de 1459,90 mg de proteínas. Lo anterior significa que existe una merma del 5,66 % correspondiente un valor de 87,63 mg, cuyos resultados numéricos se recogen en la Tabla 7.
A su vez, en el gráfico No.4B correspondiente a la misma solución que se le adiciona 25 mM de cloruro de sodio, se aprecia un recobrado del 85,42 % que corresponde a 1321,83 mg de proteína con una merma del 14,58 % que equivale a 225,71 mg. Los valores numéricos se recogen en la Tabla 8.
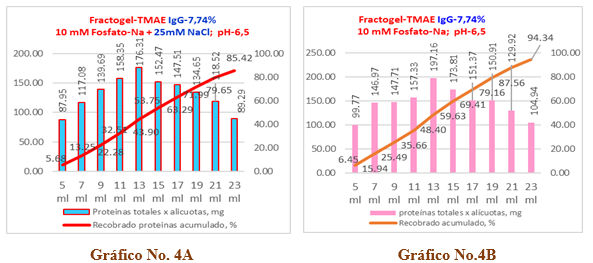
Gráfico No 4A y 4B. Se expone el comportamiento del recobrado de proteínas para una muestra de inmunoglobulina-G al 7,74 % en una columna del tipo Fractogel TMAE-M.
Resumiendo, para la resina Fractogel TMAE-M cuando comparamos el comportamiento de los parámetros capacidad de remoción de endotoxinas y recobrado de proteínas los mejores resultados corresponden al experimento No.2 para una solución de inmunoglobulina con una concentración de proteínas del 7,74% (77,4g/L) donde la resina es capaz de remover endotoxinas por debajo del límite máximo establecido (< 1 EU/ml) para 4 VC (20 mL) de muestra y se obtiene un recobrado máximo de proteínas del 94,34%.
Lo anterior significa que bajo estas condiciones la resina Fractogel TMAE-M para 1000 ml de resina se puede remover de forma eficiente una carga máxima de (110 EU/ml x 1000 ml resina x 4 VC) equivalente a 440 000 EU.
Cápsula con membrana cromatográfica aniónica del tipo Sartobind-Q Influencia del pH en la capacidad de remoción de endotoxinas
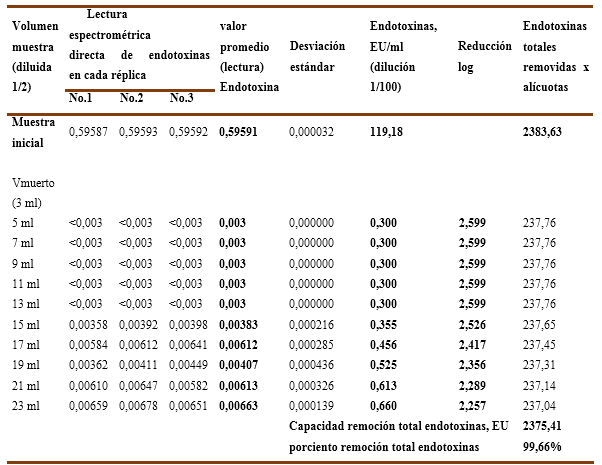
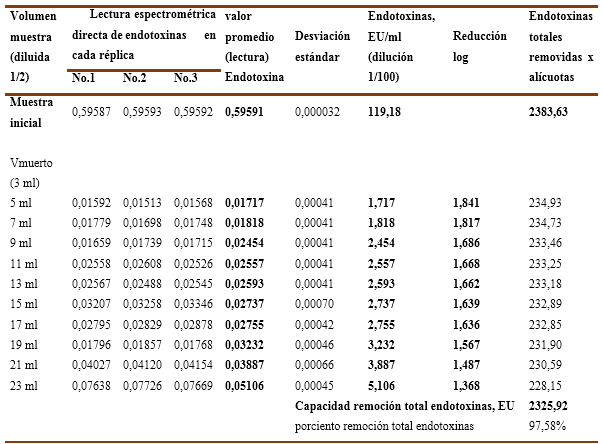
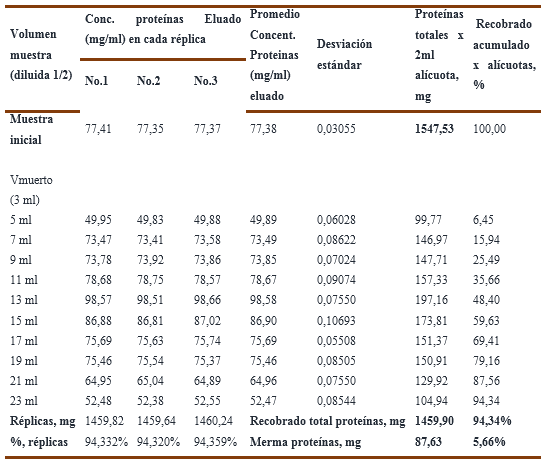
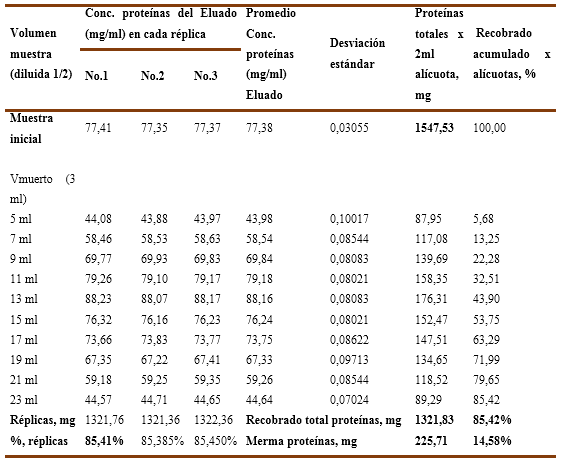
Tomando en consideración que el mejor resultado obtenido con la resina Fractogel TMAE, para una solución de inmunoglobulina, se decidió ejecutar el experimento No.3 para evaluar la influencia del pH en dos puntos (pH=6,0 y pH=6,5) en el comportamiento de la capacidad de remoción de endotoxinas y el recobrado de proteínas en un soporte cromatográfico en membrana, en este caso una cápsula aniónica (membrane adsorber) del tipo Sartobind-Q, cuyos resultados numéricos se recogen en las Tablas 9, 10, 11 y12.
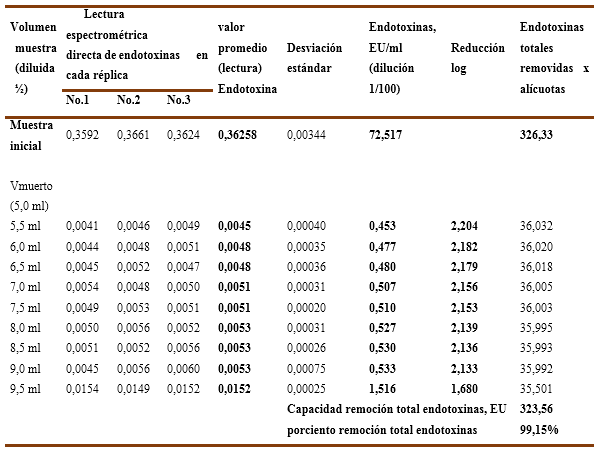
En el Gráfico No.5A y 5B se recoge la incidencia del pH, para una solución de IgG-7,92%, en la capacidad de remoción de endotoxinas (carga inicial de 72,517 EU/ml) de una cápsula Sartobind-Q, en el Gráfico No.5A se evidencia que a pH-6,0 mantiene su valor promedio entre 0,453 y 0,533 EU/ml al resultar capaz de remover las endotoxinas a valores < 1 EU/ml durante 4VC, pero alcanza un valor de 1,5167 EU/ml en los 4,5 VC donde no cumple, cuyos valores de reducción logarítmica se encuentran entre 2,204 LRV y 2,133 LRV en los primeros 4 VC y disminuye a 1,680 LRV a los 4,5 VC . Lo anterior significa que la inyección de una solución de IgG-7,92% ajustada a pH-6,0 en una cápsula Sartobind-Q para un volumen de inyección de 4,0 VC (4,6ml) resulta eficiente.
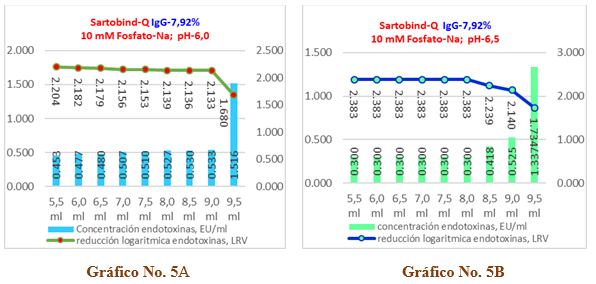
Gráfico No. 5A y 5B. Muestra la influencia del pH en la capacidad de remoción de endotoxinas para la IgG-G al 7,92% con una carga inicial de endotoxinas de 72,52 EU/ml aplicados en una Cápsula Sartobind-Q.
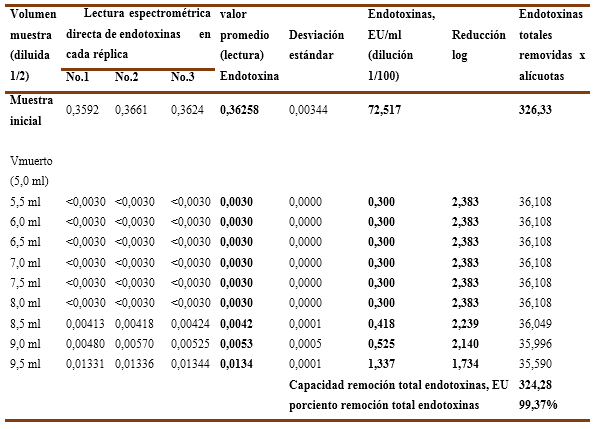
En el Gráfico No.5B, a pH-6,5 las endotoxinas residuales tienen un valor promedio de 0,300 EU/ml en los primeros 3VC, luego aumenta ligeramente hasta 0,525 EU/ml que corresponde a 4,0 VC para los que remueve las endotoxinas por debajo del límite establecido y alcanza un resultado de 1,337 EU/ml en los 4,5 VC donde no cumple. Además, los valores de reducción logarítmica se enmarcan entre 2,383 LRV y 2,140 LRV en los primeros 4 VC, siendo para los 4,5 VC de 1,734 LRV. Lo anterior significa que una solución de inmunoglobulina ajustada a pH-6,5 y aplicando 4VC en una cápsula Sartobind-Q resulta más eficiente y eficaz que en el caso anterior.
Los valores numéricos para las 3 réplicas ensayadas se recogen en la Tabla No.9 y Tabla No.10 donde se recoge además el porciento de remoción de endotoxinas totales, que para el pH-6,0 solo alcanza el 99,15 % y para el pH-6,5 llega hasta el 99,37 %, incidiendo en ambos casos la última alícuota (4,5VC) en la cual no se logra cumplir la exigencia <1 EU/ml.
Como se aprecia de los valores representados en estos gráficos no existen diferencias significativas en cuanto a la capacidad de remoción de endotoxinas en los primeros 4VC para los dos valores de pH analizados. Por ello se procede a comparar el recobrado de proteínas.
Influencia del pH en la recobrado de proteínas en una cápsula Sartobind-Q
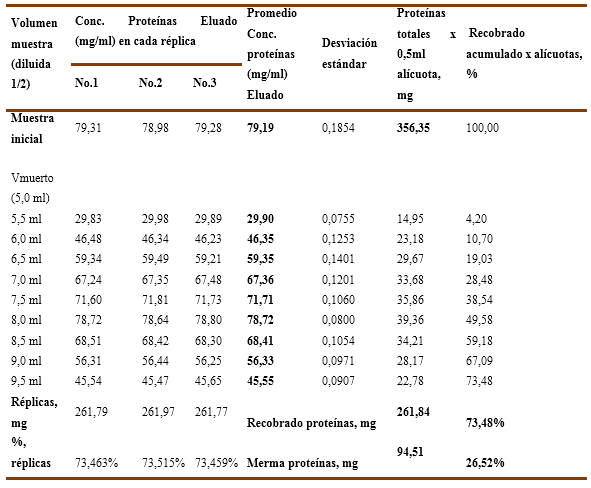
En el Gráfico No. 6A y 6B se recoge el recobrado de proteínas para una solución de inmunoglobulina al 7,92% ensayadas en dos condiciones de pH, donde a la izquierda se observa para pH=6,0 que el recobrado total de proteínas es de un 73,48 % que equivale a un valor de 261,84 mg de proteínas, lo cual resulta bastante bajo e ineficiente por cuanto la merma de proteínas es del 26,52 % que corresponde a 94,51 mg, cuyos valores numéricos se recogen en la Tabla 11.
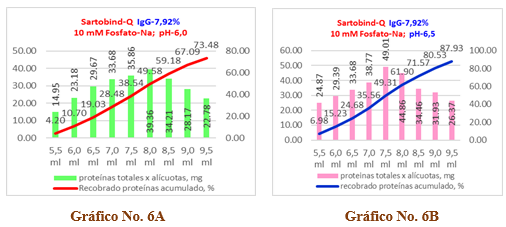
Gráfico No. 6A y 6B. Se observa la influencia del pH en el recobrado de proteínas para una solución de IgG al 7,92% con una carga inicial de endotoxinas de 72,52 EU/ml aplicados en una Cápsula Sartobind-Q.
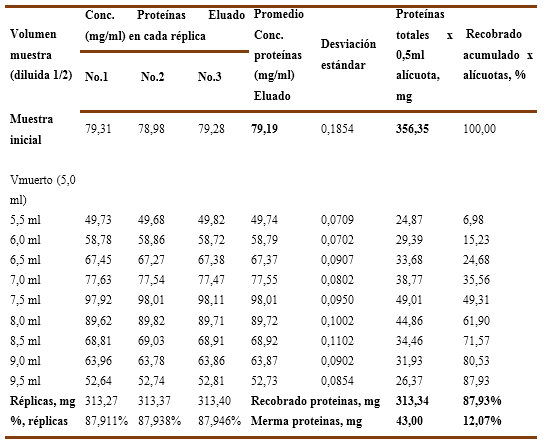
A su vez, en el Gráfico No. 6B correspondiente al pH=6,5 se aprecia un recobrado del 87,93 % que corresponde a 313,34 mg de proteína con una merma del 12,07 % que equivale a 43,01 mg. Los valores numéricos se recogen en la Tabla 12.
Al comparar el comportamiento de los dos parámetros de interés (capacidad de remoción de endotoxinas y recobrado de proteínas) para la cápsula aniónica del tipo Sartobind-Q los mejores resultados se obtuvieron para la solución de inmunoglobulina ajustada a un pH=6,5, la cual es capaz de remover endotoxinas durante 4 VC de muestra por debajo del límite máximo establecido para las inmunoglobulinas intravenosas y se obtiene un recobrado máximo de proteínas del 87,93%. Lo anterior significa que una cápsula del tipo Sartobind-Q con 1000 ml de capacidad, bajo estas condiciones, es capaz de remover de forma efectiva una carga máxima (70 EU/ml x 1000 ml resina x 4 VC) de 280 000 EU.
Según Petsch y Anspach, las preparaciones de albúmina sérica o de anticuerpos monoclonales se administran en cantidades que alcanzan entre varios cientos o miles de miligramos por kg de peso corporal: los niveles altos de endotoxinas están fuera de discusión. Para estas proteínas se requieren métodos para eliminar las trazas de endotoxinas residuales que quedan después de usar los trenes de purificación comunes.
En el caso de las inmunoglobulinas de uso intravenoso las dosis pueden oscilar entre 200 - 500 mg / kg de peso corporal, razón por la cual es imprescindible encontrar una solución.
CONCLUSIONES
Se pueden considerar como válidas las dos alternativas cromatográficas, la columna Fractogel TMAE-M y la cápsula cromatográfica Sartobind-Q, para la remoción de endotoxinas en soluciones de inmunoglobulinas preparadas a concentraciones de proteína inferior al 8,0 % pues ambas cumplen la exigencia regulatoria (< 1 EU/ml) para las inmunoglobulinas intravenosas. No se encontraron diferencias significativas en cuanto a capacidad de remoción de endotoxinas a pH=6,0 y pH=6,5, pero el recobrado resultó superior para la solución de inmunoglobulina preparada a pH=6,5. Ambas alternativas para 4VC son eficaces en cuanto a capacidad de remoción endotoxinas y permiten un recobrado final de proteínas superior al 85% lo cual es aceptable para procesos cromatográficos.