Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Centro Azúcar
versión On-line ISSN 2223-4861
cen. az. vol.44 no.2 Santa Clara abr.-jun. 2017
ARTICULO
Efecto del ph en la producción de celulasas de aspergillus niger en fermentación sólida
Effect of the initial ph in the cellulase of aspergillus niger production in solid-state fermentation
Gualberto Leon-Revelo1, Mario César Cujilema-Quitio1, Linnet Baryolo González 1, Ernesto Rosero Delgado2, Jesús Córdova3 y Luis Beltrán Ramos-Sánchez1*
1Departamento de Ingeniería Química. Universidad de Camagüey Ignacio Agramonte Loynaz. Carretera Circunvalación Norte km 5 ½, Camagüey, Cuba.
2Universidad Técnica de Manabí. Av. Urbina y Che Guevara, Manabí, Ecuador.
3Departamento de Química. Universidad de Guadalajara. Av. Juárez 976 y América, Guadalajara, México.
*Autor para la correspondencia: Luis B. Ramos, Email: luis.ramos@reduc.edu.cu
RESUMEN
En este trabajo se presenta un estudio cinético en el que se analizó la influencia del pH inicial del medio en la producción de celulasas (PFasa) por una cepa de Aspergillus niger, cultivada en fermentación en estado sólido Los resultados indicaron que un nivel de pH inicial de 4,5 fue el óptimo para la producción de celulasas. En estas condiciones se alcanza una actividad PFasa de 25,11 UI/gMSen 18 h, con una productividad de 1,40 UI h-1 gMS-1.
Palabras clave: Celulasas, Aspergillus niger, fermentación sólida, pH, cinética
ABSTRACT
In this work, a kinetic study is presented analyzing the influence of the initial pH on (PFasa) cellulase production by an Aspergillus niger strain, cultured in solid-state fermentation. The results showed that the optimum value of initial pH for PFasa production was 4.5. The PFasa activity reached 25.11 UI/gMS in 18 hours and a productivity of 1.40 UI h-1gMS-1 under these initial pH conditions.
Key words: Cellulases, Aspergillus niger, solid-state fermentation, pH, kinetics
INTRODUCCIÓN
El estudio de las celulasas comenzó desde los años 80 del siglo XX. Estuvo primeramente asociado al mejoramiento de la producción industrial dealimento animal (Oulad et al., 2009). Durante las últimas dos décadas, el uso de celulasas ha aumentado considerablemente por sus amplias aplicaciones en diferentes industrias, sobre todo en las de detergentes, extracción de jugos y de biocombustibles (Oulad et al., 2009). Actualmente las celulasas son la llave para el acceso a la enorme riqueza acumulada en millones de toneladas de residuos lignocelulósicos que se generan anualmente. La hidrólisis de estos materiales permitiría aumentar el rendimiento de la agricultura, necesitada de la producción de más alimentos por área de cultivo. Adicionalmente se concibe que los azúcares obtenidos serían punto de partida de numerosas rutas de síntesis que permitirán enfrentar la necesidad de la sustitución del petróleo como fuente de numerosos materiales usados en la vida cotidiana, llegando a definir el concepto de biorrefinería.
La fermentación en estado sólido (FES) tiene el potencial para volverse un método económicamente competitivo de la producción de enzimas celulasas (Hansen et al., 2015), por las ventajas que presenta comparado con las fermentaciones sumergidas: el uso de residuos agroindustriales como sustratos, su fácil manejo y montaje, el bajo costo de inversión y la baja liberación de efluentes líquidos contaminantes (Raghuwanshi et al., 2014). La FES usa preferentementelos hongos filamentosos como organismos productores; siendoel género Aspergillus,ampliamente empleado en procesos tales como: la producción de ácidos orgánicos, de biosurfactantes y deenzimas; siendo estas últimas, lasque constituyen su mayor aporte en la industria biotecnológica (Membrillo et al., 2008; Yoon et al., 2013).
La producciónde enzimas extracelulares por unmicroorganismo es influenciadatantopor parámetros ambientales como nutricionales. En particular, la producción de enzimases influenciada por el pH. El intervalo de pH para el crecimiento de hongos filamentosos es muy amplio y frecuentemente va desde 3 hasta 7. Sin embargo, para la producción de celulasas en hongos filamentosos mayormente se reportan en un intervalo de pH entre 4 y 6;siendo los pH de 4,5 y 5 en los que se ha encontradouna mayor producción de esta enzima(Das et al., 2013; Dinis et al., 2009; Falkoski et al., 2013; Xiros et al., 2008b). A pH más elevados aumenta la producción de proteínas extracelulareslo que tiene un efecto negativo sobre la actividad específica de las celulasas (Xiros et al., 2008a). Por el contrario, la disminución de este parámetro provoca una inhibición del crecimientofúngico. Para evitar una disminución excesivadel pHen la FES, se ha utilizado con éxito como fuente de nitrógeno una mezcla de sulfato de amonio y urea, más el di hidrogeno fosfato de potasio tiene un efecto amortiguador del pH (Dhillon et al., 2012; Ruiz et al., 2012).
La producción de celulasas en residuos sólidos de la producción de cerveza es un tema poco investigado hasta la fecha. La variada composición y valor nutricional de estos residuos pudiera servir de base para la obtención de estas enzimas por fermentación sólida. Esta investigación tiene por objetivo determinar las condiciones más apropiadas de pH para la producción de celulasas, en el cultivo deAspergillus nigeren fermentación en estado sólido (FES) con medio basado en el uso del bagazo cervecero.
MATERIALES Y MÉTODOS
2.1. Relacionadas con la fermentación en estado sólido
2.1.1. Microorganismo y preparación de inóculo
Se utilizó la cepa UC33 de Aspergillus niger de la colección del grupo científico de Desarrollo de Bioprocesos de la Universidad de Camagüey. Las cepas se conservaron en tubos inclinados con medio de cultivo papa - dextrosa-agar (PDA), las que se conservaron a una temperatura de 4±1°C.
La propagación del microorganismo se hizo en placas Petri con 10 mL de medio PDA. Se inoculó siguiendo la técnica de estriado. Después de 72hde incubación a 30 °C, se cosecharon los conidios, losque fueron arrastrados con agua destilada estéril. La concentración de conidios se determinó por conteo en la cámara de Neubauer. Esta suspensión de conidios se inoculó en un medio líquido en una concentración de 1x107 conidios/mL para la producción de micelio. El medio líquido para la propagación está compuesto por: extracto de levadura (10 g/L), peptona (10 g/L) y miel final de caña (43 g/L).La propagación se realizó, incubando a 30°C yuna agitación 150 rpm por 30 h.
2.1.2. Materiales lignocelulósicos inductores y sus pretratamientos
Se utilizó afrecho cervecero proporcionado por la cervecería Tínima y la cáscara de arroz procedente de una fábrica de pienso local, ambas localizadasen la provincia de Camagüey, Cuba. Las materias primas fueron secadas a 70 °C por 24 h y se guardaron en bolsas plásticas hasta su posterior uso.
A la cáscara de arroz se le realizó un pre-tratamiento con ácido sulfúrico al 1% durante 2 h, a temperatura ambiente (Galbe y Zacchi, 2007). Al afrecho cervecero, sin embargo,se decidió no realizarle pre-tratamiento alguno, ya que éste, al ser un residuo de la fabricación de cerveza, ha recibido pre-tratamientos térmicosyenzimáticos durante el proceso de maceración de la cebada.
2.1.3. Fermentación en Estado Sólido
Se fermentó 5 g de medio total húmedo en erlenmeyers de 250mL, usándose como material lignocelulósico una mezcla de cáscara de arroz y afrecho cervecero, conformando un medio de cultivodenominado GLCel-01,impregnando por una disolución nutritiva de minerales e inductores en relación líquido-sólidode 1:6. No se informa las proporciones de estas sales por estar sujeta a solicitud de patente.
Se incubó a 30 °C durante 30 hen cultivo estático, con una humedad de la masa total húmeda (MTH) de 57 %. El muestreo se realizó cada 6 h en condiciones asépticas.
El pH del medio de cultivo se ajustó a los diferentes valores iniciales deseados, con NaOH para valores alcalinos y, ácido cítrico,para valores ácidos.
2.1.4. Extracto crudo enzimático
Después de un análisis de los procedimientos para la extracción de celulasas reportados en la literatura (Abo-State et al., 2010; Bahrin et al., 2011; Brijwani y Vadlani 2011; Dhillon et al., 2012), se estructuró un procedimiento efectivo para su extracción.Se suspendió el material fermentado en agua destilada en una relación de 1:9, agitandoa 200 rpm por 1 h, a temperatura ambiente. Seguidamente, el material suspendido y la biomasa fúngica fueron separados por centrifugación (10000 rpm x 15 min). El sobrenadante filtrado fue usado como fuente para la determinación de las enzimas en estudio y los azúcares.
2.2. Técnicas analíticas
2.2.1. Análisis del pH
Para determinar el pH se utilizó un pH metro de la marca HANNA, de fabricación china. El procedimiento utilizado fue el siguiente: se pesa 1g de medio sólido yse suspende en 9 mL de agua destilada. Se agita con un equipo vortex marca: IKA durante 5 minutos, se separa por filtración el sólido y luego se realiza la medición.
2.2.2. Actividad y productividad enzimática PFasa
La actividad celulasa fue analizada al medir la glucosa liberada de la hidrólisis enzimática de la celulosa, utilizando como sustrato para medir la actividad PFasael papel de filtro Whatman #1 al 1%. Se trabajó a un pH de 4,8 utilizando como solución tampón citrato de sodio a0,1 mol/L y tiempo de hidrolisis de 60 minutos. La concentración de glucosa fue medida con el método del ácidodi-nitro-salicílico (DNS),tal como reporta Chaplin (Rocky-Salimi y Hamidi-Esfahani, 2010). La actividad PFasa se expresó en unidades internacionales de enzima (UI). Una UI es la cantidad de enzima que libera 1 µmol de glucosapor minuto bajo las condiciones de ensayo y se expresa como UI/gMS (unidades internacionales por gramo de masa seca de medio sólido). La productividad enzimática se calculó dividendo la actividad PFasa por el tiempo necesario para alcanzarla
2.2.3. Azúcares reductores totales
Los Azúcares reductores totales fueron medidos por la técnica del DNS, tal como se refiere en el epígrafe anterior.
2.3. Diseño experimental
Se seleccionó un diseño multifactorial categórico; con dos factores independientes: el pH con cinco niveles (4 -4,5 – 5 - 6 - 7) y el tiempo de fermentación, con cinco niveles (6 - 12 – 18 – 24 - 30 h).El experimento se realizó por triplicado, dando un total de 75 corridas experimentales.
Como variable respuesta se utilizó la actividad y productividad enzimática, el pH del medio y el contenido de reductores. Se realizó un análisis de varianza junto a la prueba de diferencia mínima significativa con el paquete estadístico STATGRAPHIS®, Centurión XV, versión 15.2.05.
RESULTADOS Y DISCUSIÓN
3.1. Análisis de las dinámicas de las variables respuestas
3.1.1. Comportamiento del pH del medio
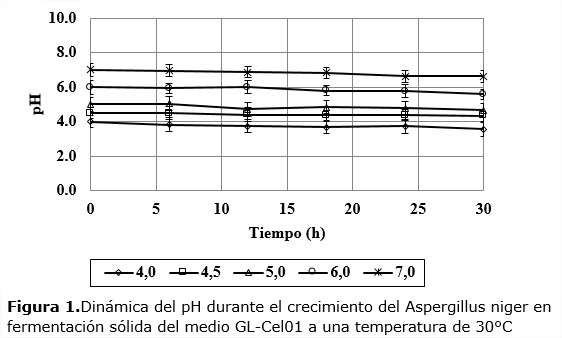
Las dinámicas del pH del medio sólidoen los cinco niveles iniciales investigados tuvieron poca variación respecto al tiempo cero, mostrando así la efectividad del efecto tampón del medio usado (Figura 1).
Este comportamiento permite afirmar que los efectos inducidos en el microorganismo por los diferentes niveles iniciales de pH se mantienen con poco cambio durante toda la dinámica del crecimiento de hongo, sin confundirse con los otros niveles de pH, algo que permite sacar conclusiones sobre la influencia de este factor en la cinética del proceso.
3.1.2. Dinámica de los azúcares reductores
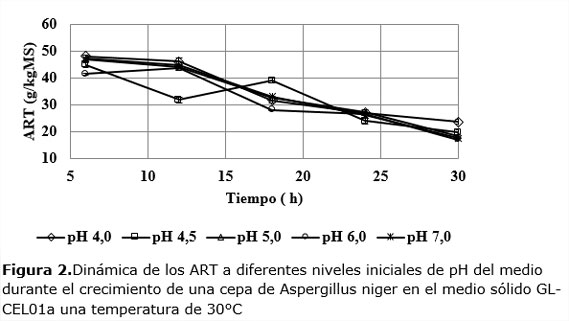
La dinámica de la concentración de ART muestra una tendencia a la disminución paulatina con el tiempo a todos los niveles iniciales de pH, tal como se muestra en la Figura 2.
Durante las primeras 24 h los niveles más bajos y altos de ART en el medio corresponden a los pH de 4 y 4,5 respectivamente. Llama la atención la brusca disminución que experimenta esta variable para pH 4,5 la que a las 12 h se aparta de las demás, llegando a bajar hasta 31,79 g/kgMS, para luego aumentar y seguir la tendencia de los otros experimentos. Este resultado puede parecer aleatorio, pero, como se verá más adelante, otras variables respuestas tienen un comportamiento que puede estar en correspondencia con la súbita bajada de los ART ocurrido en el intervalo de 6 a 12 h.Después de las 24 h, la concentración de azúcares es prácticamente la misma en todas las dinámicas.
La compleja interacción que se establece en la dinámica de la concentración de ART incluye: la existencia inicial en el medio de azúcares simples, la producción de ART debido a la actividad enzimática y, al consumo de éstos debido a la actividad del microorganismo. El comportamiento observado en la Figura 2 permite afirmar que la cantidad de azúcares producidos por la actividad enzimática no logra superar la que se consume para el crecimiento. Dentro de los factores que concurren al unísono para esta resultante se pudieran citar: el muy rápido crecimiento de la biomasa del moho que supera la productividad de ART y, la insuficiente actividad específica del sistema enzimático. En este último caso, la falta de actividad pudiera estar dada por la inhibición por productos de las enzimas, debida a la relativamente alta concentración de azúcares en el medio (Pensupa et al., 2013), la que oscila entre 40 y 45 g/kgMS al inicio y que termina entre 15 y 25 g/kg MS al cabo de las treinta h de fermentación.
3.1.3. Actividad PFasa
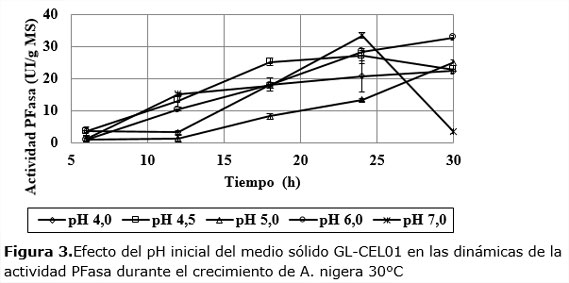
Las dinámicas de la actividad PFasa muestran que, excepto a pH 7, los niveles de actividad PFasa son significativos y oscilan entre 23 y 33 UI/gMS. A pH 5 se observa un aumento suave de esta variable que se acelera desde las 12 h hasta llegar a valores superiores a 25 UI/gMS.
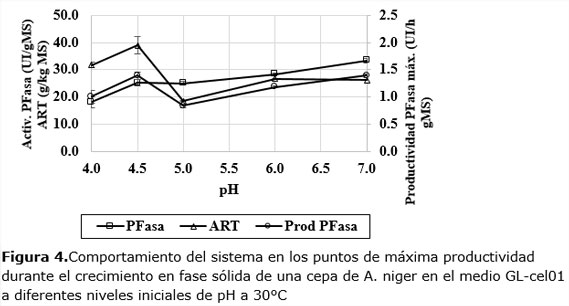
A pH 4,5 y 7,0 la dinámica es más rápida en las primeras 24 h, aunque los valores finales a 30 h, no son los mayores. Teniendo en cuenta este comportamiento se decidió analizar el comportamiento de la actividad de cada dinámica en los puntos de máxima productividad enzimática (Figura4).
En la Figura 4 se observa que la actividad enzimática aumenta monótonamente al aumentar el pH. Los valores de actividad son significativos en estas condiciones y aumentan desde 19 UI/gMS hasta 34 UI/gMS. Sin embargo, los máximos de productividad enzimática ocurren a pH más ácidos: 4,0 (1,01 UI/h gMS) y 4,5 (1,4 UI/h gMS); para luego aumentar desde pH 5 hasta pH 7 (1,39 UI/h gMS), nivel en que, prácticamente, se iguala la productividad máxima alcanzada en pH 4,5.
Según se reporta en la literatura, para maximizar la actividad PFasa son frecuentes los informes de pH en niveles óptimos cercanos a los reportados en este trabajo, es decir, en el intervalo de pH de 4-7 (Bahrin et al., 2011; Brijwani y Vadlani, 2011; Delabona et al., 2013; Dhillon et al., 2012; Elisashvili et al., 2008; Fawzi y Hamdy, 2011; Kumar et al., 2011; León y col. 2000; Membrillo et al., 2008; Pensupa et al., 2013; Rodrigues et al., 2013; Rodríguez-Zúñiga et al., 2013; Santos et al., 2012).
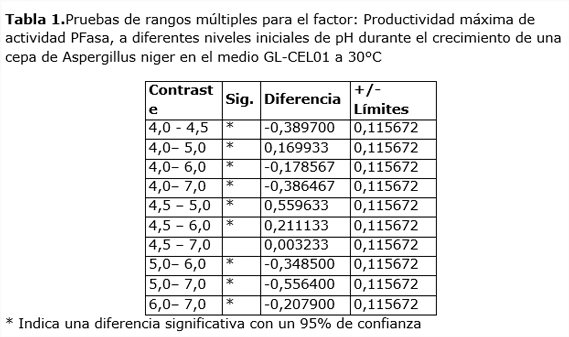
Los resultados de máxima productividad alcanzados en las dinámicas a diferentes valores iniciales de pH fueron sometidas a un análisis de varianza, el que arrojó la existencia de diferencias altamente significativas (p<<< 0,01 y F=44,3). El contraste de cada resultado (Tabla 1) indica que sólo no existen diferencias significativas entre las productividades máximas alcanzadas a pH 4,5 y pH 7,0.
En el caso de las actividades PFasa, alcanzadas en estas condiciones, se observan también diferencias altamente significativas (p<<<0,01 y F=64,23), excepto entre los niveles de pH inicial 4,5 y 5,0. Estos resultados contienen una problemática a la hora de decidir qué nivel de pH es el óptimo. Se ha demostrado que no hay diferencias en cuanto a productividad entre estos dos niveles, sin embargo, otros criterios que apuntan también a lo económico difieren en ambos casos. En primer lugar, el pH de 4,5 no requiere del uso de sustancias que ajusten pH para alcanzarlo, pues cuando se unen las materias primas básicas del medio, éste es el nivel que se alcanza. Esto quiere decir que trabajar a pH 7 requeriría de gastos adicionales de materia prima para corregir el pH hacia el valor neutro. Así pues, aunque ligeramente, el costo a pH 4,5 será por este concepto menor que a 7,0.
Una cuestión que debe ser considerada también es el hecho de que para el control de posibles infecciones de bacterias un pH tan bajo como 4,5 es más conveniente que el pH neutro, lo que es otro punto a su favor a la hora de la toma de decisiones sobre cuál pH escoger. A mayor probabilidad de infecciones, menor será la efectividad de la producción anual, lo que traerá consigo un incremento del costo unitario por producciones desechadas o de bajos rendimientos.
Otro elemento importante es que el tiempo al que se alcanza la máxima productividad es menor a pH 4,5 que ha pH 7 (Figura 5).
Tiempos de fermentación menores implican menores costos de operación por varios conceptos, incluyendo menores gastos energéticos. Al mismo tiempo con tiempos de fermentación menores se podrán realizar una mayor cantidad de ciclos productivos anuales. Considerando 7920 h como fondo de tiempo anual disponible y dos horas de tiempo auxiliar, aparte del tiempo de fermentación, las diferencias en el tiempo de fermentación observado a pH 4,5 y pH 7,0 implicarían que en el primer caso se realicen 396 ciclos por año, mientras que en el otro, sólo se realizarían 330. De esta manera la producción se vería incrementada en un 20% a pH 4,5. Mayor producción implicará mejoras significativas en el costo unitario. Teniendo en cuenta el costo de las enzimas es el elemento que más influye en la posibilidad del éxito de su aplicación, habrá que prestar atención a este análisis.
A pH 7,0 el nivel de actividad que se alcanza a las 24 h (33,41 UI/gMS) es 33% superior al que se logra con pH 4,5. Esta diferencia tendrá efectos sobre el costo de operación de la etapa de purificación. Probablemente el costo de inversión de esta etapa productiva sea menor y también su costo de operación. Esto es algo que es imposible de visualizar en el estado actual de la investigación, pero deberá ser considerado en trabajos posteriores.
El análisis de los diversos factores en pro y en contra discutidos hasta aquí sobre los dos niveles de mejores resultados inclina la selección hacia el pH 4,5.
3.2. Comparación de los resultados con informes de la literatura
En el experimento se destaca el factor tiempo como decisivo para la eficiencia de la producción de este sistema enzimático. Comparado con otros tiempos reportados en la literatura, los resultados con esta cepa de A. nigera pH 4,5 y 7,0 son destacados. La Figura 6 ha sido construida con los datos recopilados por Hansen y colaboradores (Hansen et al., 2015). Cuenta con 47 informes de cepas de ascomicetos.
Nótese en esta Figura 6 que los tiempos requeridos para alcanzar el resultado óptimo están distribuidos, principalmente, entre una y dos semanas, las que suman más del 90% de los informes. Los mejores resultados alcanzados en este trabajo, los que oscilan entre 18 y 24 h resultan muy prometedores para un futuro proceso productivo competitivo.
CONCLUSIONES
1- Las dinámicas a niveles de pH iniciales más bajos exhibieron máximos de productividad a menores tiempos de fermentación.
2- El pH inicial de 4,5 tuvo la mayor productividad observada, aunque sin diferencias significativas respecto al pH 7.
3- Razones asociadas a factores tendentes a producir un menor costo unitario de la enzima indican como más promisorio un pH inicial del medio de 4,5.
4- La productividad máxima al pH inicial de 4,5 fue de 1,4 UI/h gMS, lograda a las 18 h, con una actividad PFasa de 25,11 UI/gMS.
AGRADECIMIENTOS
La realización del trabajo de investigación que ha servido de base para esta publicación ha contado con el apoyo de la Secretaría Nacional de Educación Superior, Ciencia Tecnología del Ecuador (SENESCYT) y de la Universidad de Camagüey Ignacio Agramonte Loynaz, Cuba.
REFERENCIAS
Abo-State, M.A.M., Hammad, A.I., Swelim, M., y Gannam, R.B., Enhanced Production of Cellulase(S) By Aspergillus spp. Isolated From Agriculture Wastes by Solid State Fermentation., American-Eurasian J. Agric. & Environ. Sci., Vol.8, No. 4, 2010, pp. 402-410.
Bahrin, E.K., Seng, P.Y., y Abd-Aziz, S., Effect of Oil Palm Empty Fruit Bunch Particle Size on Cellulase Production by Botryosphaeria sp. Under Solid State Fermentation., Australian Journal of Basic and Applied Sciences., Vol. 5, 2011, pp. 276-280.
Brijwani, K., y Vadlani, P.V., Cellulolytic Enzymes Production via Solid-State Fermentation: Effect of Pretreatment Methods on Physicochemical Characteristics of Substrate., Enzyme Research , 2011, pp. 1-10.
Das, A., Tanmay, P., Halder, S., Jana, A., Maity, C., Pradeep, K., Mohapatra, D., Bikas R.P., Mondal, K.C., Production of cellulolytic enzymes by Aspergillus fumigatus ABK9 in wheat bran-rice straw mixed substrate and use of cocktail enzymes for deinking of waste office paper pulp., Bioresource Technology, Vol.128, 2013, pp. 290–296.
Delabona, P.D.S., Buzon, P.R.D. P., Codima, C.A., Tremacoldi, C.R., Rodrigues, A., y Farinas, C.S., Effect of initial moisture content on two Amazon rainforest Aspergillus strains cultivated on agro-industrial residues: Biomass-degrading enzymes production and characterization., Industrial Crops and Products, Vol. 42, 2013, pp. 236– 242.
Dhillon, G., Kaura, S., Brara, S.K., y Verma, M., Potential of apple pomace as a solid substrate for fungal cellulase and hemicellulase bioproduction through solid-state fermentation., Industrial Crops and Products., Vol. 38, 2012, pp. 6-13.
Dinis, M.J., Bezerra, R.M.F., Nunes, F., Dias, A.A., Guedes, C.V., Ferreira, L.M.M., Modification of wheat straw lignin by solid state fermentation with white-rot fungi., Bioresource Technology, Vol.100, 2009, pp. 4829–4835.
Elisashvili, V., Penninckx, M., Kachlishvili, E., Tsiklauri, N., Metreveli, E., Kharziani, T., Lentinus edodes and Pleurotus species lignocellulolytic enzymes activity in submerged and solid-state fermentation of lignocellulosic wastes of different composition., Bioresource Technology, Vol. 99, 2008, pp. 457–462.
Falkoski, D.L., Guimarães, V.M., Almeida, M.N.D., Alfenas, A.C., Colodette, J.L., y Rezende S.T.D., Chrysoporthe cubensis: A new source of cellulases and hemicellulases to application in biomass saccharification processes., Bioresource Technology, Vol. 130, 2013, pp. 296-305.
Fawzi, E.M., y Hamdy, H.S., Improvement of carboxymethyl cellulase production from Chaetomium cellulolyticum NRRL 18756 by mutation and optimization of solid state fermentation., African Journal of Microbiology Research.,Vol. 5, No. 26, 2011, pp. 4687-4696.
Galbe, M., y Zacchi, G., Pretreatment of Lignocellulosic Materials for Efficient Bioethanol Production., Biochem Engin/Biotechnol, Vol. 108, 2007, pp. 41-65.
Hansen, G. H., Lübeckb, M., Frisvada, J.C., Lübeck P.S., y Andersen, B., Production of cellulolytic enzymes from ascomycetes: Comparison of solid state and submerged fermentation., Process Biochemistry., Vol. 50, No. 9, 2015, pp. 1327–1341.
Kumar, S., Sharma, H.K., y Sarkar, B.C., Effect of Substrate and Fermentation Conditions on Pectinase and Cellulase Production by Aspergillus niger NCIM 548 in Submerged (SmF) and Solid State Fermentation (SSF)., Food Science Biotechnology, Vol. 20, 2011, pp. 1289-1298.
León, T., Argüelles, J., Mateu, Y., Guerra, G., Gómez, B., Casado, G., Obtención de celulasas de Aspergillus niger, mediante fermentación en estado sólido con bagazo de caña de azúcar., Revista ICIDCA sobre los derivados de la caña de azúcar, Vol. 41, No.3, 2000, pp. 50-59.
Membrillo, I., Sánchez, C., Meneses, M., Favela, E., y Loera, O., Effect of substrate particle size and additional nitrogen source on production of lignocellulolytic enzymes by Pleurotus ostreatus strains., Bioresource Technology, Vol. 99, 2008, pp. 7842–7847.
Oulad, F., Kaddour, S., y Sadoun, T., Adsorption of cellulase Aspergillus niger on a commercial activated carbon: Kinetics and equilibrium studies., Bioresource Technology, Vol. 75, 2009, pp. 93-99.
Pensupa, N., Jin, M.K.M., Archer, D.B., y Du, C., A solid state fungal fermentation-based strategy for the hydrolysis of wheat straw., Bioresource Technology, Vol. 149, 2013, pp. 261-267.
Raghuwanshi, S., Deswal, D., Karp, M., y Kuhad, R.C., Bioprocessing of enhanced cellulase production from a mutant of Trichoderma asperellum RCK2011 and its application in hydrolysis of cellulose., Fuel, Vol. 124, 2014, pp. 183-189.
Rocky-Salimi, K., y Hamidi-Esfahani, Z., Evaluation of the effect of particle size, aeration rate and harvest time on the production of cellulase by Trichoderma reesei QM9414 using response surface methodology., Food and Bioproducts Processing, Vol. 88, 2010, pp.61-66.
Rodrigues, N., Barros, M., Fischer, J., Coutinho, U., y Cardoso, V., Ethanol production from agroindustrial biomass using a crude enzyme complex produced by Aspergillus niger., Renewable Energy, Vol. 57, 2013, pp. 432-435.
Rodríguez-Zúñiga, U.F., Couri, S., Bertucci, V., Crestana, S., y Farinas, C.S., Integrated Strategies to Enhance Cellulolytic Enzyme Production Using an Instrumented Bioreactor for Solid-State Fermentation of Sugarcane Bagasse., BioEnergy Research, Vol. 6, No. 1, 2013, pp. 142–152.
Ruiz, H., Silva, D., Ruzene, D., Lima, L., Vicente, A., y Teixeira., J., Bioethanol production from hydrothermal pretreated wheat straw by a flocculating Saccharomyces cerevisiae strain – Effect of process conditions., Fuel, Vol. 95, 2012, pp. 528-536.
Santos, T.C.D., Gomes, D.P.P., Bonomo, R.C.F., y Franco, M., Optimisation of solid state fermentation of potato peel for the production of cellulolytic enzymes., Food Chemistry, Vol. 133, 2012, pp. 1299-1304.
Xiros, C., Topakas, E., Katapodis, P., y Christakopoulos, P., Evaluation of Fusarium oxysporum as an enzyme factory for the hydrolysis of brewer’s spent grain with improved biodegradability for ethanol production., Industrial Crops and Products, Vol. 28, 2008, pp. 213-224.
Xiros, C., Topakas, E., Katapodis, P., y Christakopoulos, P., Hydrolysis and fermentation of brewer’s spent grain by Neurospora crassa., Bioresource Technology, Vol. 99, 2008, pp. 5427–5435.
Yoon, L.W., Ngoh, G.C., y Chua, A.S.M., Simultaneous production of cellulase and reducing sugar through modification of compositional and structural characteristic of sugarcane bagasse., Enzyme and Microbial Technology, Vol. 53, 2013, pp. 250– 256.
Recibido: Julio 22, 2016
Revisado: Noviembre 8, 2016
Aceptado: Diciembre 12, 2016