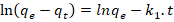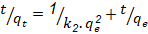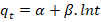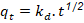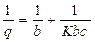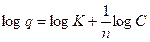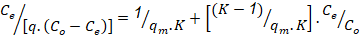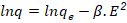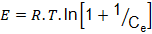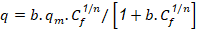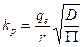INTRODUCCIÓN
La depuración de aguas contaminadas comprende usualmente un tratamiento primario que elimina sólidos y líquidos en suspensión, seguido de un tratamiento secundario de tipo biológico y un tratamiento terciario donde se eliminan contaminantes recalcitrantes que no han sido completamente separados en las etapas anteriores. Entre estos últimos se encuentran algunos metales pesados que aún en muy baja concentración son altamente tóxicos (Fu ( Wang, 2011), requiriéndose el empleo de adsorbentes altamente selectivos a éstos (Horacek et al., 1994), en este sentido, los carbones activados presentan amplias posibilidades de aplicación en la remoción de estos contaminantes indeseables.
Los carbones activados pueden obtenerse a partir de diversos precursores carbonosos, usualmente se utilizan maderas, carbón mineral o cáscaras de coco. La creciente demanda de estos adsorbentes ha incentivado la búsqueda de nuevas fuentes de materias primas, de disponibilidad segura y bajo costo, centrándose la atención especialmente en los materiales renovables. Entre ellos se destacan las cáscaras de nueces, carozos de frutas, aserrín, cortezas de algunas especies de crecimiento rápido (como la aroma) y algunos residuos agroindustriales como el bagazo de caña de azúcar (Villegas et al., 2002).
Parte importante de los metales pesados y otros componentes presentes en aguas contaminadas son removidos por precipitación como hidróxidos insolubles, sales básicas o coprecipitado junto a carbonato de calcio u oxido férrico hidratado, en la etapa de tratamiento con cal, pero esta etapa de depuración no los elimina completamente. Una de las posibilidades de reducir su concentración por debajo de los límites máximos permitidos es mediante su adsorción en carbón activado (Basso et al., 2002). La adsorción en carbones activados se utiliza ampliamente en plantas de tratamiento de aguas para la eliminación de olores, de sabores y para la separación de compuestos orgánicos, pero además en esta etapa se pueden separar los metales pesados (Giraldo, 2005).
Como consecuencia de lo planteado el objetivo de este trabajo es obtener carbón activado con buenas propiedades adsortivas a partir de bagazo de caña de azúcar, variedad Roxa de Mozambique, recurso renovable de disponibilidad en ese país, que permita la eliminación de iones Cd (II) de disoluciones acuosas.
MATERIALES Y MÉTODOS
La preparación del carbón parte de bagazo de caña de azúcar de la variedad Roxa previamente secado a temperatura ambiente, molido en un molino se bolas y tamizado para la obtención de una granulometría de aproximadamente 1 mm de diámetro. Se utilizan procesos “químicos” con ácido fosfórico de 0,6 mol/l y parámetros operacionales de 60 y 120 minutos a temperaturas de 800oC y 600oC. Los adsorbentes obtenidos se evalúan mediante su capacidad de decoloración de soluciones de azul de metileno (Avon et al., 1997). La fracción que más decolora al azul de metileno es sometida a un proceso de caracterización donde se evalúa la densidad aparente por aprisionamiento (g/mL), la densidad picnométrica (g/mL), densidad aparente (g/mL), porosidad (%), compresibilidad (%), factor de forma, humedad (%), material volátil (%), ceniza (%), carbón fijo (%), índice de yodo, índice de azul de metileno, superficie específica respecto al azul de metileno, punto de carga cero convencional y pH.
Una vez caracterizada la fracción se estudia la cinética de adsorción de iones Cd (II) determinando sus concentraciones en disoluciones acuosas mediante la técnica de absorción atómica empleando el espectrofotómetro Perkin Elmer 372 y se aplican diferentes modelos: seudoprimer orden, seudosegundo orden, Elovich y modelo difusional, mediante las siguientes expresiones (Prieto y Lestayo, 2017).
2.1. Modelos cinéticos
Los modelos cinéticos y difusivos evaluados se describen a continuación (Azizian, 2004), (Chun-I y Li-Hua, 2008), (Ejikeme et al., 2011), (Pei-Sin et al., 2014), (Prieto et al., 2019a), (Prieto et al., 2019b).
Modelo de difusión intrapartícula
Donde:
qe |
cantidad de metal adsorbido en el equilibrio (mg/g). |
qt |
cantidad de metal adsorbido en cualquier instante (mg/g). |
t |
tiempo (minutos). |
k1 |
constante de velocidad de seudo primer orden (min-1). |
k2 |
constante de velocidad de seudo segundo orden (g/(mg.min)). |
kd |
constante de velocidad de difusión intrapartícula (mg/g s1/2) . |
α |
velocidad de sorción inicial (mg/g. min). |
β |
constante de desorción (g/mg). |
2.2. Modelos termodinámicos
Para la realización del estudio termodinámico se prepararon cinco disoluciones del adsorbato (30 mL) de diferentes concentraciones (0,2974 mol/l, 0,2091 mol/l, 0,1899 mol/l, 0,1721 mol/l y 0,1632 mol/l). Se ponen en contacto con 1,50 gramos del material utilizado como adsorbente y se agita (250 rpm) durante el tiempo determinado por el estudio cinético. Posteriormente se separan por filtración y se determina la concentración de equilibrio. Se realiza un análisis estadístico a diferentes modelos termodinámicos de adsorción, tales como lo explican Prieto y Lestayo, 2017.
Se aplican los modelos de las isotermas de Langmuir, Freundlich, BET y Dubinin (Foo y Hameed, 2001), (Stoeckli, 2001), (Igwe, 2006).
Modelos de Langmuir
Donde:
q |
capacidad de adsorción para el adsorbente, g de soluto/g sólido. |
c |
concentración de soluto(mol/cm3) |
K |
constante (cm3/mol) |
Modelo de Freundlich
q |
capacidad de adsorción por unidad de peso de adsorbente (mg de soluto/g de adsorbente). |
C |
la concentración molar de equilibrio del adsorbato correspondiente a q (mol/ cm3). |
K |
constante para el sistema adsorbato-adsorbente |
n |
constante que se restringe a valores mayores que la unidad |
Modelo de BET:
Donde:
Co |
la concentración molar inicial del adsorbato (mol/ cm3) |
q |
cantidad de sustancia absorbida por unidad de absorbente, (mg de soluto/g de adsorbente). |
qm |
cantidad de sustancia adsorbida por unidad de masa de absorbente en la monocapa (mg de soluto/g de adsorbente). |
Ce |
concentración molar en equilibrio del soluto en solución, (mol/ cm3). |
K |
constante relacionada con el calor de absorción. |
Modelo de Dubinin- Raduskevich;
Donde
R |
8,314 J/ (mol. K) |
T |
Temperatura absoluta (K) |
ß |
Coeficiente relativo a energía de adsorción (mol2/(g.J2)) |
E |
Potencial de Polany (J/mol) |
Donde:
RESULTADOS Y DISCUSIÓN
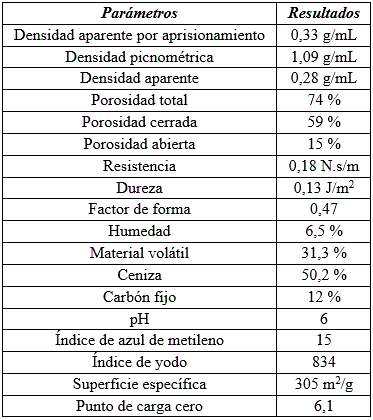
Las diferentes fracciones se someten a la decoloración de azul de metileno y se escoge la que más adsorbió que corresponde a fracción obtenida en 120 minutos y una temperatura de 800 oC. En la (tabla 1) se muestran parámetros físicos y químicos de la fracción de carbón empleada en la adsorción de iones Cd (II).
Tabla 1 Parámetros físicos y químicos de la fracción de carbón empleada en la adsorción de iones Cd (II)
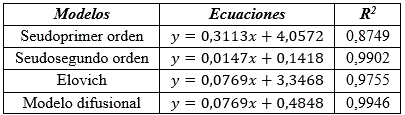
Del estudio cinético se obtuvieron diferentes modelos mostrados en la (tabla 2), evaluados por los coeficientes de correlación.
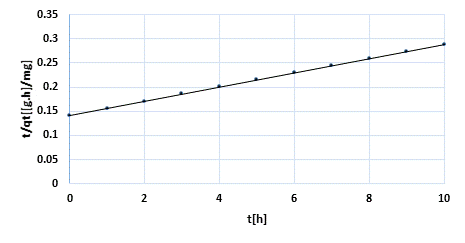
A continuación se muestra la (Fig. 1) que refleja el modelo cinético de seudosegundo orden.
Como se aprecia hay dos factores importantes en la adsorción de iones Cd (II) en soluciones acuosas utilizando carbón obtenido por activación “química”. La adsorción de iones Cd(II) responde a una adsorción de tipo física de seudosegundo orden dado el alto coeficiente de correlación del modelo con velocidad de sorción inicial de 7,052 mg/g.min y tiempo de vida media de 9,646 min. La capacidad de adsorción en el equilibrio responde al valor de 6,80 mg/g. El modelo difusional muestra una constante de velocidad de difusión intrapartícula de 0,0769 mg/g min-1.
Dada la importancia del modelo difusional en el proceso, es posible obtener el coeficiente de difusión efectivo a través de:
Donde:
qe |
capacidad de adsorción en el equilibrio (mg de adsorbato/g de adsorbente). |
kp |
constante difusional (mg/g min0,5). |
D |
difusividad efectiva (cm2/min). |
t |
tiempo (min). |
La ecuación 11 permite obtener un coeficiente de difusión efectivo de 4,1•10-11 m2/s. El valor obtenido, comparado con otros adsorbentes, demuestra una buena difusión (Prieto, et al., 2019c).
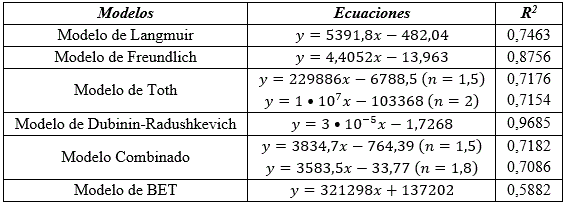
Desde el punto de vista termodinámico se ofrecen las ecuaciones e índices de correlaciones mostrados en la (tabla 3).
El estudio termodinámico demuestra que el modelo de Dubinin-Radushkevich se ajusta a los datos experimentales de la adsorción de los iones Cd (II). El potencial de Polanyi calculado es 129,10 J/mg. La adsorción en los microporos es factor importante en el proceso de adsorción (García, 2004). En concordancia con este modelo la adsorción teórica obtenida es 5,6 mg/g.
El autor principal de este artículo ha estudiado la adsorción de iones Cd (II) en solución acuosa obteniendo los siguientes valores de capacidad de adsorción en zeolita (3,9 mg/g), carbón activado "químicamente" de bambú (4,4 mg/g), ceniza de bagazo de caña de azúcar cubana (3,9 mg/g) y silicato amorfo de calcio (9,9 mg/g). Se evidencia la alta capacidad de adsorción del silicato amorfo. Lo anterior obedece a la alta superficie específica del mismo (Prieto y Lestayo, 2017). El valor obtenido para el material estudiado desde el punto de vista práctico es 10,6 mg/g, evidencia buenas condiciones adsortivas para el ion en estudio. Es de consideración que el adsorbente propuesto es de origen mozambicano, cuyo precursor no se utiliza en ese país. Evidentemente, su comparación desde el punto de vista económico con la arcilla y la zeolita de origen nacional lo hace más caro, pero como adsorbente es mejor que los anteriores. Su comparación con el silicato amorfo hidratado refrenda su uso ya que este es más caro a partir de los reactivos de su síntesis y sus operaciones para lograr su lavado de los productos colaterales obtenidos en el proceso sintético. La alta capacidad de adsorción está dada por la alta superficie que presenta, en comparación con los adsorbentes empleados en la comparación.
CONCLUSIONES
El bagazo de caña de azúcar es un precursor adecuado para obtener carbones por vía “química” con moderadas capacidades de adsorción de iones Cd (II) en soluciones acuosas.
Los carbones activados preparados por activación “química” en condiciones operacionales de 800 oC y 120 minutos muestran los mejores resultados con respecto a la adsorción de azul de metileno.
El análisis estadístico a través de los coeficientes de determinación permite establecer una fisisorción de los iones Cd (II) acompañada de un proceso de difusión intrapartícula.
El estudio termodinámico demuestra que el modelo de Dubinin-Radushkevich es el más adecuado para explicar la adsorción de los iones Cd (II) desde soluciones acuosas al carbón obtenido de bagazo de caña de azúcar por activación “química”.