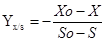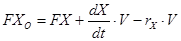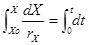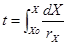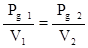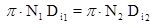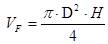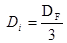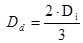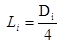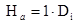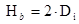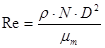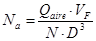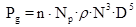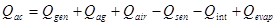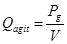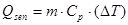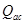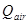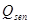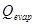Introducción
Por más de 30 años en Cuba se ha trabajado en el desarrollo de métodos biológicos para el control de roedores de importancia en la salud pública y la agricultura. Desde 1985, el Biorat se ha empleado de forma masiva en objetivos urbanos, agrícolas y pecuarios en Cuba, países de Centro América, El Caribe, América del Sur, Asia y África, sin que hasta la fecha se haya relacionado su utilización con brotes epidémicos en humanos o animales que no son objeto del control. La bacteria Salmonella enteritidis, fagotipo 6a, es el principio activo del Biorat. Está incluida en un cebo a base de arroz sin descascarar. Es monopatógena para roedores múridos y algunos integrantes de la familia Cricetidae, donde ha sido probada su inocuidad para la especie humana y otros animales.
S. enteritidis es una bacteria aislada inicialmente desde roedores, caracterizada como fagotipo 6a (PT6a), lisina negativa, sensible a muchos antimicrobianos y que presenta tres plasmidios de 59, 4 y 3 Mda. El perfil plasmidial de esta cepa fue caracterizado en el “Public Health Laboratory Service” en Colindale, Inglaterra, por el Dr. E. J. Threlfall, el cual determinó que el plasmidio de mayor peso molecular (59 Mda) contenía los genes de virulencia de (spv).1
La Planta de Biorat de Matanzas posee una tecnología obsoleta, casi todo el proceso se hace de forma manual. Sin embargo, el producto que se obtiene resulta de interés a nivel nacional e internacional y su demanda así lo demuestra. Uno de los problemas que más atenta contra la productividad de la fábrica es la necesidad de adquirir el inóculo de S. enteritidis de la Empresa Productora de Vacunas Virales y Bacterianas. Esta acción conlleva a gastos en la adquisición, transportación y almacenaje adecuado. De acuerdo con los antecedentes descritos, se impone la necesidad de diseñar un biorreactor que sea capaz de satisfacer las necesidades de esta materia prima a la industria.
Materiales y métodos
Preparación del medio de cultivo
Trasplante de la cepa
Se parte de un tubo que contiene 10 ml de medio Merezhkonski en el cual se encuentra conservada la cepa de S. enteritidis. Con una aguja larga se toma el contenido y se siembra en un erlenmeyer de 250 mL, que contienen 100 mL de medio Caldo Nutriente, añadiendo 5 mL del contenido de cepa en el erlenmeyer. A este cultivo se le realiza tinción de Gram, control de esterilidad en medio tioglicolato y caldo soya triptona, para el control del microorganismo. Luego el erlenmeyer se incuba a 37 °C durante 20 h.
Siembra en el fermentador de 50 L
Pasado el periodo de incubación del erlenmeyer con caldo nutriente se realiza observación microscópica para corroborar preliminarmente que no exista contaminación. Una vez obtenido microorganismo típico de la cepa se procede a sembrar el fermentador de 50 L que contiene caldo nutriente estéril. El cultivo se mantiene en condiciones de operación de 300 r.p.m a 37 °C.
Determinación de la cinética de crecimiento de la Salmonella
En el diseño del reactor biológico es necesario conocer del microorganismo en cuestión, los parámetros cinéticos, o sea, el comportamiento en la formación de biomasa, el consumo de sustrato, el rendimiento de biomasa y la velocidad especifica de crecimiento.
Para la obtención de los parámetros cinéticos del cultivo de Salmonella, se utiliza una cepa liofilizada y certificada del cepario de la Empresa Productora de Vacunas Virales y Bacterianas, pertenecientes al Grupo Empresarial Labiofam. Con el objetivo de reproducir al microorganismo fue inoculado el biorreactor de 50 L, con dicha cepa a 37 °C por 24 h. Luego se siembra en Agar verde brillante, un medio diferencial, donde las colonias que presentaron las características morfológicas típicas de Salmonella fueron replicadas en el mismo medio, hasta obtener un cultivo puro.2,3
Para la realización de la cinética se toma asépticamente muestras de 10 mL desde 0 h a 5 h con una frecuencia de 0,5 h. Las muestras se centrifugaron a 5 000 r.p.m. por 10 min, para separar la biomasa del sobrenadante.4
La concentración de biomasa se establece por peso seco.5 En el sobrenadante se determina la concentración de proteínas totales mediante la técnica espectrofotométrica de Lowry.6 En el cálculo del rendimiento de biomasa (Yx/s) y el consumo de sustrato (CS) se emplean las ecuaciones siguientes, respectivamente.7
El crecimiento microbiano fue estudiado y modelado según la ecuación de Monod para un sistema discontinuo.8 La ecuación de Monod, relaciona la velocidad máxima de crecimiento con la concentración del sustrato limitante, la que se expresa como: 9-12
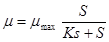 (3) donde: X = Concentración final de biomasa. (g/L) X = Concentración inicial de biomasa. (g/L) S = Concentración final de proteínas totales. (g/L) S= Concentración inicial de proteínas totales. (g/L) = Velocidad específica de crecimiento. (h) = Velocidad específica máxima de crecimiento. (h) Ks = Constante de saturación. (g/L)
(3) donde: X = Concentración final de biomasa. (g/L) X = Concentración inicial de biomasa. (g/L) S = Concentración final de proteínas totales. (g/L) S= Concentración inicial de proteínas totales. (g/L) = Velocidad específica de crecimiento. (h) = Velocidad específica máxima de crecimiento. (h) Ks = Constante de saturación. (g/L)El valor μ máx y la constante de saturación Ks se obtiene por el método del reciproco, a partir de la gráfica de 1/μ contra 1/S, aplicado a los datos experimentales.13 El inóculo de Salmonella tiene una titulación de 2 x 109 UFC/mL según PNO - 08-01-002. 2010 2, para esto se realiza la concentración de microorganismos mediante una cámara Neubauer de un área de 0,002 5 mm2 y una profundidad de 0,1 mm 7, junto con un microscopio Olympus, Tailandés.
Diseño del biorreactor
Tiempos de fermentación
En el diseño del biorreactor son utilizadas las modelaciones matemáticas y las técnicas de escaldo industrial. La primera parte de la investigación se realiza experimentalmente a nivel de banco, en un biorreactor de 50 L (fig.1) de capacidad, dotado de los elementos necesarios para el posterior escalado a otro de 150 L. En el mismo se le determina el tiempo de fermentación del microorganismo. Según el balance de biomasa se llega a: 14
Esta ecuación es ajustada a un biorreactor discontinuo, donde FX0 = FX = 0, los volúmenes se mantienen constantes y considerando que no hay muerte celular, la ecuación de balance para el crecimiento microbiano será:
expresada en velocidad especifica de crecimiento (µ)
queda para una biorreacción en que cumpla con la ecuación de Monod:
 (8) siendo: F = Velocidad del flujo volumétrico del medio. (m/h) r= Velocidad de duplicación. (g/L h) t = Tiempo de fermentación. (h)
(8) siendo: F = Velocidad del flujo volumétrico del medio. (m/h) r= Velocidad de duplicación. (g/L h) t = Tiempo de fermentación. (h)Ya establecido el tiempo de fermentación y las relaciones de magnitudes en el reactor modelo o banco, se busca los criterios de escalado más apropiado para el caso de estudio. En el sistema se mantiene el principio de semejanza entre el modelo y el prototipo, pero en procesos biológicos es necesario además un criterio de escalado, que asegure el funcionamiento exitoso del prototipo, y este criterio seria el régimen de cambio entre ambas escalas.15
Para este caso el criterio de escaldo que marca el régimen de cambio es el de potencia consumida por el agitador por unidad de volumen del cultivo (Pg/V), donde para que sea llevado a efecto en la práctica existe la relación:
siendo:
Pg 1 = Potencia consumida por el sistema aireado del biorreactor modelo. (W)
Pg 2 = Potencia consumida por el sistema aireado del biorreactor prototipo. (W)
V1 = Volumen del biorreactor modelo. (m3)
V2 = Volumen del biorreactor prototipo. (m3)
Dimensionamiento del biorreactor
Para el cálculo del dimensionamiento hay que tener en cuenta el espacio disponible en la planta. Las dimensiones se calcula con una relación de altura - diámetro (H:D) de 2:1 mediante la siguiente ecuación: 16
Dimensionamiento de los impulsores
Los impulsores son cuchillas planas tipo Roushton, por lo que sus dimensiones se calculan con las ecuaciones siguientes:
Se necesita que los impulsores estén ubicados estratégimente dentro del biorreactor.
 (18) donde: V= Volumen del biorreactor. (m) H = Altura. (m) D = Diámetro del biorreactor. (m) D = Diámetro del impulsor. (m) A = Ancho de las cuchillas. (m) D = Diámetro del disco. (m) L= Longitud de las cuchillas, desde el impulsor al primer cojinete. (m) H = Distancia entre el fondo del biorreactor al primer agitador. (m) H = Distancia del primer agitador al segundo agitador. (m) H = Distancia del segundo agitador al tercer agitador. (m)
(18) donde: V= Volumen del biorreactor. (m) H = Altura. (m) D = Diámetro del biorreactor. (m) D = Diámetro del impulsor. (m) A = Ancho de las cuchillas. (m) D = Diámetro del disco. (m) L= Longitud de las cuchillas, desde el impulsor al primer cojinete. (m) H = Distancia entre el fondo del biorreactor al primer agitador. (m) H = Distancia del primer agitador al segundo agitador. (m) H = Distancia del segundo agitador al tercer agitador. (m)Para el completamiento del diseño de un biorreactor prototipo se debe estimar el consumo de potencia de agitación y los calores involucrados en el proceso. Conociendo los calores que intervienen en la fermentación se puede conocer la masa del agente de calentamiento para mantener 37 °C en el medio de cultivo.17
La potencia consumida para la agitación
Las relaciones de escalado son significativamente simples cuando se escala con semejanza geométrica y cuando el régimen de flujo del reactor de menor escala es completamente turbulento. El número de Reynolds para reactores agitados mecánicamente se define por la ecuación siguiente: 15
El régimen de transición de laminar a turbulento ocurre cuando Re ≈ 100 y el régimen turbulento ocurre cuando Re ≥ 1 000. La mayoría de los reactores agitados a escala industrial operan en régimen turbulento completamente desarrollado.
La mayoría de los procesos fermentativos discontinuos necesitan de un sistema de agitación. Para estimar la potencia en un sistema aireado se hace uso de un módulo adimensional llamado número de aireación (Na). Este módulo se define como el cociente entre la velocidad superficial del gas y la velocidad tangencial en el extremo del impulsor. El valor de Na indica el grado de dispersión de las burbujas alrededor del impulsor.17
Para el cálculo de la potencia se emplea la relación entre el número de potencia (Np) y Na, se obtiene mediante la existencia de correlaciones empíricas para cada tipo de agitador (fig. 2).
Calor disipado por el agitador
Energía disipada por el agitador, se formula como la energía específica que suministra el agitador, para una velocidad de giro dada:
Calor intercambiado con la chaqueta
Por medio de un balance de calor en el sistema de proceso fluido térmico en la chaqueta se llega a la siguiente expresión.
Calor sensible
La temperatura del medio de cultivo debe permanecer constante en 37 °C. El calor para alcanzar la temperatura deseada se expresa en la ecuación:
Cantidad de agua
Realizando un balance para el agua de enfriamiento, el flujo másico de agua se puede obtener con la ecuación siguiente:
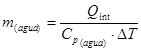 (26) donde: Q= Velocidad de acumulación de calor. (kcal/h) Q= Velocidad de generación de calor debido agitación. (kcal/h) Q= Velocidad de generación por aireación. (kcal/h) Q = Velocidad de pérdida de calor por evaporación. (kcal/h) Q = Velocidad de generación de calor metabólico. (kcal/h) Q= Velocidad de intercambio de calor en el biorreactor. ( kcal/h) Q = Velocidad de generación de calor sensible. (kcal/h) U = Coeficiente global de transferencia de calor. (kW/mºC) ΔT = Diferencia media de temperatura entre el medio de cultivo y el medio de enfriamiento. (°C) A = Área de transferencia de calor. (m) C = Capacidad calórica (kcal/kg ºC) m = Masa
(26) donde: Q= Velocidad de acumulación de calor. (kcal/h) Q= Velocidad de generación de calor debido agitación. (kcal/h) Q= Velocidad de generación por aireación. (kcal/h) Q = Velocidad de pérdida de calor por evaporación. (kcal/h) Q = Velocidad de generación de calor metabólico. (kcal/h) Q= Velocidad de intercambio de calor en el biorreactor. ( kcal/h) Q = Velocidad de generación de calor sensible. (kcal/h) U = Coeficiente global de transferencia de calor. (kW/mºC) ΔT = Diferencia media de temperatura entre el medio de cultivo y el medio de enfriamiento. (°C) A = Área de transferencia de calor. (m) C = Capacidad calórica (kcal/kg ºC) m = MasaResultados y discusión
Determinación de la cinética de crecimiento de la Salmonella
A las 24 h de realizada la prueba, se obtiene un cultivo del microorganismo en Agar verde brillante. Mediante la siembra sucesiva por estriado simple se obtiene un cultivo puro del aislamiento. Las características morfológicas de las colonias de Salmonella son: colonias de forma redondeadas, de color rojas o rosadas.
Durante el tiempo de operación de la fermentación fue monitoreado la concentración de biomasa y el consumo de sustrato contra el tiempo. Después de 4 h de fermentación, la densidad óptica se mantuvo constante y el pH alcanzó el valor de 7,2. Se evaluó el rendimiento de biomasa y el consumo de sustrato. En la tabla 1 se observa los parámetros estudiados.
Tabla 1 Parámetros de la cinética de crecimiento de Salmonella enteritidis en biorreactor de 50L
| Parámetros | Valores | Unidad | |
|---|---|---|---|
| X0 | Concentración de biomasa inicial. | 0,45 | g/L |
| X | Concentración de biomasa final. | 1,92 | g/L |
| S0 | Concentración de sustrato inicial. | 8,02 | g/L |
| S | Concentración de sustrato final. | 3,96 | g/L |
|
|
Velocidad especifica máxima de crecimiento. | 0,753 | h-1 |
| Ks | Constante de saturación. | 0,383 | g/L |
| Yx/s | Rendimiento celular en base al sustrato. | 0,362 | __g célula__ g sustrato |
| Cs | Consumo de sustrato. | 50,62 | % |
Diseño del reactor biológico
Tiempos de fermentación
El modo de operación escogido fue discontinuo (batch) debido a las ventajas que ofrece, entre las que se pueden destacar: su fácil manejo y construcción y la minimización de los riesgos de contaminación por microorganismos externos.18,19 Como se puede apreciar en la tabla 1 la Ks es despreciable con respecto a la concentración de sustrato inicial, por lo que según Doran 2013, μ = máx, quedando el tiempo de fermentación en 3,35 h. El tiempo de fermentación calculado es semejante al tiempo real de fermentación en la industria como se refleja en Tecnología de producción del rodenticida Biológico Biorat.1
En la tabla 2 se muestran el dimensionamiento del biorreactor diseñado.
Tabla 2 Resultados del diseño del biorreactor prototipo
| Elemento | Valores | Unidades | |
| V | Volumen del fermentador | 0,150 | m3 |
| DF | Diámetro del fermentador | 0,444 | m |
| H | Altura | 0,971 | m |
| Di | Diámetro del impulsor | 0,148 | m |
| Ai | Ancho de las cuchillas | 0,029 | m |
| Dd | Diámetro del disco | 0,098 | m |
| Li | Longitud de las cuchillas | 0,037 | m |
| Ha | Distancia entre el fondo del fermentador al primer agitador. | 0,148 | m |
| Hb | Distancia del primer agitador al segundo agitador. | 0,296 | m |
| Hc | Distancia del segundo agitador al tercer agitador. | 0,444 | m |
| Nb | Número de |
4 | U |
El sistema de agitación del biorreactor es de turbina tipo Rushton de seis hojas planas, para asegurar homogeneidad en todo el volumen de trabajo. Se emplean tres turbinas a lo largo del eje de agitación, las cuales se encuentran ubicadas de manera equidistantes. Así mismo, cuenta con cuatro baffles con la finalidad de mejorar el sistema de agitación y facilitar la limpieza.20
Velocidad de agitación y potencia consumida por el agitador
Para lograr que no exista muerte celular por agitación excesiva, es necesario calcular la velocidad de agitación para el biorreactor prototipo. Teniendo en cuenta la ecuación (10) la velocidad de agitación calculada para el prototipo fue de 168 r.p.m.
El número de potencia es de 1,8 según fig. 2, pero como el biorreactor modelo no cumple con las relaciones de magnitudes estándares para agitadores de turbina de hojas planas, por lo que el Np de trabajo se obtiene mediante la ecuación siguiente:
 (27) siendo: N = Número de potencia de trabajo. (adimensional) N´ = Número de potencia calculado. (adimensional) I = Ancho de los baffles.
(27) siendo: N = Número de potencia de trabajo. (adimensional) N´ = Número de potencia calculado. (adimensional) I = Ancho de los baffles. El número de potencia de trabajo del biorreactor prototipo fue de 1,53. En la tabla 3 se muestra los valores de Velocidad de agitación y potencia consumido entre el modelo y el prototipo.
Balance de calor
Los resultados de los valores de los calores involucrados en el proceso de fermentación se relacionan en la tabla 4:
Tabla 4 Calores involucrados en el proceso de fermentación
Cantidad de agua de calentamiento
El flujo másico de agua se calculó utilizando un 10 % de pérdida de calor.21 La cantidad de agua es de 4,8 m3/h, este flujo de agua será capaz de mantener la temperatura a 37 °C durante la fermentación.
Conclusiones
Se diseñó un biorreactor de 150 L de capacidad empleando la técnica de escaldo Potencia del motor por unidad de volumen del medio. La velocidad específica máxima de crecimiento de la salmonella enteritidis se comportó con un valor de 0,753 h-1, una contante de saturación de 0,383 g/l. El rendimiento celular en base al sustrato de 0,362 g células/g sustrato y un consumo de sustrato de un 50,02 %. Se dimensionó el biorreactor prototipo para su construcción y se propuso un modelo diseñado por la empresa globo inox. El tiempo de fermentación de la salmonella enteritidis fue de 3,35 h, tiempo muy semejante al que normalmente transcurre en la industria. La velocidad de agitación que se obtuvo del biorreactor fue de 168 rpm con una potencia consumida de 11,01W. El volumen de agua para calentamiento durante el proceso de fermentación fue de 4,8 m3