Introducción
La contaminación del agua constituye un problema ambiental a nivel mundial, la mayor preocupación de la calidad del agua es la presencia de metales pesados, procedentes de diversas fuentes antropogénicas como la industrialización, el crecimiento demográfico y el uso de diversos materiales y/o productos químicos, que causan daños tanto a la salud humana como al ambiente.1 A esta problemática se suma que la propuesta de tratamiento para la eliminación de los mismos requiere de la caracterización de las aguas para tener conocimiento de las interacciones que puedan tener los mismos en función de la composición de medio.
En Cuba, se estudian y desarrollan métodos para disminuir o eliminar la contaminación de sistemas de abasto hídrico con alto contenido metálico. Para el tratamiento de aguas contaminadas y en específico para la remoción de metales pesados, actualmente se utilizan métodos como el intercambio iónico, la ósmosis inversa y la precipitación, pero estos procesos son muy costosos en su operación y mantenimiento; en este sentido, la adsorción ha sido objeto de muchas investigaciones, las cuales han demostrado que este proceso permite disminuir las concentraciones de iones de metales pesados, no biodegradables, ser altamente tóxicos y poseer efectos carcinogénicos 2, tales como: Cd2+, Cr6+, Zn2+, Hg2+, Pb2+, Mn2+ entre otros, ya que es un método preciso, altamente efectivo y económico, donde su aplicación permite la utilización de sólidos adsorbentes de bajo costo procedentes de los residuales generados en operaciones industriales o agrícolas.
El empleo de biomasas para el tratamiento de aguas contaminadas con metales pesados permite utilizar materiales como la corteza y hojas de coníferas, la cáscara de arroz, el bagazo de caña de azúcar, la piel de naranja, algas, hongos, entre otros.3
Por lo anteriormente expuesto, en este trabajo se evaluó la capacidad de adsorción de iones Mn2+ por biomasa residual de la caña de azúcar en muestras de agua de La Laguna Azul, en la localidad de El Cobre en Santiago de Cuba. Para esto, se realizó la caracterización de una estación de monitoreo situada en un extremo del reservorio acuático, teniendo en cuenta la facilidad de acceso al mismo.
Materiales y métodos
Se utilizaron los materiales y equipos disponibles en el Laboratorio de Química-Física y Adsorción del Departamento de Química de la Facultad de Ciencias Naturales y Exactas de la Universidad de Oriente y el Laboratorio de minerales de la Empresa Geominera Oriente. La preparación de soluciones para ensayos químicos se realizó según el Standard Methods.4
Ubicación del punto de muestreo
Se efectuaron tres muestreos entre los meses de mayo y junio de 2017 y febrero de 2018, teniendo en cuenta las variaciones climáticas del territorio. Todos los análisis se realizaron por triplicado. La toma de muestra fue superficial. La localización del punto se realizó según la metodología establecida en las Normas ISO 5667-1 5, 5667-3 6 y 5667-10.7
Muestreo y conservación de muestras
Para recolectar las muestras se utilizaron envases de plástico de 5 L de capacidad. La toma y conservación de las mismas, se realizó mediante la metodología establecida en el Standard Methods. La temperatura se determinó in situ.4
Normativa para el análisis de los resultados
Los parámetros físico-químicos determinados a las aguas de la Laguna Azul, fueron comparados con la norma cubana NC: 1021-2014 “Higiene comunal. Fuentes de abastecimiento de agua. Calidad y protección sanitaria”.8
Parámetros analizados a las muestras de agua
A las muestras analizadas se les determinó: pH, Conductividad eléctrica (λ), Na+ , K+ , SO4 2- y Metales, utilizando las técnicas y métodos establecidos en el Standard Methods.4 Para el análisis estadístico se usa el Statgraphics 2007 para Windows.9
Determinaciones a la biomasa de caña de azúcar
Se emplearon muestras de bagazo del CAI América Libre, municipio Contramaestre, Provincia Santiago de Cuba. Las mismas se depositaron en bolsas plásticas a 5 °C para evitar la proliferación de microorganismos que degradan el material y luego fueron acondicionadas previamente a los estudios; se secaron a 105 °C hasta peso constante y se homogeneizaron moliendo en un molino de cuchillas y después tamizando para obtener fracciones de tamaño de partícula: 0,074 mm; 0,350 mm; 0,177 mm y 0,500 mm.
Contenido de humedad real (% h.r)
Se colocó una masa pesada del residual en la estufa (1 h a 105 °C). Por diferencia de masa se determinó la humedad real del residual.
Contenido de cenizas (materia inorgánica)
Se colocó una masa pesada del residual en la mufla a 550 °C durante 1 h y luego por diferencia de masas se determinó el % cenizas.
Contenido de materia orgánica (% m.o)
El % de materia orgánica se determinó restando a 100 el porciento de cenizas. Se pesaron 2 g de bagazo y se le añadieron 100 mL de H2O destilada en un vaso de precipitado de 250 mL, luego la mezcla fue agitada bruscamente y dejada en reposo 5-10 min. Después se le midió el pH con un pH - metro.
Selección del pH de adsorción
Los experimentos de adsorción fueron realizados por triplicado en erlenmeyer de 250 mL de capacidad, utilizando 0,5 g/L de biomasa seca de 0,500 mm de tamaño de partícula y un nivel de concentración de Mn2+ de 5,0 mg/L, con agitación en zaranda horizontal a 150 rpm durante 1 h a temperatura ambiente.
Soluciones de Mn2+
Fueron preparadas a partir de una solución estándar de 1,0 g/L en volumétricos de 100 mL. Para el ajuste del pH en el intervalo de estudio (2 - 6 unidades) fueron realizadas adiciones de soluciones diluidas de HCl 0,01 mol/L e NaOH 0,01 mol/L. La solución sobrenadante, luego de finalizado el experimento, se filtró para separar los sólidos que pueden interferir. Los filtrados se conservaron a 4 ºC hasta posterior lectura.1
Selección del tamaño de partícula
Para la evaluación de la influencia del tamaño de partícula en la remoción de los iones Mn2+, previamente se realizó un análisis de la granulometría utilizando un tamizador con tamices de tamaños de partícula: 0,074 mm; 0,350 mm; 0,177 mm y 0,500 mm.
Selección de la masa de adsorbente
La selección de la masa de adsorbente adecuada en la remoción del ion objeto de estudio fueron de 0,25 y 0,5 g de biomasa seca en 50 mL de solución del analito a temperatura ambiente, con agitación en zaranda a 150 rpm y 6 h. Dicha experiencia se realiza aplicando los valores adecuados de pH y granulometría del adsorbente obtenidos en los experimentos anteriormente explicados, a un nivel de concentración de Mn2+ de 5,0 mg/L. La solución sobrenadante, luego del experimento, es filtrada de igual forma que en experimentos anteriores.
Selección del tiempo de contacto
Para conocer el tiempo adecuado de adsorción, se realizaron experimentos, teniendo en cuenta los valores obtenidos de los parámetros anteriores, pero en los siguientes tiempos 15, 30, 45, 60, 90 y 120 min en las mismas condiciones de agitación y nivel de concentración del Mn2+.
Activación química de la biomasa con soluciones de NAOH Y H3PO4
Los agentes de activación química más utilizados son el ZnCl2, H3PO4, NaOH y KOH. El ZnCl2 ha sido desplazado por el ácido fosfórico por problemas de corrosión, bajos rendimientos y presencia de zinc residual en el producto final. Las biomasas tratadas con estos agentes son generalmente mesoporosas, de baja densidad y poca resistencia a la abrasión. Para la activación química de la biomasa, fueron utilizadas disoluciones concentradas de H3PO4 e NaOH, impregnándola por 24 h y luego filtrada y secada a 105 oC.
Resultados y discusión
Los parámetros analizados en la caracterización físico - química y evaluación de las aguas de la Laguna Azul se reportan a continuación (tabla 1). Teniendo en cuenta las normas vigentes para la clasificación de las mismas se procede a la interpretación de estos valores.
Tabla 1 Valores medios obtenidos de los parámetros de caracterización por muestreo
| Muestreos | pH | λ (mS.cm-1) | SO4 2- (mg/L) | K+ (mg/L) | Na+ (mg/L) |
|---|---|---|---|---|---|
| 1 (Mayo-2017) | 4,37 | 18,27 | 8 200 | 5,58 | 52,52 |
| 2 (Junio 2017) | 4,41 | 18,31 | 9 350 | 5,58 | 59 |
| 3 (Febrero 2018) | 4,49 | 19,26 | 10 350 | 6,43 | 60,07 |
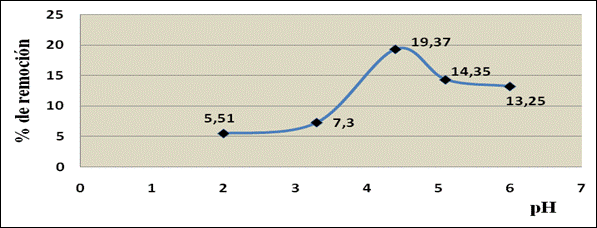
El valor de pH del agua tiene influencia en muchas reacciones que tienen lugar en el seno de la misma. En aguas neutras o ligeramente alcalinas predomina la eliminación de oxígeno, mientras que en aguas ácidas domina la evolución de burbujas de hidrógeno.10 Los valores de este parámetro en las muestras analizadas oscilan entre 4,37 y 4,49 unidades, lo que permite clasificar estas aguas con un carácter ácido, relacionado con el proceso tecnológico asociado al beneficio de las menas metálicas. Los resultados obtenidos se encuentran por encima de los límites máximos admisibles en la NC: 1021-2014.
Los electrolitos disueltos en las aguas hacen que estas sean más conductoras, a medida que sea mayor la concentración de los mismos, ya que entra en juego las interacciones iónicas; por tanto, en principio, debe existir una relación directa entre conductividad del agua y los electrolitos disueltos. Los valores de conductividad en estas muestras oscilan entre (18,27 - 19,26 mS.cm-1) lo que puede estar asociado a los procesos de extracción y lixiviación de sales minerales en la zona estudiada.
Los valores obtenidos están entre 8 200-13 050 mg/L lo que evidencian que dichas aguas presentan elevados valores encontrándose por encima de la Concentración Máxima Admisible 400 mg/L según la NC 1021:2014. La causa puede ser consecuencia del proceso de lixiviación con ácido sulfúrico. Por otro lado, dado a fenómenos mineral o químicos pueden estar presentes minerales que aporten sulfatos tales como el Yeso (CaSO4.2H2O) y la Epsomita (MgSO4.7H2O), o por procesos oxidativos de la Calcosina (Cu2S) y/o Calcopirita (CuFeS2), que originen el CuSO4 y todos ellos, por procesos de lixiviación natural con aguas de lluvia incrementen considerablemente la concentración.
El sodio forma sales solubles en agua con muchos aniones, la principal el NaCl. Las sales que generan el potasio son más solubles que las del sodio y a estas concentraciones no son considerados como tóxicos. Teniendo en cuenta los resultados, se detectaron concentraciones de K+ (5,58 - 6,43 mg/L) y Na+ (52,52-60,07 mg/L) y puede deberse a la presencia de sales inorgánicas relacionadas con la topografía del terreno.
Los metales son especies químicas no degradables fácilmente, experimentando transformaciones que dependen de diferentes factores como pH, potencial redox, temperatura y debido a diferentes procesos pueden distribuirse entre los entornos aire - agua - suelo, ya sea cambiando su estado de oxidación o incorporándose a los seres vivos. En la tabla 2 se muestran los valores de la concentración de metales totales mayoritarios analizados en los muestreos realizados, y evidencian que estas aguas se pueden considerar polimetálicas, por los elementos que la constituyen y su alta concentración, destacándose como mayoritarios el Cu2+, Al3+ y Mn2+.
Tabla 2 Concentraciones medias determinadas y reportadas en la NC: 1021-2014
| Muestreo | Cu2+(mg/L) | Al3+(mg/L) | Zn2+(mg/L) | Mn2+(mg/L) |
|---|---|---|---|---|
| 1 (Mayo-2017) | 43,36 | 5,428 | 3,712 | 5,428 |
| 2 (Junio 2017) | 42,15 | 5,304 | 3,786 | 5,304 |
| 3 (Febrero 2018) | 41,75 | 5,112 | 3,573 | 5,401 |
| NC:1021-2014 | 2.0 | 0.2 | 5.0 | 0.1 |
Caracterización de la biomasa
Según sus propiedades organolépticas, el residual posee olor a guarapo, un ligero sabor dulce y color blanco amarillento.
Tabla 3 Valores promedios de los análisis del material adsorbente (biomasa)
| Valores | % H.R | % cenizas | % M.O | pH (U) |
|---|---|---|---|---|
| Promedio | 7,26 ± 0,22 | 1,53 ± 0,12 | 98,47± 0,12 | 4,84 ± 0,18 |
Los resultados del análisis para el bagazo proporcionaron un contenido de cenizas bajo acorde a la bibliografía consultada para este tipo de biomasa 11, lo cual justifica su empleo para la adsorción de metales pesados. El porcentaje de humedad real del bagazo fue de 7,26 %. A pesar de ser un factor que potencia la adsorción sobre los sitios activos disponibles presentes en la superficie del residual tratado, el contenido de agua superficial puede crear una doble capa eléctrica 11 a través de interacciones, donde la última capa tendrá carga parcial positiva, lo que implica el aumento de repulsión entre los sitios activos de la superficie de la biomasa y la carga del catión estudiado.
Los resultados del análisis del contenido de materia orgánica reportan un valor promedio de 98,47 % (tabla 3); valor consecuente con las características de un material lignocelulósico.2) Según el valor promedio de pH (4,84 unidades), se demuestra el carácter ácido de la biomasa. Esto puede deberse a que los azúcares presentes en el material son susceptibles a procesos de fermentación, formándose una mezcla de ácidos carboxílicos, aldehídos y cetonas.12
Las propiedades físicas de los adsorbentes son fundamentales como criterio para la selección de diferentes materiales y la posible aplicación de los mismos, ya sea en su utilización para minimizar el impacto perjudicial de metales pesados en cuerpos de agua o como rellenos en columnas de lecho fijo.13
Influencia del ph en el proceso de adsorción
El pH es el parámetro más importante a tener en cuenta en el proceso de bioadsorción, ya que afecta la solubilidad de los metales o la activación de los grupos funcionales en la biomasa, esto es debido a la posibilidad de que los grupos aminos, amidas, hidroxilos y grupos carboxilos que pueden estar protonados o no, dependiendo del pH de la solución en contacto.14 Debido a esto, la interacción de los cationes metálicos con los sitios de unión de la biomasa es muy sensible a los valores de éste parámetro. Se ha demostrado que éste puede modificar la adsorción de los metales dependiendo del tipo de biomasa y del adsorbato empleado.13-15 La figura 1 muestra el comportamiento del proceso de adsorción de Mn2+ con respecto al pH. En el mismo puede observarse el efecto explicado en este proceso. El pH es responsable (como parámetro) de la especiación del metal en la solución, la cual puede cambiar dependiendo de su valor.1
Selección del tamaño de partícula
Una vez procesado el sólido mediante un molino de cuchillas, se procedió al tamizado utilizando un vibrador con tamices de tamaños de partícula: 0,074 mm; 0,350 mm; 0,177 mm y 0,500 mm. Teniendo en cuenta la cantidad de sólido obtenido y los reportes de literatura 16 se seleccionó la fracción de 0,074 mm para la realización de los experimentos de adsorción.
Influencia de la masa de adsorbente en el proceso de adsorción
Los experimentos para la selección de la masa de adsorbente en la remoción del ion objeto de estudio, se realizaron según se reporta en materiales y métodos. En la tabla 4 se muestran los resultados de dichos experimentos.
El análisis estadístico se sustenta en una comparación de medias. La prueba F no arroja diferencias significativas entre las dispersiones de los conjuntos de valores, puesto que el valor de la probabilidad (0,273 6) es mayor que el nivel de significación (α = 0,05). El valor de la probabilidad (0,000 2) de la t-Student es menor que el nivel de significación (α = 0,05) lo que indica que las relaciones masa/volumen son diferentes para un 95 % de confianza. Como se evidencia, al valor de 0,50 g de adsorbente en 50 mL de disolución se observan los mayores valores de % de remoción, siendo el valor más adecuado. La relación masa/volumen es un factor que, desde el punto de vista práctico, puede obstaculizar el proceso, ya que la densidad del sólido es baja y lógicamente ocupa un gran volumen.
Influencia del tiempo de contacto en el proceso de adsorción
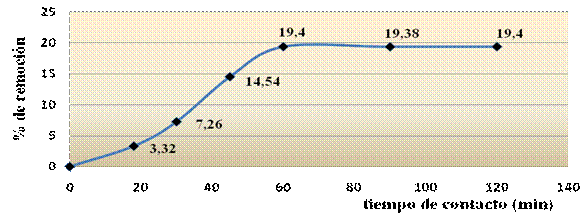
La figura 2 muestra el comportamiento del proceso de adsorción como función del tiempo de contacto.
Se observa un aumento de la adsorción con el transcurso del tiempo hasta 60 min. A partir de aquí, no se aprecia aumento del % de remoción y se adsorbe el 19,4 % de Mn2+, alcanzando rápidamente el equilibrio. Los resultados sobre el tiempo necesario para alcanzar el equilibrio se relacionan con los reportados en la literatura, aún cuando algunos autores reportan que a partir de los 180 s el proceso de adsorción de metales sobre sólidos adsorbentes tiende al equilibrio.17 De estos resultados se puede inferir que la retención de Mn2+ puede ser por la interacción con grupos funcionales localizados en la superficie del adsorbente.
Influencia de la activación química de la biomasa con soluciones de NAOH y H3PO4
Las características visuales finales de la biomasa activada son diferentes de sus características iniciales; acentuando así el color amarillo y la suavidad en la textura en el tratamiento con el NaOH y llegando prácticamente a la carbonización de la materia orgánica con apariencia y color negro característico del carbón vegetal cuando se utiliza H3PO4. Una vez lavadas las biomasas activadas con agua destilada y secada a 105 oC, se procede a los experimentos de adsorción, tomando los valores adecuados obtenidos de los parámetros estudiados anteriormente.
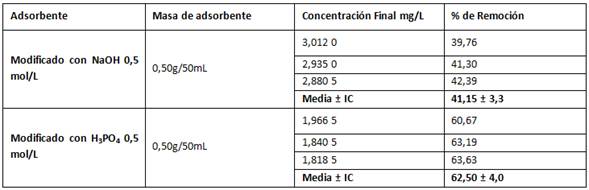
El análisis estadístico indica que existen diferencias significativas entre las medias de los % de remoción para cada tratamiento con 95 % de confiabilidad, siendo el p-valor menor (0,000 033) que 0,05 asumiendo igualdad de varianza en ambas muestras. En tal sentido, el nivel de concentración de Mn2+ es de 5 mg/L que bajo las condiciones estudiadas el biomaterial es capaz de alcanzar un porcentaje de remoción del 62,50 %, a diferencia de la tratada con hidróxido de sodio que es capaz de remover solo el 41,15 %. (tabla 5). De estos resultados se puede inferir una posible modificación de la estructura de la biomasa pudiendo tener mayor abertura de poros, existencia de nuevas cavidades porosas pro-tratamiento o activación de nuevos grupos funcionales.
Estudio del proceso adsorción en una matriz real
De la evaluación de la remoción de Mn2+ por la biomasa estudiada en muestras de agua de la Laguna Azul del Cobre, se alcanzan valores de 5,31 % para la biomasa natural, 33,36 % para la tratada con NaOH y 58,42 % para la tratada con H3PO4. Estos valores son inferiores a los logrados con disoluciones sintéticas. Esto puede estar relacionado con las características polimetálicas del agua, en las que se encuentran presentes iones Cu2+, Zn2+, Al3+, Na+, K+ y NH4 + entre otros con radio iónicos semejantes o menores que pueden competir con Mn2+, y deben ocupar los sitios activos del sólido dando como resultado una menor capacidad de adsorción de Mn2+.
La cantidad de Mn2+remanente en el agua (2,1 mg/L) luego del proceso de adsorción todavía es superior a los límites máximos permisibles (0,4 mg/L) para las fuentes de abastecimiento superficiales y de los establecidos (<1,0 mg/L) según procedimientos tecnológicos. 5 No obstante, los resultados obtenidos en este trabajo evidencian que el bagazo de caña de azúcar modificado tiene potencialidades para la remoción de Mn2+en solución, por lo que podría emplearse como una alternativa de tratamiento para minimizar el impacto sobre los reservorios acuáticos.
Consideraciones del proceso de adsorción estudiado
La bioadsorción de iones metálicos puede modelarse utilizando el Modelo de Langmuir, en el cual el aumento del consumo de metal por la biomasa alcanza el equilibrio en función de la saturación de los sitios activos, con formación de una monocapa. La adsorción de adsorbatos por los constituyentes del adsorbente ocurre por interacciones entre la superficie activa del adsorbente y el adsorbato.18 La isoterma de adsorción es un modelo no lineal basado en un equilibrio de primer orden, donde el metal adsorbido forma una monocapa en la superficie homogénea del sólido y todos los sitios de unión tienen una energía uniforme de adsorción sin interacción entre las moléculas del adsorbentes.19 La tabla 6 muestra los parámetros del modelo de Langmuir y el coeficiente de correlación para la bioadsorción de Mn2+.
Tabla 6 Parámetros de ajuste del modelo de adsorción de Langmuir
| Metal | pH | Langmuir | ||
|---|---|---|---|---|
| K d | q m(mg/g) | r2 | ||
| Mn2+ | 4,30 | 0,894 0 | 0,432 5 | 0,970 2 |
La capacidad máxima de adsorción del metal (qm) alcanza un valor de 0,432 5 mg/g a un valor de pH de 4,30 unidades. Por el comportamiento gráfico del proceso de adsorción según el modelo linealizado de la isoterma se obtiene la constante de adsorción. El valor obtenido del coeficiente de correlación indica el grado de ajuste de los datos experimentales al modelo matemático utilizado. Según este valor, puede decirse que el modelo de Langmuir explica satisfactoriamente el proceso de adsorción estudiado.20
Conclusiones
El bagazo de la caña de azúcar utilizado fue caracterizado química-físicamente y los valores obtenidos evidencian las posibles utilidades como material adsorbente de iones de metales, acorde a reportes de literatura para este tipo de material. Se alcanzan los mayores niveles de % de adsorción de Mn2+ a valores de pH de 4,3 unidades, tiempo de contacto de 1 hora y masa de adsorbente de 0,5 g de adsorbente seco en 50 mL de disolución patrón de Mn2+. Existen diferencias estadísticamente significativas en los porcientos de remoción de Mn2+con la biomasa al estado natural y modificada con agentes químicos en una matriz real ya que es capaz de remover el 5,31 % de Mn2+en condiciones naturales, el 33,36 % una vez tratada con hidróxido de sodio y el 58,42 % bajo tratamiento con ácido fosfórico